2-肼基-4-氯苯并噻唑类席夫碱的合成与表征*
2021-02-25吴利欢黄耀锋陈丽雅张华鑫
吴利欢,黄耀锋,陈丽雅,张华鑫,李 湘
(肇庆学院 环境与化学工程学院,广东 肇庆526060)
席夫碱因具有良好的杀菌性、抗病毒、抗肿瘤等生物活性而应用于医药领域[1],此外,席夫碱还在催化[2]、荧光探针[3]和网络材料[4]等方面有广泛的应用。苯并噻唑类化合物具有刚性的平面结构和大范围的π 共轭体系,广泛应用于农药、医药[5]、荧光探针[6]和荧光发光材料[7]等领域。近年来,人们利用苯并噻唑良好的光化学性能和稳定的配位性能制备苯并噻唑衍生物的荧光探针,利用荧光探针与某些离子配位络合反应后对荧光强度的影响来定性或定量检测离子。荧光探针可以不需要昂贵的大型仪器,只需用荧光分光光度计即可检测离子浓度,是一种简便、快捷、准确度高的检测方法。因此,合成含有苯并噻唑的席夫碱对开发新型荧光探针具有重要的研究意义。
本文以2-氨基-4-氯苯并噻唑为原料,在酸催化作用下与水合肼发生缩合反应生成中间体2-肼基-4-氯苯并噻唑(1),然后与芳香醛(或酮)作用,生成一系列新型4-氯-2-肼基苯并噻唑类席夫碱3a~3d,此类化合物具有明显的荧光效果,为进一步开发新型荧光探针提供实验参考,设计的合成路线见Scheme 1。
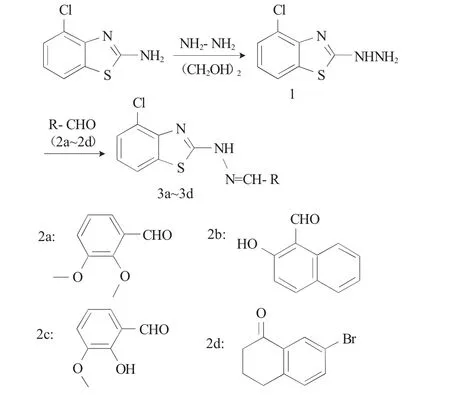
Scheme 1
1 实验部分
1.1 仪器与试剂
X-5 显微熔点测定仪(北京泰克仪器有限公司);FTIR-8400S 型红外光谱仪(日本岛津公司傅立叶变换红外光谱仪);ESJ-120-4 电子分析天平(沈阳龙腾电子有限公司);DRX-400 型核磁共振谱仪(德国布鲁克公司);ACQUITY UPLC I-Class/Xevo TQD 型液相色谱质谱联用仪(美国沃特世公司)。
2-氨基-4-氯苯并噻唑、香草醛、2-羟基-1-萘甲醛、2,3-二甲氧基苯甲醛、7-溴-3,4-二氢萘-1(2H)-酮、水合肼,均为分析纯,上海阿拉丁生化科技股份有限公司;HCl、无水乙醇、乙二醇、HAc,均为分析纯,广州化学试剂厂。
1.2 中间体(1)2-肼基-4-氯苯并噻唑的合成
称取0.5g(2.72mmol)2-氨基-4-氯苯并噻唑于三口烧瓶中,先后加入0.88mL(18.1mmol)水合肼、0.88mL HCl,产生大量白雾,加热到80℃,然后再加入20mL 乙二醇,搅拌至完全溶解,在130℃条件下反应,TLC 跟踪反应进程,约反应6h,直至原料点消失,结束反应,冰水浴冷却30min,有大量针状结晶析出,抽滤,干燥后得到用无水乙醇重结晶纯化,得到白色丝状晶体,收率为78%, m.p.232.5~234.0℃(文献值239~241℃[8]);1H NMR(400MHz,DMSOd6)δ:9.44(s, 1H), 7.65(dd, J=7.9, 1.1Hz, 1H), 7.28(dd, J=7.9, 1.1Hz, 1H), 6.96(t, J=7.8Hz,1H), 5.17(s,2H);13C NMR(100MHz, DMSO-d6)δ: 175.3, 150.7,132.2,125.9,121.6,121.3,120.4; IR(KBr)v:3342(-NHNH2),2860,1655,1564,1443,1442,1256,1092, 9561,874,754cm-1; MS C7H6ClN3S [M+H]+m/z:199.82.
1.3 目标化合物(3a~3d)的合成
以合成目标化合物3a 为例,称取0.050g(0.25mmol)中间体(1)于圆底烧瓶中,加入10mL无水乙醇,加热、搅拌至中间体(1)完全溶解,再加入0.045g(0.27mmol)2,3-二甲氧基苯甲醛,搅拌、回流,TLC 跟踪反应进程,约反应2h,原料点消失,结束反应,冷却到室温,有少量浅黄色晶体析出,静置1d,有大量晶体析出,抽滤,干燥得到浅黄色晶体。
化合物3a1H NMR(400MHz,DMSO-d6)δ:12.78(s,1H),8.35(s,1H),7.79(dd,J=7.9,1.1Hz,1H),7.41(ddd, J=9.2,7.8,1.4Hz,2H),7.16-7.08(m, 3H),3.84(s,3H),3.79(s, 3H);13C NMR(100MHz, DMSO-d6)δ:168.2,153.2,149.4,148.0,139.4,132.3,127.8,126.5,124.9,123.8,122.8,120.9,117.1,114.4,61.6,56.2;IR(KBr)v:2835,1595,1566,1445,1421,1259,1061,1001,818,729cm-1; MS C16H14ClN3O2S [M]+m/z: 347.86.
化合物3b1H NMR(400MHz,DMSO-d6)δ:12.79(s, 1H),10.83(s, 1H), 8.98(s, 1H),8.90(d, J=8.7Hz,1H),7.87(q,J=8.6Hz, 3H),7.61(ddd, J=8.5,6.7,1.4Hz,1H),7.46-7.35(m, 2H),7.25(d, J=8.9Hz, 1H),7.13(t,J=7.9Hz, 1H);13C NMR(100MHz, DMSO-d6)δ:167.6,163.0,157.33,143.3,132.9,131.5,129.3,128.7,128.4,126.6,124.0,123.9,122.8,122.7,121.1,118.6,110.7;IR(KBr)v:2752,1604,1576,1456,1416,1256,1182,1080,700cm-1; MS C18H12ClN3OS [M]+m/z:353.87.
化合物3c1H NMR(400MHz, DMSO-d6)δ:12.74(s, 1H),9.42(s, 1H),8.42(s, 1H),7.79(d, J=7.8Hz,1H),7.39(d, J=8.0Hz, 1H),7.33(dd, J=8.1,1.2Hz,1H),7.10(t, J=7.9Hz, 1H),7.00(dd, J=8.1,1.5Hz, 1H),6.85(t, J=7.9Hz, 1H),3.84(s, 3H);13C NMR(100MHz,DMSO-d6)δ:168.0,148.5,146.2,140.9,132.1,126.5,123.2,122.7,120.9,119.8,117.9,113.33,56.35;IR(KBr)v:2785,1605,1564,1449,1414,1242,1134,1101,968,881,727cm-1;MS C15H12ClN3NaO2S [M]+m/z:333.84.
化合物3d1H NMR(400MHz, DMSO-d6)δ:12.02(s, 1H),8.10(d, J=2.2Hz, 1H),7.84(d, J=7.8Hz,1H),7.44(dd, J=8.1, 2.2Hz, 1H),7.39(dd, J=7.9,1.1Hz,1H),7.17(d, J=8.2Hz, 1H),7.12(t, J=7.9Hz, 1H),2.74-2.70(m, 4H),1.84(t, J=6.2Hz, 2H);13C NMR(100MHz,DMSO-d6)δ:169.8,160.1,147.4,139.3,134.6,132.4,131.8,131.5,127.6,126.7,126.4,122.9,121.0,119.6,28.7,26.4,21.4;IR(KBr)v:2797,1595,1560,1433,1408,1256,1128,1099,877,760,725cm-1;MS C17H13BrClN3S[M+Na]+m/z:427.77.
2 结果与讨论
2.1 中间体的合成条件探讨
2.1.1 溶剂的选择 本实验尝试用乙醇、丙酮等为溶剂,2-氨基-4-氯苯并噻唑、水合肼和HCl,在加热、回流条件下反应,用TLC 跟踪反应进程,反应24h 后均未出现产物点。参照文献[9],改用乙二醇为溶剂,反应温度高于120℃条件下加热、回流,原料点逐渐变浅,同时产物点变浓,因此,合成中间体需采用沸点较高的溶剂,本实验选用乙二醇为反应溶剂。
2.1.2 温度对合成中间体(1)反应时间的影响 以乙二醇为溶剂,2-氨基-4-氯苯并噻唑与水合肼的原料配比1∶8,HCl 为催化剂,探讨了反应温度对合成中间体的反应时间影响,用TLC 跟踪反应进程,以产物点与原料点浓度对比来观察其反应程度,其结果见表1。

表1 反应温度对合成中间体(1)反应时间的影响Tab.1 Effect of temperature on reaction time of synthetic intermediate(1)
由表1 可知,在其他条件一致的情况下,温度对合成中间体的反应时间有较大影响,反应温度越高反应越快,加热到130℃,原料点消失,反应时间明显缩短,因此,130℃为最佳的反应温度。
2.1.3 不同催化剂对合成中间体(1)反应时间的影响 以乙二醇为溶剂,反应温度130℃,2-氨基-4 氯苯并噻唑与水合肼的原料配比为1∶8,探讨了不同催化剂对合成中间体的反应影响,通过TLC 跟踪反应进程,其结果见表2。

表2 不同催化剂对合成中间体(1)反应时间的影响Tab.2 Effect of different catalysts on reaction time of synthetic intermediate(1)
由表2 可知,在其他反应条件一致的情况下,不同催化剂对合成中间体的反应进程影响不一样,不加催化剂和加浓H2SO4为催化剂均未出现产物点,而以HCl 为催化剂时,反应可进行,说明HCl 是合适的催化剂。可能的原因是在酸性条件下,肼基具有较强的亲电性,有利于亲电取代反应,而硫酸与肼形成的肼盐由于空间位阻大而不利于反应[10]。
2.2 目标化合物3a~3d 反应结果
合成目标化合物3a~3d 的反应时间、反应温度、收率和物理性质见表3。
由表3 可知,中间体2-肼基-4-氯苯并噻唑与不同的醛或酮发生反应时,醛比酮更容易发生反应,反应时间短且收率较高。
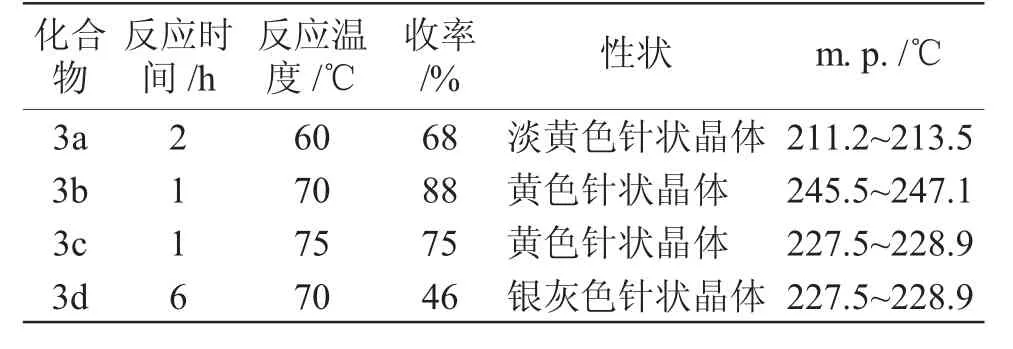
表3 合成产物3a~3d 的反应条件、收率和物理性质Tab.3 Reaction conditions, yields and physical properties of synthetic products 3a~3d
3 结论
以乙二醇为溶剂,2-氨基-4 氯苯并噻唑为原料与过量的水合肼发生缩合反应生成中间体2-肼基-4-氯苯并噻唑,通过对溶剂的筛选、反应温度的探讨和催化剂对合成中间体的影响,得到了合成中间体的最佳反应条件,然后将中间体分别与2,3-二甲氧基苯甲醛、2-羟基-1-萘甲醛、7-溴-3,4-二氢萘-1(2H)-酮、邻香草醛反应,合成4 种新型的苯并噻唑类席夫碱(3a~3d),并对所合成的目标化合物进行了IR、1H NMR、13C NMR 和MS 结构鉴定和表征,并得以确认。
