脂肪干细胞移植治疗大鼠视神经损伤的应用价值
2021-02-25唐平李雷陈执吕博琦赵楠楠李蒙恩
唐平 李雷 陈执 吕博琦 赵楠楠 李蒙恩
视神经损伤是严重致盲性眼病,由于视神经位于眼球后部,眼眶外伤、脑外伤均可视神经管骨折,进而压迫视神经形成损伤[1]。外伤为第一次损伤,外伤形成的压迫可再次导致二次损伤,进一步损害残存视网膜神经节细胞(retinal ganglion cells,RGCs)的血供,进而导致RGCs死亡,可导致机体视力永久丧失[2,3]。为此当前视神经损伤的治疗要求是保存残余RGCs,减少视神经的二次损伤,促进视神经轴突再生,从而促进改善患者的视力[4]。当前该病并无有效治疗方法,多采用上调神经生长因子、促神经生长等方法,但是治疗效果一直不太显著[5]。现代研究表明炎症在中枢神经系统疾病中起到关键作用,当神经受到损伤时,会立即激活炎性反应,释放自由基、细胞因子、补体、前列腺素类等炎性介质,导致神经损伤[6,7]。模式识别受体toll样受体(toll-like receptors,TLRs)与固有性免疫激活有关,可参与调节中枢神经系统损伤中的免疫应答[8]。有研究发现在周围神经损伤中,在缺乏TLR4介导的信号通路中,延迟了轴突再生和运动神经元的修复,也延迟了巨噬细胞的募集[9,10],不过在视神经损伤中的作用还无相关报道。干细胞是一类有自我复制能力的多潜能细胞,包括脐带血间充质干细胞、骨髓间充质干细胞、牙髓间充质干细胞等,可以替代受损的神经元、促进神经元的存活和轴突再生[11]。随着再生医学技术的发展,脂肪间充质干细胞(adipose-derived stem cells,ADSCs)已成为热点,脂肪组织被认为是多潜能干细胞可供选择的来源,ADSCs不仅能分化为脂肪细胞、神经细胞、骨细胞、软骨细胞等,也可表达与其相似的蛋白[12,13]。并且许多机体拥有过剩的脂肪,应用无创和无痛的方法可获得大量的ADSCs,在治疗中的应用比较方便[14],本研究通过建立视神经钳夹损伤动物模型,明确模型大鼠RGCs的变化规律,通过向模型大鼠视神经损伤部位鞘内注射ADSCs,以明确ADSCs对视网膜节细胞的保护作用与作用机制,报道如下。
1 材料与方法
1.1 材料 成年SD级健康雄性大鼠(40只)由海南医学院动物实验中心提供(动物合格证号:琼2039211),实验动物的饲养条件及实验操作流程均遵守动物实验中心相关规定,体重220~250 g。随机将其分为4组,分别为对照组、模型组、干细胞组、冻存液组,每组8只。
1.2 视神经损伤模型的制作 选择3 g/100 ml浓度的水合氯醛腹腔麻醉模型组、ADSCs组、冻存液组的大鼠,在大鼠右眼上睑靠后9∶00~12∶00位作垂直切口,向剪开穹窿部结膜,游离眼球后部脂肪,暴露并剪断上直肌、视神经,动脉瘤夹于球后2 mm夹持视神经5~10 s,观察大鼠瞳孔情况。模型制作成功标准:伤后10 min 瞳孔散大,间接对光反射存在,直接对光反射消失,且眼底明确未损伤大鼠眼动脉、眼底供血情况供恢复良好。模型制作完毕后缝合球结膜,抗菌药物滴眼液抗感染。
1.3 脂肪干细胞的获取 取另外5只SD大鼠,取其脂肪组织,用于分离脂肪干细胞。收获第三代细胞,取1×104的样本进行流式细胞表型鉴定,采用的抗体包括CD11b、CD19、CD34、CD45、CD73、CD90、CD105、等。
1.4 治疗方法 模型制作成功后,模型组不做任何处理,干细胞组立即于损伤部位视神经鞘内注射ADSCs,干细胞浓度为5×106个/ml,注射体积为10 μl;冻存液组立即于损伤部位视神经鞘内注射冻存液,注射体积为10 μl。
1.5 观察指标 所有大鼠分别于伤后7、28 d处死4只大鼠,心脏去血液标本后,取眼球和视神经标本,使用多聚甲醛心脏灌注,对照组正常眼球作为对照组同时取材。(1)视神经和眼球标本的采集:取大鼠头部,分离眼球及周围软组织,经颅内上丘剪断视神经贴近眼球球根部剪断视神经,颅内取出视神经。视神经使用4%的多聚甲醛保存,眼球于眼球固定液内保存。(2)HE染色:组织样本固定于4%多聚甲醛24 h后,连续切片,厚度为4 μm,采用HE染色步骤如下,中性树胶封片,光学显微镜下观察。(3)免疫组织分析:固定的组织样本用65℃烘箱中烘片2 h,脱蜡至水,微波修复,PBS洗涤3次,放入3%过氧化氢溶液,PBS洗涤3次,去除BSA液,加入50 μl稀释的一抗,PBS洗涤3次,加入二抗,PBS洗涤3次,DAPI避光染核5 min,PBS洗涤3次后用抗荧光淬灭封片剂封片,荧光显微镜观察。(4)RGCs计数:光学显微镜(400倍)下观察视网膜形态学变化并拍照,每个标本计数3张片子,每个切片随机取5个视野计数细胞核作为视网膜节细胞数量,同时进行免疫荧光染色RGCs计数。(5)炎性因子检测:取组织样本提取总蛋白,采用Western blot检测白介素-6(IL-6)(1∶1 000)、肿瘤坏死因子-α(TNF-α)(1∶1 000)蛋白在视神经上的表达变化。
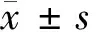
2 结果
2.1 脂肪干细胞细胞表型 第3~6代ADSCs呈现细胞贴壁生长,形态纺锤形,48 h能够扩增2倍数量,具有连续传代并保持其形态的特性。考虑细胞活力与数量,本实验采用第6代细胞。流失细胞仪检测显示第6代细胞ADSCs不表达CD11b、CD19、CD34、CD45,高表达 CD73、CD90、CD105 间充质源性分子标记,能够很好的保持其表型特征。见图1。

图1 脂肪干细胞细胞表型
2.2 视神经HE染色病理变化结果 正常视神经,显微镜下可见鞘膜完整,细胞排列整齐,层次分明。视神经损伤后7 d,HE染色显示损伤部位出现空泡化,视神经鞘膜完整,少量炎性细胞浸润。损伤后28 d可见视神经萎缩变细和胶质瘢痕增生,表明模型建立成功。见图2。
对照组 模型组7d 模型组28d
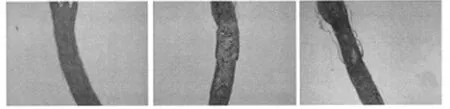
2.3 视网膜HE染色与免疫荧光分析 模型建立7 d,模型组、干细胞组与冻存液组之间RGCs数量对比差异无统计学意义(P>0.05);模型建立28 d,干细胞组RGCs多于模型组和冻存液组,对比差异有统计学意义(P<0.05)。见图3、4,表1、2。

图3 视网膜HE染色(×400)
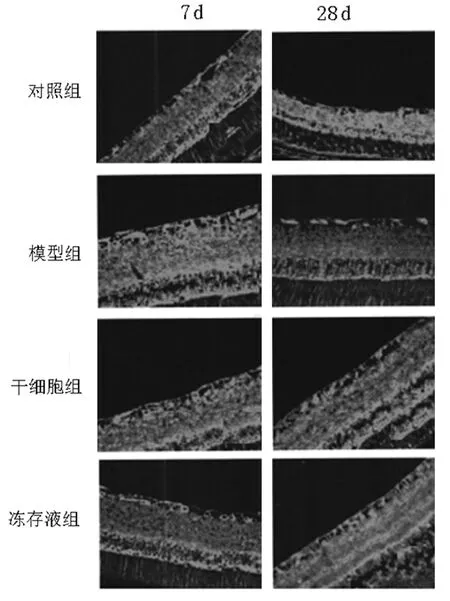
图4 视网膜免疫荧光染色(×400)
表1 4组视网膜节细胞计数(HE染色) n=4,个,
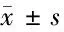
表2 4组视网膜节细胞计数(免疫荧光) n=4,个,
2.4 4组炎性因子表达比较 Western blot检测显示IL-6、TNF-α在模型组中损伤后都呈现高表达状况,干细胞组的表达水平低于模型组与冻存液组,差异均有统计学意义(P<0.05)。见表3。

表3 不同组别的炎性因子相对表达水平比较
3 讨论
视神经损伤当前比较常见,多是外伤导致严重的视力功能障碍,在临床上主要表现为视力下降、色觉障碍、眼底改变、相对性传入性瞳孔阻滞。视神经损伤分为直接损伤和间接损伤,直接损伤可导致视神经管骨折,一般预后比较差[15]。间接性损伤主要损伤部位为管内段视神经,其发病涉及视神经血肿、受压、水肿以及脑脊液循环改变等[16]。现代研究表明,视神经节细胞损伤后不可再生,视网膜节细胞死亡后视力将永久丧失[17]。本实验采用SD大鼠视神经钳夹损伤动物模型,模型成功率较高,其病理生理改变可完全模拟临床视神经损伤病理生理变化。
大鼠的视网膜构成分为视神经节细胞层、内丛状层、内核层、外核层、外丛状层等,视神经损伤后视网膜层次开始紊乱、RGCs出现死亡,但是有部分RGCs能够幸存并且长期存活,也为临床治疗提供了基础[18]。视神经损伤的治疗包括保守治疗和手术治疗,但是各种治疗手段都有一定的缺陷。大剂量激素有严重副作用,手术治疗对于机体的创伤比较大。视网膜节细胞位于视网膜节细胞层,是中枢神经系统的组成部分。在一定条件下,干细胞可以分化成多种功能类型细胞,特别是间充质干细胞没有致瘤性,在体外有免疫抑制性,也使得同种异体移植,缺乏免疫排斥反应[19,20]。有研究表明骨髓间充质干细胞具有神经保护作用,能促进视神经纤维再生[21]。ADSCs可稳定增殖,具有取材方便、干细胞含量高、创伤小等优点。有研究表明静脉注射ADSCs可有效减轻小鼠体重、降低胆固醇、增加高密度脂蛋白、降低血糖、增加糖耐量,并且降低肝脏中脂肪堆积,增胰岛素受体的表达[22,23]。ADSCs具有强大的体外扩增能力,体外建立神经诱导环境后可定向分化为具有神经细胞的生物学特性的细胞,可为神经系统损伤提供种子细胞。目前为止还没有完全特异性的细胞表型来鉴别MSCs,只能利用多种细胞表面标记来鉴别ADSCs。本研究显示第6代细胞ADSCs不表达CD11b、CD19、CD34、CD45,高表达 CD73、CD90、CD105间充质源性分子标记,能够很好的保持其表型特征,这是从脂肪中分离间充质干细胞的特异性标记之一。本研究显示模型建立7 d,模型组、干细胞组与冻存液组之间RGCs数量比较差异无统计学意义(P>0.05);模型建立28 d,干细胞组RGCs多于模型组和冻存液组,差异有统计学意义(P<0.05)。相关研究也表明在急性肺损伤模型中,向小鼠气管内注射ADSCs可减轻减少肺内细菌数量,减轻金黄色葡萄球菌肺炎、降低小鼠死亡率[24,25]。有研究表明ADSCs可以减轻氧自由基和炎性因子对脊髓的进一步损伤,减少细胞凋亡和突变,并且无明显不良反应,显著提高再生坐骨神经的连续性和神经功能[26,27]。
中枢神经系统损伤伴随的炎症应答在神经学上具有双重作用,即促进神经元再生或者引起神经元继发性损害[28,29]。损伤后,正常情况下视神经是不能再生的,眼内炎症可引起RGCs转变成活跃的生长状态。特别是当视神经损伤后,正常情况下表现出很少的再生能力[30]。尽管目前炎性介质在神经损伤后的再生作用存在一定的争议,炎性反应在神经再生方面的作用受到广泛重视。有研究显示在中枢神经系统中,TLR4主要在星形胶质细胞、小胶质细胞中表达,当小胶质细胞激活后,TLR4可大量表达[31]。特别是在神经炎性反应中,TLR4产生应答,引起脑损伤。有研究也显示中枢神经系统死亡可通过激活TLR4信号通道,紧坏死的神经元激活小胶质细胞里MyD88,导致IL-6、TNF-α的释放[32]。另外TLR4可能在控制神经性疼痛、轴突再生和组织修复过程中也发挥重要作用,脊髓损伤时TLR2和TLR4的激活调节损伤后的炎性反应及神经胶质增生[33,34]。本研究显示Western blot检测显示IL-6、TNF-ɑ在模型组中损伤后都呈现高表达状况,干细胞组的表达水平低于模型组与冻存液组,差异均有统计学意义(P<0.05),提示TLR4介导的炎性反应在视神经损伤后的早期继发性损害过程中发挥一定作用,也可能是视神经损伤后介导炎性反应的一条重要通道。ADSCs能够抑制抗炎效应,从而发挥视网膜保护作用、促进神经再生作用[35,36]。不过本研究也存在一定的缺陷,ADSCs的具体作用机制还不太明确,对TLR4信号通路相关蛋白的影响阐述还不够深入,将在下一步的研究中进行深入分析。
综上分析,ADSCs治疗大鼠视神经损伤可减缓视网膜神经节细胞的下降速度,抑制TLR4信号通路中炎性因子的表达,对视神经损伤具有保护作用。
