厌氧菌群TC-5生物强化秸秆猪粪混合发酵过程的研究
2021-02-25孔祥平奚永兰王宇欣叶小梅
孔祥平, 奚永兰, 杜 静, 王宇欣, 黄 艳, 叶小梅
(1.江苏省农业科学院畜牧研究所, 江苏 南京 210014; 2. 农业农村部农村可再生能源华东科学观测实验站, 江苏 南京 210014; 3. 农业农村部沼气科学研究所, 四川 成都 610041)
我国农业秸秆年产量高达10.4亿吨,且秸秆产量呈现出不断增长的趋势[1]。通过厌氧发酵制备生物甲烷是秸秆资源化利用的重要途径之一,该技术可规模化处理农业有机废物,增加清洁燃气供给,是打赢污染防治攻坚战、实现碳减排及实施乡村振兴战略的重要途径[2-3]。然而,复杂的化学组成和结构使得秸秆降解过程成为厌氧发酵制备甲烷的限速步骤,进而导致厌氧发酵周期长、容积产气率和甲烷产量低等问题,阻碍了秸秆发酵制备生物甲烷产业的发展[4]。国内外学者对秸秆厌氧消化生产沼气的预处理方法进行了广泛的研究,开发了多种基于物理、化学、生物或组合的预处理技术,有效促进了秸秆厌氧消化过程的产气能力,但由于较高的预处理成本限制了这些技术在实际生产过程的应用。因此,如何以高效低成本的方式突破秸秆的抗降解结构屏障,提高秸秆的生物转化效率是厌氧发酵制备生物甲烷领域的研究热点[5-8]。
自然界中秸秆的降解是一个多种微生物相互协作的过程。与单一菌株相比,微生物菌群通过分泌功能互补的复杂降解酶系可显著提高秸秆的降解效率,从而促进厌氧发酵过程中甲烷的合成[9]。Wen[10]等研究了3种不同秸秆降解菌群MC1,WSD-5,XDC-2对秸秆预处理过程,结果表明通过3种菌群的预处理均能够使甲烷的收率提高32%~49.2%。Yuan[11]等研究了秸秆降解菌群MC1预处理棉花秸秆对产甲烷过程的影响,甲烷收率达到118 mL·g-1VS,比未处理棉花秸秆提高了136%。尽管目前已有大量秸秆降解菌群的报道,但大多数都是好氧菌群。利用好氧菌群预处理秸秆将会增加设备投入,延长发酵周期,且预处理过程秸秆干物质损失大。相反,厌氧秸秆降解菌群可直接接种至甲烷发酵体系促进秸秆水解,无需额外设备投入,且主要降解产物可为甲烷发酵过程提供前体,有利于甲烷收率的进一步提高[12]。有鉴于此,Kong[13]等通过在培养基中添加复合还原剂的方式从高温堆肥样品中成功筛选到一种可高效降解农业秸秆的厌氧菌群TC-5,其中稻秸和麦秸的降解率分别达到46.7%和54.5%(1.0 wt% 添加量),酶活检测分析表明TC-5菌群具有多种木质纤维素降解酶活性。将厌氧秸秆降解菌群TC-5接种至甲烷发酵体系,在中温和高温批次发酵过程中甲烷产量分别提高了22.2%和36.6%。
本研究在半连续进料模式下考察了添加厌氧微生物菌剂TC-5对秸秆和猪粪混合发酵产气过程和发酵体系中微生物多样性的影响。研究结果表明生物强化菌剂TC-5的添加能够调控厌氧发酵过程中细菌和产甲烷古菌微生物的组成,进而影响微生物的活性,促进甲烷产量的提高,相关结果对厌氧发酵过程的生物强化技术开发具有重要的价值。
1 材料与方法
1.1 试验材料
试验所用水稻秸秆来自江苏省南京市六合区的试验农田中,自然风干后,使用粉碎机(Hummer 900)将其粉碎成约2~3 mm的粉末颗粒,置于烘箱55 ℃下烘干后备用。取自于江苏省淮安市养殖场的新鲜猪粪,取回后储存于4 ℃的冰箱。接种物为本实验室污泥驯化罐中不产气厌氧污泥。厌氧木质纤维素降解菌群TC-5来源于保存的原始种子液经过活化后得到。供试材料的理化参数如表1。
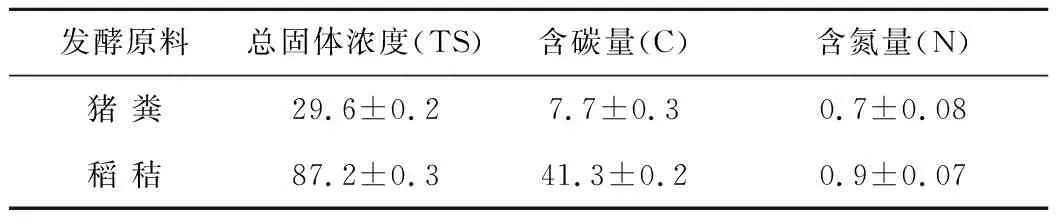
表1 供试材料的理化组成 (%)
所有化学品均为试剂级,购买于上海中化集团或上海生工科技有限公司。 所用的气体包括CO2,H2,CH4和N2均从南京特种气体工厂购买。
1.2 试验装置
厌氧发酵装置采用CSTR反应器(见图1),总容积5 L,有效容积4 L,主要由搅拌器、发酵罐、排水集气装置以及水浴系统组成。发酵罐材质为双层有机玻璃,罐内设有搅拌釜,机械密封,搅拌轴连接定时开关与高频电机,轴上固定 3 层叶片,采用间歇式搅拌方式。发酵罐整体采用循环恒温水浴箱保温。发酵罐顶部设置有进料口和排气口,侧面的上部设有出水口,下部设有出料口和进水口,进出料口采用阀门控制,沼气出口连接排水集气装置。
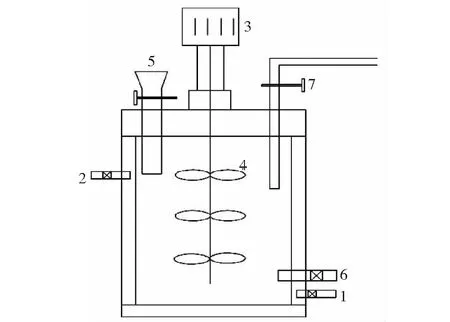
图1 CSTR反应器结构图
1.3 试验方法
1.3.1 厌氧木质纤维素降解菌群TC-5的制备
将配制好的50 mL PCS培养基分装到180 mL血清瓶中,并在加热状态下持续通无氧高纯氮气和0.5 g·L-1的L-半胱氨酸,以达到排除培养基中溶解性氧气的作用,在121℃灭菌15 min备用。无菌条件下,按照4%v/v的比例将甘油管保存的菌种原始菌液转接至厌氧血清瓶中活化。置于55℃恒温培养箱中静置培养48 h,在8000 rpm·min-1条件下离心10 min,收集湿菌体按照接入厌氧发酵罐中。
1.3.2 半连续厌氧发酵试验的运行
本试验设计3个重复组,每组运行3个发酵阶段共60 d,每个发酵阶段设置为20 d,以恒温循环水浴将发酵罐维持在37℃,每2 h搅拌1次,转速设定为20 r·min-1。厌氧发酵试验包括3个阶段,A 阶段为一次性进料的批式发酵试验,共计20 d。B阶段不添加TC-5菌剂的半连续发酵(SRT为20 d)。C阶段为添加厌氧菌群TC-5的半连续发酵(SRT为20 d)。采用排水法(饱和碳酸氢钠溶液)计量每日沼气总产量。
A 阶段发酵TS质量分数为8%,反应器容积4 L,接种物与发酵罐有效容积之比为1∶2,水稻秸秆与新鲜猪粪添加量换算出TS干物质比为1∶5,发酵体系C/N调节为30。装料方式如同批式发酵试验,一次性进料后密封发酵罐。在A阶段运行结束后,继续实行B阶段,每天定时定量进出料,进出料料液总体积为200 mL,利用100目网筛过滤出料液,过滤后的滤液用于进料料液中。进料基质为水稻秸秆和新鲜猪粪,发酵TS同为8%,当进料料液体积不足200 mL时可采用纯化水补充。B阶段运行结束时,接入活化后离心的厌氧菌群TC-5菌泥,按照5.0 % v/v接种量的方式接入,并继续运行20天,进出料方式与B阶段保持一致。
1.4 分析检测方法
猪粪和水稻秸秆总碳(TC)、总氮(TN)和总固体(TS)的含量测定采用国家标准方法。pH值由pH计测得。采用 GC-7890A 气相色谱仪分析沼气中的甲烷浓度(TCD检测器),并使用氢气作为载气。进样器,柱箱和检测器的温度分别控制在100℃,150℃和120℃。载气的流速为50 mL·min-1,样品的进样量为0.5 mL。定期采集不同阶段厌氧发酵中的沼液,采用通用型细菌引物338F(5’-ACTCCTACGGGAGGCAGCAG-3’)进行细菌多样性检测;利用Arch344F (5′-ACGGGGYGCAGCAGGCGCGA-3′)和Arch915R (5′-GTGCTCCCCCGCCAATTCCT-3′)引物进行了古细菌多样性的测定。DNA扩增后PCR产物送往上海美吉生物技术有限公司进行 Illumina MiSeq 高通量测序,在美吉云平台上对数据进行分析。
2 结果与讨论
2.1 菌群TC-5的添加对厌氧发酵日产沼气量和甲烷量的影响
在厌氧发酵过程中,日产沼气量如图2所示,A,B,C这3个阶段的发酵时间均为20天。在发酵启动阶段,日产沼气量迅速增加,在第4天达到峰值6493 mL·d-1,随后开始下降,这种趋势符合厌氧发酵产沼气的试验结果,说明发酵启动,在适宜的温度、充足的原料条件下,体系中的微生物开始活动,物料发生降解产生大量沼气,随着发酵的进行到达峰值后,沼气产量开始下降,说明随着原料基质的降解,体系可以利用的原料在减少,沼气产量随着减少。B阶段通过半连续进料的方式,沼气产量开始逐渐缓慢增加,并在后期30~40天发酵过程稳定在3500~3700 mL·d-1,说明随着半连续发酵的进行,体系在后期逐渐达到一个稳定的状态。C阶段在添加菌群TC-5之后,沼气日产量并没有立即得到提升,沼气产量经过10天左右的发酵缓慢增加,最终稳定在4000 mL·d-1左右。

图2 厌氧发酵过程中日产沼气量
在厌氧发酵过程中,日产甲烷量如图3所示。日产甲烷量的总体趋势和日产沼气量相似,日产甲烷的体积分数缓慢上升,在B和C阶段稳定在54.38%左右。B阶段的日产甲烷量稳定在1800~1900 mL·d-1,C阶段稳定在2100~2200 mL·d-1,添加厌氧微生物菌剂TC-5能够明显提高甲烷的日产量提。
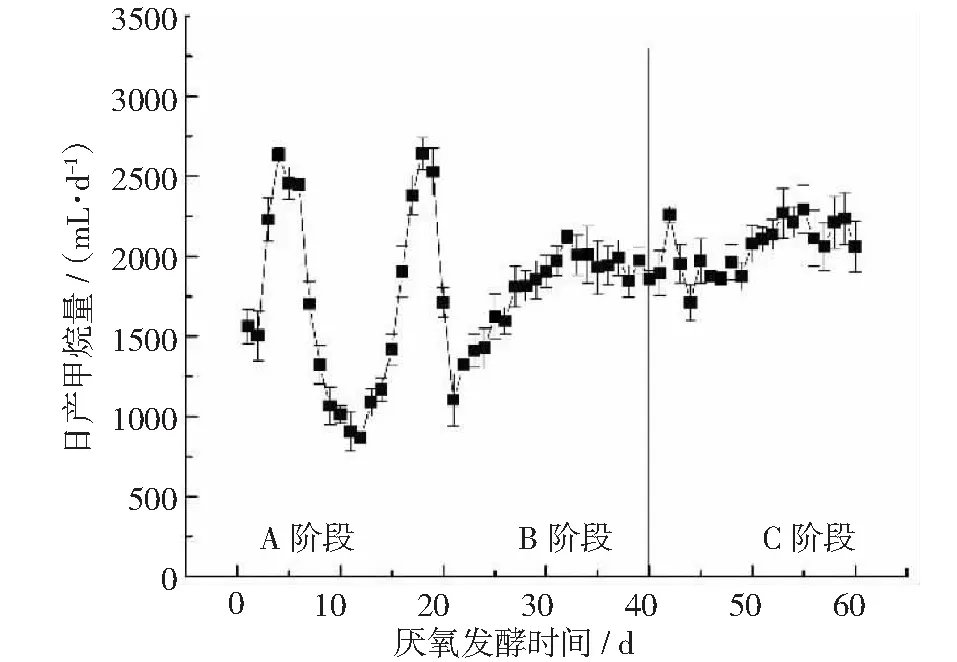
图3 厌氧发酵过程中日产甲烷量
2.2 菌群TC-5的添加对厌氧发酵日累积产沼气量和甲烷量的影响
在厌氧发酵过程中,日累积产沼气量如图4所示。A阶段日累计沼气产量在0~10天迅速增加,10~20天缓慢增加,而B和C阶段持续缓慢增加,这种趋势和日产沼气量相似,符合厌氧发酵产气模式。A,B,C这3个阶段的最终累积沼气产量分别为67304 mL,65803 mL,75700 mL,相较于A发酵阶段和B发酵阶段,添加厌氧菌群TC-5后的C发酵阶段沼气产量分别提高了12.47%,15.04%,这说明在厌氧发酵过程中,添加厌氧菌群TC-5可在一定程度上有助于沼气产量的提高。
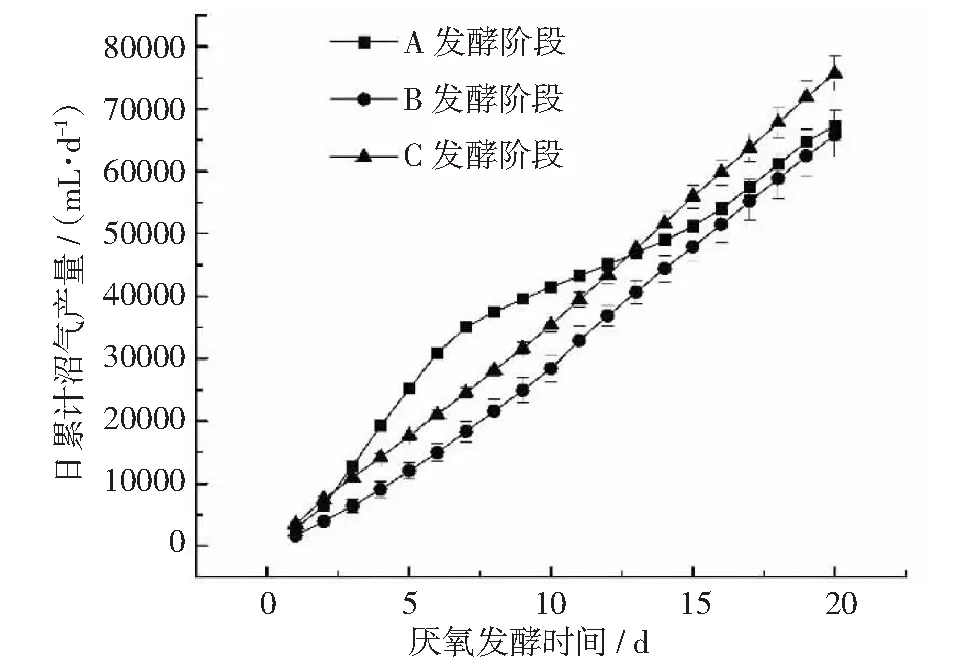
图4 厌氧发酵过程中日累积产沼气量
在厌氧发酵过程中,日累积产甲烷量如图5所示。A,B,C这3个阶段总体趋势与日累积产沼气量相似,最终累积甲烷产量分别达到34540 mL,35626 mL,41146 mL。相较于A发酵阶段和B发酵阶段,添加厌氧菌群TC-5后的C发酵阶段甲烷产量分别提高了19.12%,15.49%。
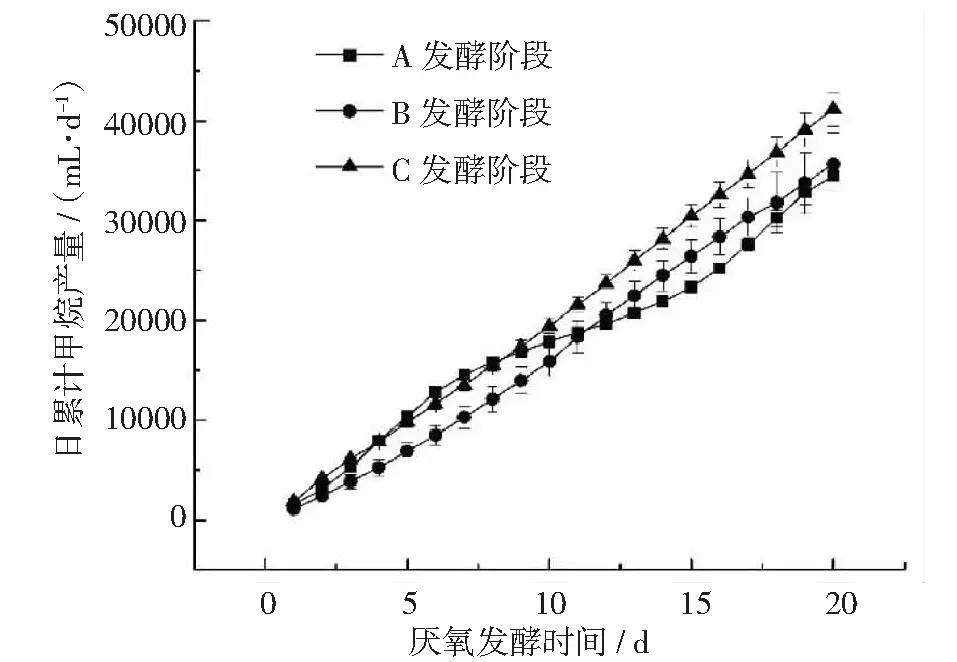
图5 厌氧发酵过程中日累积产甲烷量
2.3 厌氧菌群TC-5的添加对发酵容积产气率和原料产气率的影响
容积产气率和原料产气率是衡量厌氧发酵过程效率和经济效益的核心指标。在本实验的半连续厌氧发酵过程中,不同发酵阶段的容积产气率如图6所示,各阶段间的容积产气率差异显著。A阶段由于前期可溶性有机物的快速降解导致容积产气率先迅速上升,在第4天达到容积产气率最大值1.62 L·L-1d-1,并由于秸秆中木质纤维素组分的抗降解性容积产气率持续下降至0.48 L·L-1d-1左右,随后缓慢上升到次高峰0.92 L·L-1d-1。B,C阶段趋势相同,均为先缓慢增加,第30~40天稳定在0.89 L·L-1d-1,第50~60天稳定在1 L·L-1d-1。3个阶段的平均容积产气率(见表2)分别为0.84,0.82和0.95 L·L-1d-1,C阶段是分别是A,B阶段的1.13和1.16倍。

表2 不同厌氧发酵阶段的平均容积产气率和原料产气率对比
发酵原料、滞留时间、发酵温度等条件显著影响原料产气率。整个发酵过程中原料产气率变化如图7所示。A,B,C这3个阶段的容积产气率趋势总体相似。A阶段产气率随着发酵时间的增加而缓慢增加,在第20天达到最大值210.06 mL·g-1TS。B阶段中启动后原料产气率迅速降低,直到第30~40天后达到228.17 mL·g-1TS。接入厌氧菌群TC-5后启动的C阶段发酵过程原料产气率缓慢增加,在第60天达到251.86 mL·g-1TS,3个不同发酵阶段的平均原料产气率(见表2)分别为123.47,205.64和236.56 mL·g-1TS,C阶段的原料产气率分别是A阶段和B阶段的1.92和1.15倍。
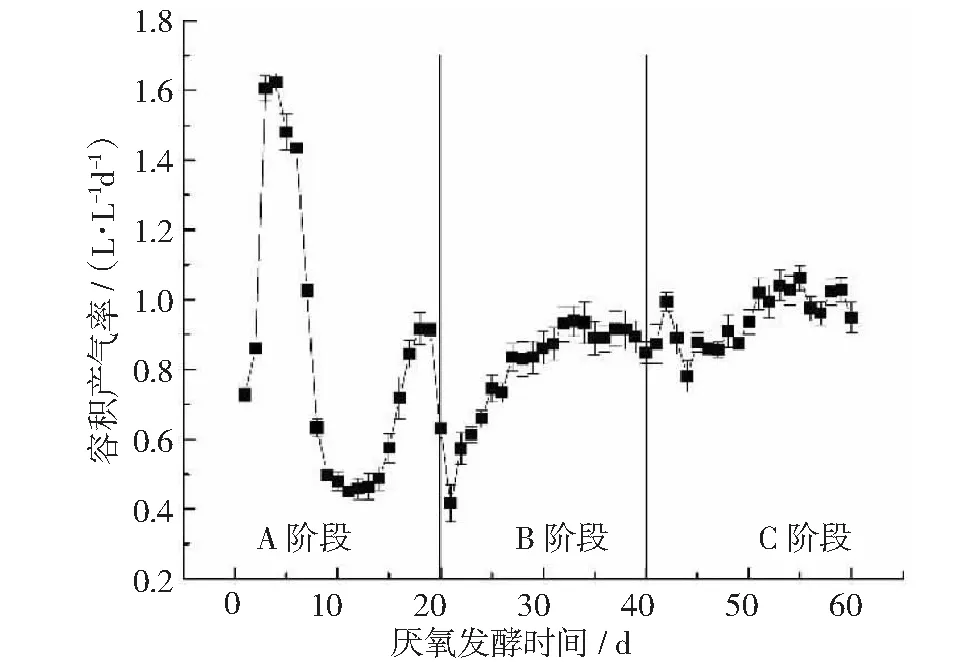
图6 发酵过程中容积产气率
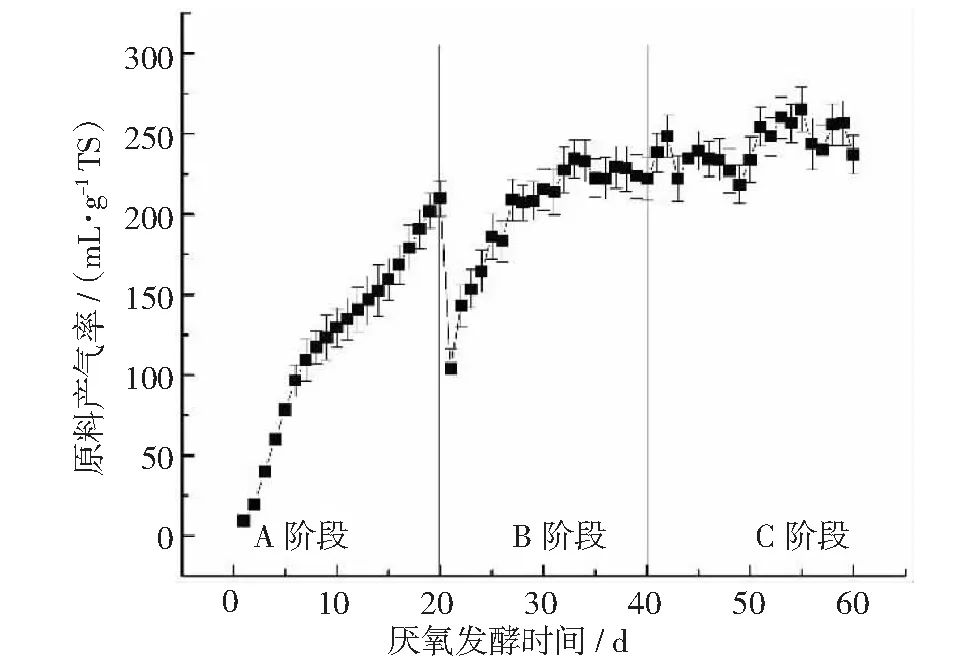
图7 发酵过程中原料产气率
2.4 菌群TC-5的添加对厌氧发酵微生物群落结构的影响
分别对每个发酵阶段的起始和结束阶段进行高通量测序技术分析,研究3种不同厌氧发酵体系中细菌和产甲烷古菌群落的变化过程(见图8~图10)。厌氧发酵的水解酸化阶段主要由细菌负责完成[14]。细菌群落在门水平上的分布图显示厌氧发酵体系中主要包含厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidetes)和变形菌门(Proteobacteria),此细菌门水平分布图结果与之前报道的文献结果相一致[15-16]。厚壁菌门在木质纤维素生物质降解中起重要作用,因为已知属于该门的物种会产生多种纤维素降解酶。厚壁菌门的严格梭状芽胞杆菌1(Clostridiumsensustricto1)和克里斯滕森氏菌(Christensenellaceae_R-7_group)的菌群相对丰度升高。Christensenellaceae_R-7_group和Clostridiumsensustricto1是典型的纤维素分解菌,也能有效降解半纤维素,并且能够高效的分解有机物合成有机酸为厌氧发酵产甲烷过程提供前提物质。
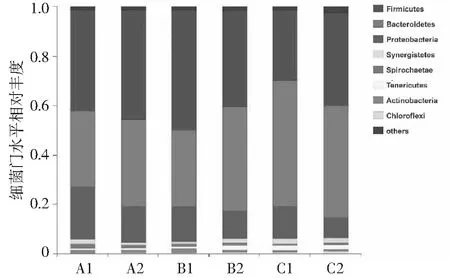
图8 不同发酵阶段细菌在门水平上的相对丰度对比

图9 不同发酵阶段细菌在属水平上的相对丰度对比
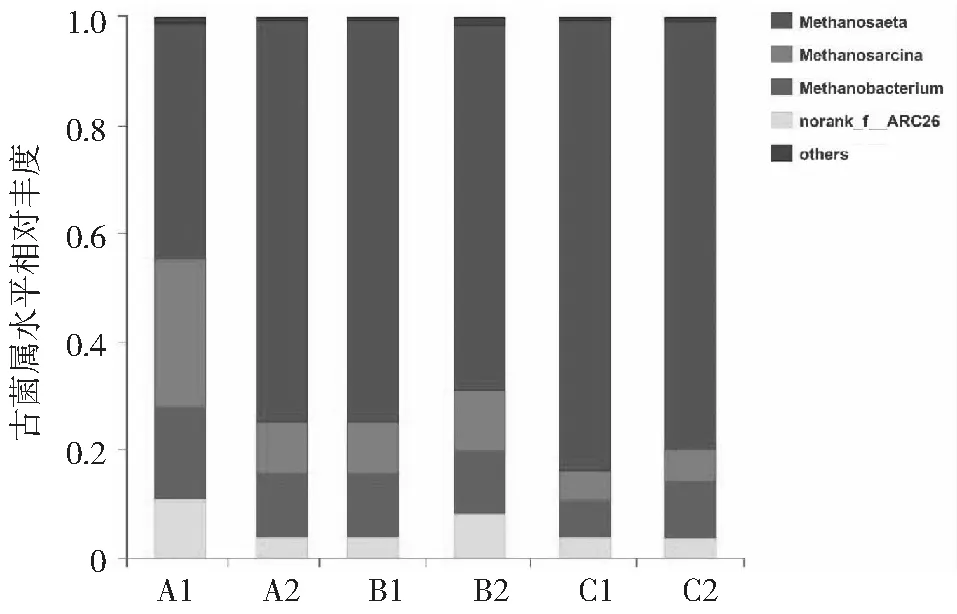
图10 不同发酵阶段产甲烷古菌在属水平上的相对丰度对比
拟杆菌门是第2大优势种群,门内菌种的主要功能是降解大分子有机物以及产有机酸。在接入TC-5后,拟杆菌纲中vadinBC27wastewatersludgegroup属的相对丰度相比对照组(A组)有明显升高。vadinBC27wastewatersludgegroup能够利用氨基酸(亮氨酸、色氨酸和蛋氨酸等)产生挥发性脂肪酸[17]。
由细菌群落在门和属水平上的分析可知,接入厌氧菌群TC-5后,梭菌纲中的Christensenellaceae_R-7_group和Clostridiumsensustricto_1以及拟杆菌纲中vadinBC27wastewatersludgegroup的物种丰富度均比未接菌时高,而这些细菌可能通过加强有机物的分解利用过程,进而提高沼气和甲烷产量。
厌氧消化过程的甲烷合成由多种产甲烷古细菌协同作用完成。从图10可以看出,古菌群落在属水平上主要包含甲烷八叠球菌属(Methanosarcina)、甲烷鬃菌属(Methanosaeta)和甲烷杆菌属(Methanobacterium)。其中,乙酸营养型产甲烷菌Methanosaeta占据主导地位;乙酸营养型产甲烷菌Methanosarcina和氢营养型产甲烷菌Methanobacterium是第二大优势菌属。当发酵进入半连续进料阶段,产甲烷古菌的相对丰度总体保持平稳,但接种厌氧菌群TC-5后Methanosaeta属的物种丰富度升高,而Methanosarcina和Methanobacterium属的物种丰富度降低,这表明厌氧降解菌群TC-5可以影响厌氧发酵体系中氢营养型和乙酸营养型产甲烷途径的平衡。乙酸营养型产甲烷菌的丰度升高和氢营养型产甲烷菌的丰度降低,说明TC-5能够提高厌氧发酵体系利用乙酸作为底物产生甲烷的潜力。
3 结论
在猪粪-稻秸半连续厌氧发酵过程中考察了添加TC-5生物强化菌剂对厌氧发酵过程沼气合成和微生物多样性的影响。实验结果表明添加TC-5生物强化菌剂能够有效提高日产气量和累计产气量,与批次发酵和未接种菌剂组相比,甲烷产量提高了12.47%~15.04%。通过高通量测序技术分析了不同发酵过程中微生物菌落的动态变化,发现发酵型细菌Christensenellaceae_R-7_group,Clostridiumsensustricto_ 1,vadinBC27 wastewater sludge group和产甲烷古菌Methanosaeta的相对丰度均比批次发酵和未接种TC-5菌剂的半连续发酵过程显著提高,特殊的发酵型细菌和乙酸营养型产甲烷菌的丰度升高可能是发酵过程甲烷产量提高的原因。相关实验结果表明采用微生物菌剂TC-5强化厌氧发酵过程提升甲烷产量是一种可行的技术方案。
