载体选择对畜禽粪污除臭微生物菌剂效果的影响
2021-02-25徐延亮任肖庆吴雨恬
徐延亮, 刘 军, 黎 霞, 任肖庆, 吴雨恬, 邓 宇, 贺 静
(农业农村部沼气科学研究所, 农业农村部农村可再生能源开发利用重点实验室, 四川 成都 610041)
规模化和集约化养殖已经成为我国畜禽养殖的主流,据统计,2015年畜禽粪污产生量就达3.834×109t,其中,新鲜粪便6.36×108t,尿液5.65×108 t,产生污水约2.633×109 t[1]。畜禽粪污的不合理排放和不科学利用对生态环境以及人们身体健康产生了很多的负面影响,畜禽粪污引发的恶臭气体不仅对畜禽本身的危害很大,而且对周边环境及人体健康也造成严重伤害。因此,畜禽养殖环境和堆放场所气体除臭具有重要的现实意义和应用前景。
目前,常用的除臭方法主要有物理法、化学法和生物法,与物理法和化学法相比,生物法使用和产生的是生态安全的化合物,是生态友好型的除臭方法,因此,生物法除臭已经成为除臭的重要方法之一[2]。目前的除臭菌剂主要是液体剂型,存在运输不方便和货架期不长等问题,为了延长菌剂保存期,本试验以实验室富集和筛选的一组复合除臭菌剂为研究对象,从菌剂载体的角度出发,对3种不同菌剂载体进行了比对和筛选,测定载体与菌剂复配后活菌数,并优化添加了香味物质作为培养基成分,形成了微生物除臭菌剂产品。将不同剂型的菌剂与市售除臭剂应用于猪粪处理,通过对猪粪氨气排放的抑制率来评估不同除臭菌剂的作用效果,为制备有效的微生物复合菌剂奠定基础,为解决粪污臭气污染问题提供理论支撑。
1 材料与方法
1.1 供试材料
1.1.1 供试菌种
本实验室采集猪粪和堆肥样品进行富集培养,从产臭不明显富集样本中培养出约500个单菌落,采用M9U产氨检测培养基[3],有20菌落可明显降低氨气产生,将其依次命名为A,B,C,D,E,F,G,H,I,J,K,L,M,N,O,P,Q,R,S,T。其中,N和K为条件致病菌。其余18株经菌落形态描述及分子生物学鉴定,根据农业菌株安全名录,主要包含乳酸菌,酵母菌和芽孢杆菌。
1.1.2 供试载体
非金属矿物载体:沸石粉、植物源载体:稻壳粉、玉米秸秆粉。
上述载体过60目筛,在121℃灭菌30 min,烘干备用。
1.1.3 供试培养基及其它溶液
1.1.3.1 固体培养基
MRS培养基(g·L-1):蛋白胨10 g,葡萄糖20 g,乙酸钠5 g,硫酸镁0.2 g,硫酸锰0.05 g,牛肉粉5 g,酵母粉4 g,磷酸氢二钾2 g,柠檬酸三铵2 g,吐温801 mg·L-1,琼脂粉15 g。
YPD培养基(g·L-1):酵母粉10 g,蛋白胨20 g,葡萄糖20 g,琼脂20 g。
CC培养基(g·L-1):酵母粉10 g,蛋白胨3 g,葡萄糖10 g,琼脂20 g。
1.1.3.2 液体培养基
固体培养基不加琼脂即可。
1.1.4 供试香料
7种香料分别按Ⅰ,Ⅱ,Ⅲ,Ⅳ,Ⅴ,Ⅵ,Ⅶ编号。
1.2 试验方法
1.2.1 菌株的生长曲线和产氨气性能分析
从臭味不明显的猪粪或堆肥样品中分离具有除臭潜力的功能微生物,使用M9U产氨检测培养基[3],经群落分析及分子生物学鉴定菌株。
1.2.2 菌株生长曲线测定
按照体积比1%将菌株A~T接种在MRS液体培养基,30℃,200 rpm摇床单独培养。前14 h每隔2 h各取200 μL菌液,14 h~46 h每隔8 h各取200 μL菌液,使用酶标仪进检测OD600,每组重复检测2次[4]。以时间(h)为横坐标,OD600值为纵坐标,建立各菌株生长曲线[5]。
1.2.3 拮抗作用分析
将菌株通过划线交叉法,在MRS平板上两两之间交叉划线,观察交叉点是否有菌生长,两菌均能生长,则无拮抗作用,只有一株或者两株均不能生长则存在拮抗作用。运用牛津杯抑菌圈法测定菌株之间的拮抗性,观察透明圈的大小,透明圈越大代表拮抗性越强烈,反之,则拮抗性越低。
1.2.4 固体菌剂载体性能测定
吸水率测定:在无菌条件下,每种载体在搪瓷盘中称3份,每份100 g,按照一定体积梯度缓慢加入蒸馏水后充分混匀,至载体不再吸收水分时停止加水,计算每一份载体吸水率,求平均值。
吸水率=
pH值测定:在250 mL锥形瓶中称取不同载体10 g,加入100 mL无菌水搅拌均匀,测定液体pH值[6]。以蒸馏水作为对照。
1.2.5 载体与微生物复配
将筛选好的18株菌分别培养至对数期,将200 g载体高温高压灭菌后与菌液按照质量体积比1∶1混匀,放置于干燥箱40℃低温干燥,约48 h后完成[7]。
1.2.6 载体与菌剂复配后活菌数测定
称取1 g菌剂样品,加入到装有无菌玻璃珠和100 mL PBS缓冲液的250 mL锥形瓶中,在恒温磁力搅拌器上搅拌2 h后进行梯度稀释,用无菌水分别梯度稀释后,涂布在MRS,YPD,LB固体培养基上, 约24 h后统计培养基菌落数,并计算载体释放的活菌数目,同时统计培养液的菌落数目作为接种细菌的数目,统计3次稀释涂布平板法菌落的平均值[8]。
活菌率(%)=释放活菌数/接种细菌数目(CFU)×
100%[9]
将干粉状菌剂放置于30 ℃培养箱保存,模拟菌株快速老化过程,分别于第20 天和40 天称取载体1 g按上述方法 。
1.2.7 菌剂培养液制备
经过初步筛选,确定Ⅰ,Ⅱ,Ⅲ,Ⅳ,Ⅴ,Ⅵ,Ⅶ等7种香料,按照不同比例复配,确定最佳比例及用量,并进一步优化配方配比。
1.2.8 菌剂对猪粪臭气及氨气的去除效果评估
除臭效果评估反应体系见表1。

表1 复合菌剂除臭效果评估
嗅觉影响分析评估见表2。

表2 恶臭评判标准
产氨气检测:将湿润的红色石蕊试纸贴于盛有样品的一次性塑料盒盖,盖上盖子3 min后读取颜色,红色石蕊试纸遇氨气变紫。
产硫化氢检测:将湿润的醋酸铅试纸贴于盛有样品的一次性塑料盒盖,盖上盖子3 min后读取颜色,醋酸铅试纸遇硫化氢变黑。
1.2.9 氨气去除率计算
称取24份猪粪样品置于一次性塑料盒中,每份250 g,将其分为7个试验组,1个对照组,每组设置3个重复。试验组分别加固体菌剂、液体菌剂1、液体菌剂2、液体菌剂3、市售液体菌剂1、市售液体菌剂2、市售液体菌剂3,加无菌水作为对照。与猪粪充分混匀。然后将盛有20 mL稀硫酸的小烧杯平稳放入一次性饭盒中,加盖密封,吸收氨气。每2 天吸取1 mL稀硫酸样品,10 天后取样结束,利用凯式定氮法测氨。
氨气去除率=
2 结果与分析
2.1 菌株生长曲线测定
通过检测各菌株不同生长时间的OD600值,绘制出菌株生长曲线。图1结果显示,在30℃,200 rpm摇床单独培养相同条件下,菌株A~E在8~20 小时达到对数生长期,菌株A,B,C,E在20~28 h进入平稳生长期,菌D在28~36 h进入衰退期,之后生长平稳。
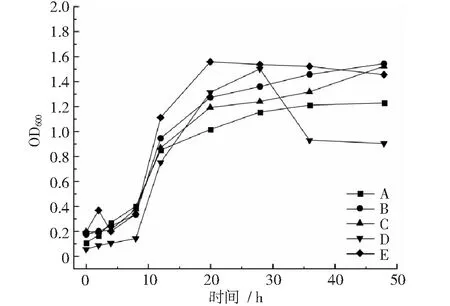
图1 菌株A~E生长曲线
图2~图4显示,菌株F在20~28 h进入衰退期,之后生长平稳。菌株G在4~12 h达到对数生长期,12~48 h生长平稳;菌株H,I,J,L,M在8~28 h进入对数生长期,第28 h以后开始衰退。菌株O在8~28 h达到对数生长期,28 h以后生长开始衰退;菌株S在12~28 h内达到对数生长期,之后生长较为平稳;菌株P,Q,R,T在4~8 h内进入对数生长期,在8~48 h内,菌株P,R,T增长缓慢,生长较为平稳,菌株Q在8~12 h内生长衰退,12~20 h内菌数开始增长,20 h以后生长平稳。
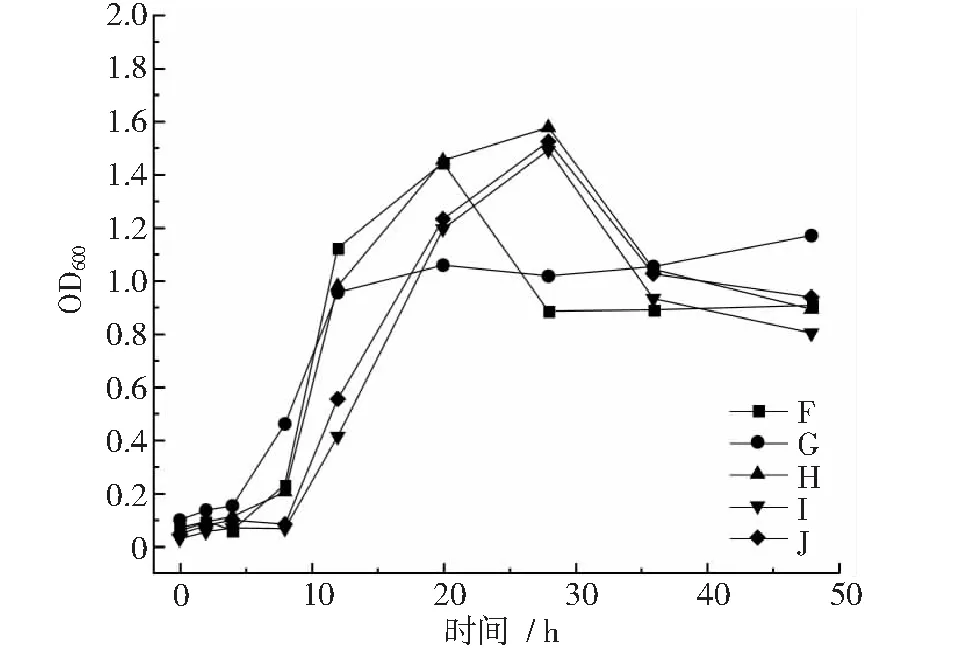
图2 菌株F~J生长曲线
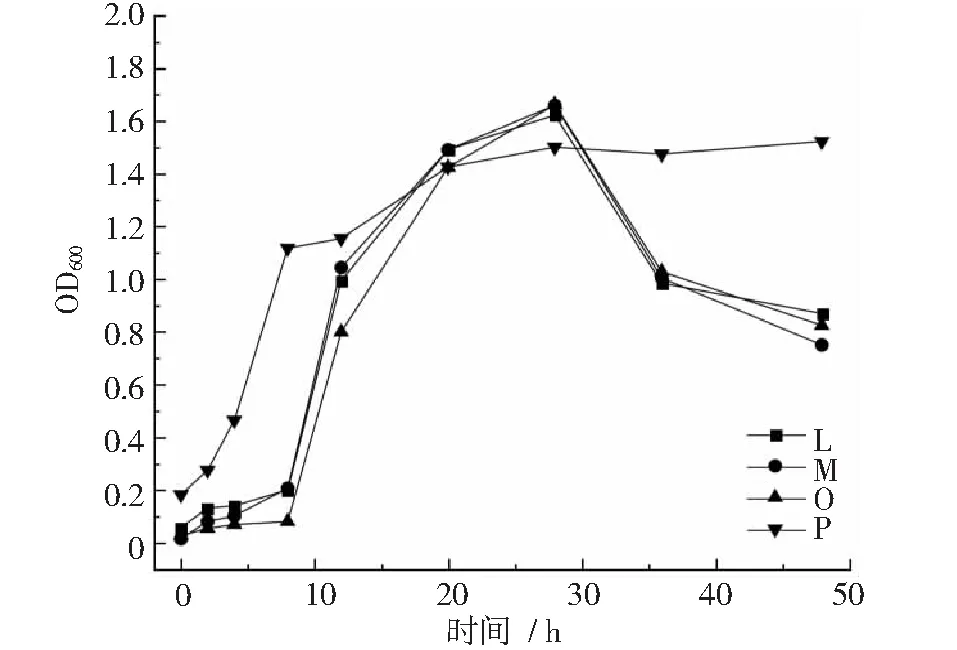
图3 菌株L~P生长曲线
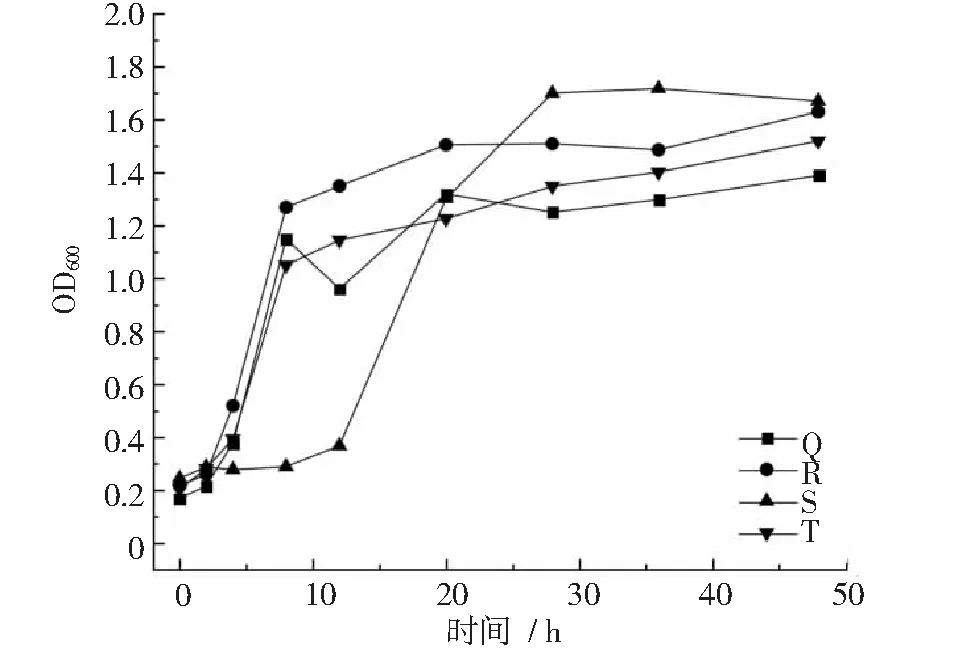
图4 菌株Q~T生长曲线
综上所述,菌株A~F,H~O均在8 h后进入对数生长期,对数生长期均在12 h以上,部分菌株对数生长期后进入平稳生长期,48 h以内不会有衰退期,平稳生长期均时长超过12 h,如菌株A,B,C,E,F 等,但是H,I,J,L,M,N等菌株在28 h以后进入生长衰退期。菌株G,P,Q,R,T等在4 h后进入对数生长期,对数生长期持续时长约4 h,均在4 h以
后的不同时间进入平稳生长期,平稳生长时间超过对数生长期。因此,按照对数生长期收集菌体作为与载体复配的时间节点,菌株G和R分别在培养10.4 h和7.2 h收集,其他菌株均在培养17.6 h以后收集菌体。
2.2 菌株间拮抗作用分析
通过平板交叉划线法探究各菌株间的拮抗作用,观察交叉点处的菌株生长情况,如表3所示:18株微生物之间无相互抑制效应。微生物之间的拮抗作用是指一种微生物的生长和代谢活动,对其他微生物产生抑制、干扰或毒害作用。拮抗作用一般具有专一性或特异性,本研究中所筛选菌株为乳酸菌、酵母菌和芽孢杆菌,此3类广泛共存于环境中。

表3 菌株的拮抗性
2.3 固体菌剂载体吸水性能测定
选择沸石粉、稻壳粉和玉米秸秆粉作为备选载体,不同载体吸水率测定结果显示(见图5):沸石粉吸水较快,吸水量较少,吸水率为46%,搅拌后呈糊状;稻壳粉加水后吸水较慢,吸水量居中,浮于水面缓慢吸收水分,吸水率为195.3%,玉米秸秆粉吸水最快,吸水量最高,吸水率为600.3%。不同载体pH值测定结果显示:沸石粉pH值最高,为8.10,稻壳粉次之,pH值为7.71,玉米秸秆最低,pH值为7.51。
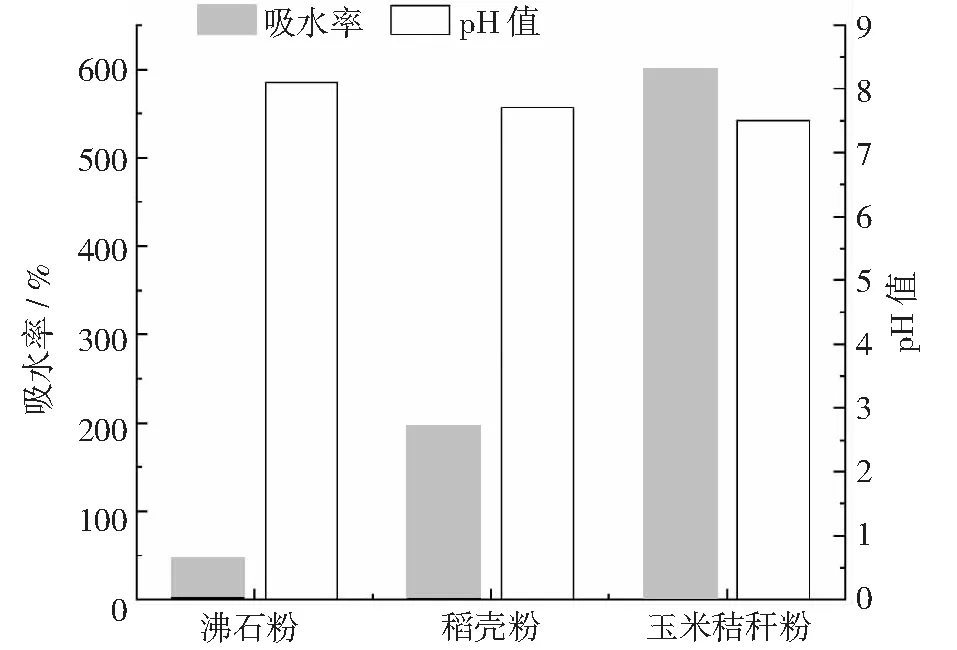
图5 不同载体吸水性能和pH值
因此,沸石粉吸水率最低,pH值最高,不适合作为固体菌剂载体;稻壳粉吸水率,pH值次之,但是其吸水速率较慢;玉米秸秆粉吸水率最高,吸水速度较快,pH值更接近中性,故最终选择玉米秸秆粉作为固体菌剂载体。
2.4 载体与菌剂配制为固体菌剂后活菌数测定
通过检测载体和菌剂复配后第0天,20天,40天的活菌数评估制备效果。第0天的接菌数为1.4483×1010个·g-1,活菌数1.0628×1010个·g-1。
活菌数测定结果显示(见图6),第20 天的活菌数为6.02×109个·g-1, 20 天后活菌率为56.64%;第40 天的活菌数为2.003×109个·g-1,即 40 天后活菌率为33.27%。根据农用微生物菌剂产品的技术指标显示,粉剂型有效活菌数应不少于2.0×108个·g-1,且保质期应不少于6个月,自制复合菌剂20 天和40天后符合规定标准。
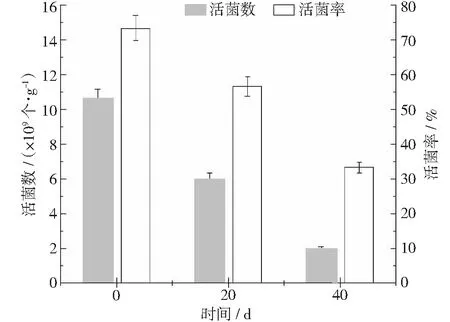
图6 固体菌剂不同时间的活菌数
2.5 培养液配方对液体菌剂活菌数的影响
经过香料配方初步筛选,选择了3种感官较好的配方,配方1(Ⅰ∶Ⅱ∶Ⅲ∶Ⅳ=2∶3∶3∶7),配方2(Ⅰ∶Ⅴ∶Ⅵ∶Ⅶ=1∶2∶3∶1),配方3(Ⅱ∶Ⅵ∶Ⅲ=5∶2∶2)。考察了在不同配方培养液下,对菌剂总活菌数的影响。从图7可以看出,3种配方培养下,总菌数都在1010个·mL-1以上,其中配方2条件下活菌数最高。

图7 3种培养液条件下液体菌剂的活菌数
2.6 菌剂对猪粪臭气及氨气的去除效果评估
结果显示(见表4)配方3和市售菌剂3除臭效果最好,勉强可以闻到气味,配方2次之,气味很弱,固体菌剂、配方1和市售菌剂3除臭效果不明显,很容易能感觉到气味,市售菌剂2除臭效果最差,可以闻到强烈的气味。

表4 菌剂除臭效果分析评估
2.7 氨气去除率计算
实验室条件下,在猪粪存储盒中使用菌剂,测定其氨气的积累量。结果表明(见图8):在2 天以后,固体菌剂开始积累氨气,3 天以后,除液体菌剂3之外的2种液体菌剂和3种市售菌剂开始积累氨气,其氨气积累量由多到少依次为固体菌剂、市售液体菌剂1、市售液体菌剂3、液体菌剂1、液体菌剂2。液体菌剂3在4 天以后开始积累氨气,且氨气积累量比其它菌剂少,产生速率慢。
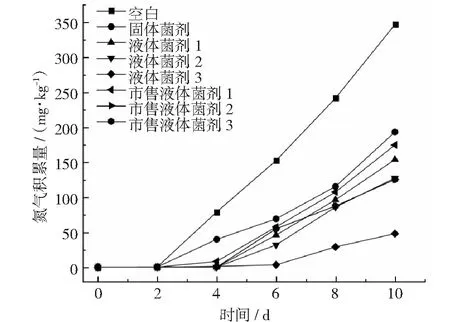
图8 不同剂型除臭剂施用后猪粪的氨气积累量
氨气去除率结果表明(见图9):在0~2 天内,除固体菌剂外,其它菌剂在第2 天时,氨气去除率达100%。2~6 天内,液体菌剂3氨气去除率保持在100%,第4 天以后,其它均菌剂氨气去除率开始降低,但是市售液体菌剂3的氨气去除率在4天以后保持在60%以上。通过除氨率实验结果可以看出,在液体菌剂中,液体菌液3的降低氨气产生效果最为显著。
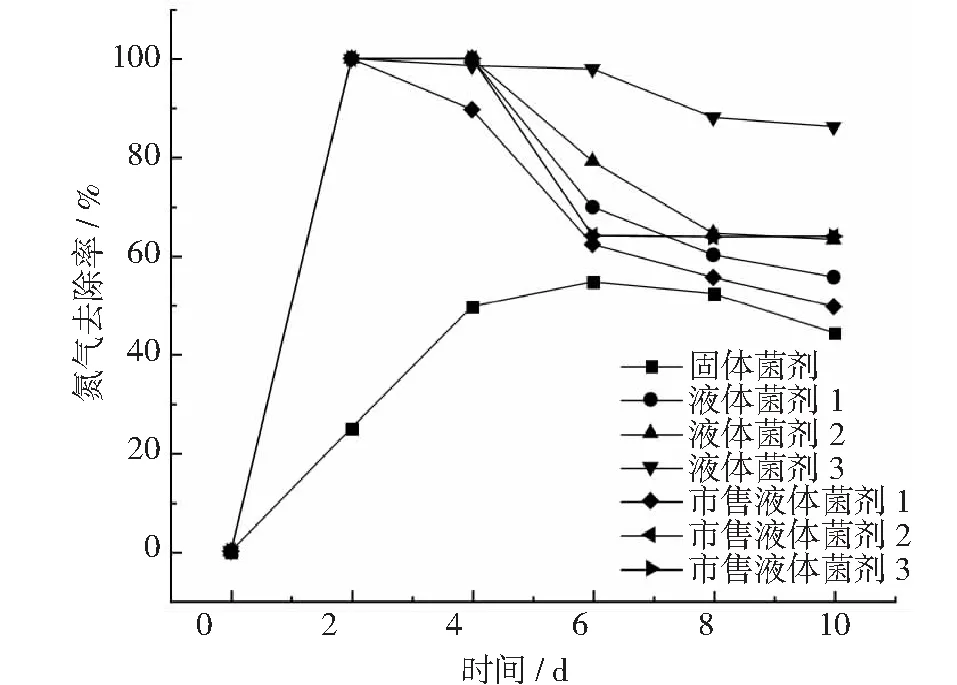
图9 不同剂型除臭剂施用后猪粪的氨气去除率
固体菌剂在前4 天起效较液体菌剂慢,可能因素是固体菌剂在猪粪中定殖需要一段时间,但是在菌剂施用第4 天到第10 天氨气去除率达到50%以上,效果和液体菌剂相当,具有非常好的实际实用潜力。
3 讨 论
在畜禽养殖方面,养殖圈舍和粪便储存处理过程中产生的氨气造成土壤酸化以及水体富营养化等问题日趋严重[10]。据统计,农业畜禽养殖氨排放量自1975年至2005年增加5100 kg,增幅达44.7%[11]。目前,部分畜禽养殖场通过粪尿分离减少部分臭气的产生与排放,但是后续的粪尿处理存在较大的缺陷,刘娟[12]等研究发现粪尿酸化可显著降低氨气排放。据了解,也有研究使用菌剂处理畜禽粪尿,但是效果和稳定性有待提高。目前关于除臭菌剂载体选择和效果评价尚没有报道,故本研究从菌剂载体的角度出发,通过筛选一些具有一定除臭作用的菌株,与载体复配,优化配制条件,初步应用于猪粪储存,检测除臭效果,结果显示液体除臭菌剂在使用2 天之后,氨气去除率能达到100%,4 天之后略有降低,但维持在80%以上。固体菌剂效果要比液体菌剂起效慢4 天左右,总体效果低50%,但是因其具有运输方便和施用简易的特点,也具备很好的现实使用意义。
本研究虽然筛选出载体种类以及菌剂配方,做了初步效果评估,但是也有许多不足有待进一步探究: 1)本研究菌剂只做了猪粪发酵探究除臭效果,其他畜禽粪便除臭效果如何有待进一步探究; 2)菌剂对于其它恶臭气体的去除率尚需要评估; 3)菌剂处理后的畜禽粪便能否再次利用,利用价值如何有待进一步探究。
