海洋来源的Omega-3不饱和脂肪酸对超重、肥胖患者脂联素、瘦素影响的随机对照实验Meta分析
2021-02-24王文婷李兆钰
王文婷,姜 萍,郭 超,王 琳,李兆钰,李 晓
(1.山东中医药大学第一临床医学院,2.山东中医药大学附属医院,山东 济南 250014)
超重和肥胖是以体重指数(body mass index BMI)≥25 kg/m2为基准的一种慢性代谢性疾病,它是引起高血压、糖尿病、心脑血管病等多种慢性非传染性疾病的的重要危险因素和病理基础。在过去的50年间,肥胖已成为影响生活质量、增加患病风险和提高医疗支出的国际公共卫生问题,引起了全球医学界的广泛关注[1]。调查显示,从1975~2014年,全球男性和女性的BMI呈现持续上升趋势,中国已成为肥胖人口上升最快的国家[2]。脂肪组织除了作为脂质储存能量以帮助机体正常代谢以外,还因其能够分泌具有生物活性的脂肪细胞因子而被称为“内分泌器官”。包括脂联素、瘦素以及炎性因子白介素(interleukin IL)-6、肿瘤坏死因子(tumor necrosis factor TNF)-α等,在维持脂质、葡萄糖、能量代谢稳态中发挥重要作用[3]。在超重和肥胖个体中,脂肪源性的促炎细胞因子如IL-6、TNF-α、脂肪因子瘦素浓度增加,而具有抗炎作用的脂联素浓度减少[4]。有研究指出脂联素/瘦素比例失调是引起脂肪组织功能障碍的原因,其在肥胖、糖尿病、代谢综合征等疾病中呈低比率,并与炎症代谢标志物高度负相关[5]。尽管饮食和生活方式干预仍是肥胖治疗的主要措施,但针对实际的炎症分子或通过调节炎症级联来治疗和干预肥胖已成为研究的热点和趋势,这其中通过抑制瘦素或增加脂联素浓度的药物在临床中得到了良好应用[6]。
脂质是人类日常饮食中的关键营养素,通过服用鱼油或食用肥鱼而获得的Omega-3 不饱和脂肪酸(Omega-3 polyunsaturated fatty acids Omega-3 PUFA),包括二十碳五烯酸(Eicosapentaenoic acid EPA)和二十二碳六烯酸(Docosahexaenoic acid DHA)已被证实具有心脏保护、抗炎和抗高甘油三酯血症的作用[7]。2015~2020年美国饮食指南建议每天食用8盎司海鲜,即250 mg EPA、DHA[8]。然而许多研究发现,食用鱼类或鱼油并没有确切的抗肥胖作用[9]。但多项动物和人体试验显示,Omega-3 PUFA能够调节脂肪因子的分泌[10,11]。肥胖是一种低度炎症反应,伴随着脂肪过度堆积和体重异常,而脂联素和瘦素作为脂肪功能的体现,其分泌和浓度增减受到海洋来源Omega-3 PUFA的影响。目前为止,已经进行了各种研究来评估海洋来源的Omega-3 PUFA对肥胖和超重个体脂联素和瘦素水平的影响,但是报道了相互矛盾的结果,并未获得统一的认识。因此通过对现有的随机对照实验进行Meta分析和系统评价,综合评估海洋来源的Omega-3 PUFA对超重肥胖个体血清脂联素瘦素水平的影响,为临床鱼油的辅助使用和鱼类饮食干预治疗肥胖提供指导。
1 资料与方法
1.1 文献来源与检索策略
通过计算机在PubMed、Cochrane Library、Embase、中国知网在内的电子数据库中进行系统搜索,检索时间为自建库起至2020年4月25日,中文检索词为:“鱼油”、“omega-3不饱和脂肪酸”、“肥胖”、“超重”、“脂肪因子”,英文检索词为:“overweight”、“obesity”、“fish oils”、“omega-3 fatty acids”、“adiponectin” 、“leptin”。采用主题词和自由词相结合的策略检索。出版语言限制为中文和英文。并对获取的文献进行重复筛选。
1.2 文献纳入与排除标准
1.2.1纳入标准 (1)RCT研究;(2)超重(BMI 25~29.9 kg/m2)或肥胖(BMI≥30 kg/m2)成年患者(年龄≥18岁);(3)无其他疾病史,如糖尿病、冠心病、中风、慢性炎症或精神疾病;(4)以富含海洋Omega-3 PUFA为干预的研究;(5)明确基线和干预后血清脂肪因子浓度并评估Omega-3 PUFA效果。
1.2.2排除标准 (1)对儿童或青年进行的研究;(2)对动物或培养细胞的研究;(3)干预措施为Omega-3 PUFA以外的化合物或与其他组分组合的化合物的研究;(4)评价指标不清楚的研究;(5)各种观察性研究、病例报告、系统综述和荟萃分析研究;(6)无法通过各种渠道获得全文的研究;(7)原始研究中的数据不能用于本次研究。
1.3 资料提取与质量评价
1.3.1资料提取 由两位作者分别进行文献标题摘要的检索与筛选,确定符合条件的研究,阅读全文和提取数据。并由第三位作者进行争议的处理。从符合条件的文章中提取的数据包括第一作者的姓氏、发表年份、人口统计学(包括纳入和分析的受试者数量)和人体测量因素(年龄、性别、体重指数)以及Omega-3 PUFA的剂量、干预方式、干预持续时间,安慰剂类型和研究设计特征。根据基线和干预结束时的平均标准差提取脂联素和瘦素水平的变化。在一项研究中报道了2种不同鱼类食物和鱼油对肥胖患者瘦素的影响,因此在meta分析中将其视为3个独立实验,具有3种不同效应[12]。此外,有3项研究来自于同一个课题组,但其干预持续时间、受试者数量和生活控制方式均不同,因此均纳入本项研究中[13-15]。
1.3.2质量评价 依据Cochrane协作组推荐使用的Cochrane偏倚评估工具对纳入试验进行方法学质量的评价,从选择、实施、测量、随访、报告和其他六个方面进行,包括随机序列产生,分配隐藏,盲法的设计和实施(分配者、受试者施盲),研究结果盲法评价,随访结果的完整性和处理,选择性报告研究结果和其他偏倚来源。
1.4 统计学处理
本研究采用Cochrane协作组提供的Revman 5.3软件进行统计学分析。主要结果为血清脂联素和瘦素水平的变化,从文献中提取的数据均为连续性数据,以标准化平均差异(SMDs)及其95%的置信区间记录每个结果的影响大小。I2统计量用于量化异质性的影响和评估不一致性。当I2≥50% 认为有统计学异质性,采用随机效应森林图模型。若I2<50%则认为无统计学差异并采用固定效应模型进行分析。同时进行了敏感性分析,以评估每项研究对最终结果的影响和结果的稳健性。针对药物剂量、Omega-3 PUFA补充剂的类型进行亚组分析,以确定研究间潜在的变异来源。
2 结果
2.1 文献检索结果
通过检索策略从电子数据库共获得了818篇文献,通过计算机过滤软件删除重复文献228篇,阅读标题和摘要后排除不符合要求的文献556篇并纳入35篇文献进一步获取全文,经过资格审查,最终有8篇文献被纳入meta分析中,27篇文献因为各种原因被排除在研究之外,具体流程见图1。

图1 文献检索流程Fig 1 Flowchart of document retrieval process
2.2 文献纳入特征与质量评估结果
2.2.1文献纳入特征 最终有8项随机对照实验符合纳入标准,共包括607名参与者,8项研究有3项研究只报道了Omega-3 PUFA对瘦素水平的影响[12,13,16],1项研究只报道了Omega-3 PUFA对脂联素水平的影响[14],有4项研究同时讨论了Omega-3 PUFA干预后瘦素和脂联素的变化情况[15,17,18,19]。3项研究的干预方式为含鱼饮食[12,13],其余为食用鱼油胶囊。本研究纳入的大多数随机对照实验将生活方式纳入其试验方案。令受试者保持常规活动水平并纳入一定热量的饮食,监测其每日热量摄入。具体文献纳入特征见表1。

表1 文献特征表
2.2.2文献质量评估 共纳入8篇文献,均为随机对照实验。其中有1项研究采用交叉分配的随机方法[12],1项研究并未描述随机方法[14]。有2项实验为开放标签[12,15],存在分配隐藏风险,另3项研究描述了随机方法的生成,不存在隐蔽分组情况[16,17,19]。其余研究未提及。大多数研究采用盲法,有2项实验未使用盲法可能对结果产生偏倚[13]。7项研究有病例脱落现象,但有4项研究对病例脱落情况作出详细说明并分析对结局的影响。有2项研究并未提供最初的研究计划[12,14],因此不确定是否存在选择性报道。全部研究不存在其他偏倚。各研究具体质量评估见图2。

图2 质量评估图Fig 2 Quality assessment chart
2.3 研究结果
2.3.1脂联素变化水平 共有5项研究报道了脂联素的变化情况,涉及209例受试者,分析存在临床异质性(I2=60%),采用随机效应模型,海洋来源的Omega-3 PUFA并未明显增加血清脂联素水平[SMD=0.32,95%CI=(-0.13,0.76),P=0.16]。见图3。
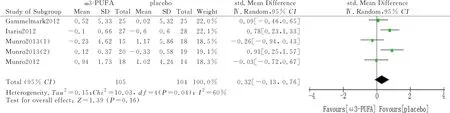
图3 脂联素变化水平森林图
2.3.2瘦素变化水平 共纳入7项研究,其中一项研究涉及3种不同效应,总计575例受试者。分析存在临床异质性(I2=64%),故采用随机效应模型。海洋来源的Omega-3 PUFA并未明显降低瘦素水平[SMD=-0.22,95%CI=(-0.53,0.09),P=0.16]。见图4。

图4 瘦素变化水平森林图
2.3.3敏感性分析和亚组分析 因两项Meta分析结果均产生临床异质性,因此为寻找异质性来源,进一步进行敏感性分析。在脂联素水平的研究中,经过分析,发现异质性可能来源于Itariu等[15]的研究,究其原因,可能是因为其受试对象为严重肥胖的患者,将其剔除后再次合并,异质性仍然存在(I2=55%),根据Omega-3 PUFA中EPA/DHA的比值是否>1进行亚组分析,结果显示Omega-3 PUFA的使用未明显增加脂联素水平,且在亚组之间没有观察到明显差异。因此不能确定异质性的来源。见图5。
在瘦素水平的研究中,将异质性来源的研究[15]剔除,此时异质性较低(I2=14%),则说明此项研究很可能是造成异质性的原因。先前所得的结果并不稳固。对于严重肥胖的患者,Omega-3 PUFA能够降低血清瘦素。根据初始设计的亚组,针对给药方式为胶囊和含鱼饮食以及每日用量是否>3 g进行亚组分析,结果均无明显变化(I2=64%),两种不同的给药方式均能降低血清瘦素水平,组间无明显差异。当每日用量大于3 g时,大剂量的Omega-3 PUFA使用对于降低血清瘦素的作用更加明显。见图6。
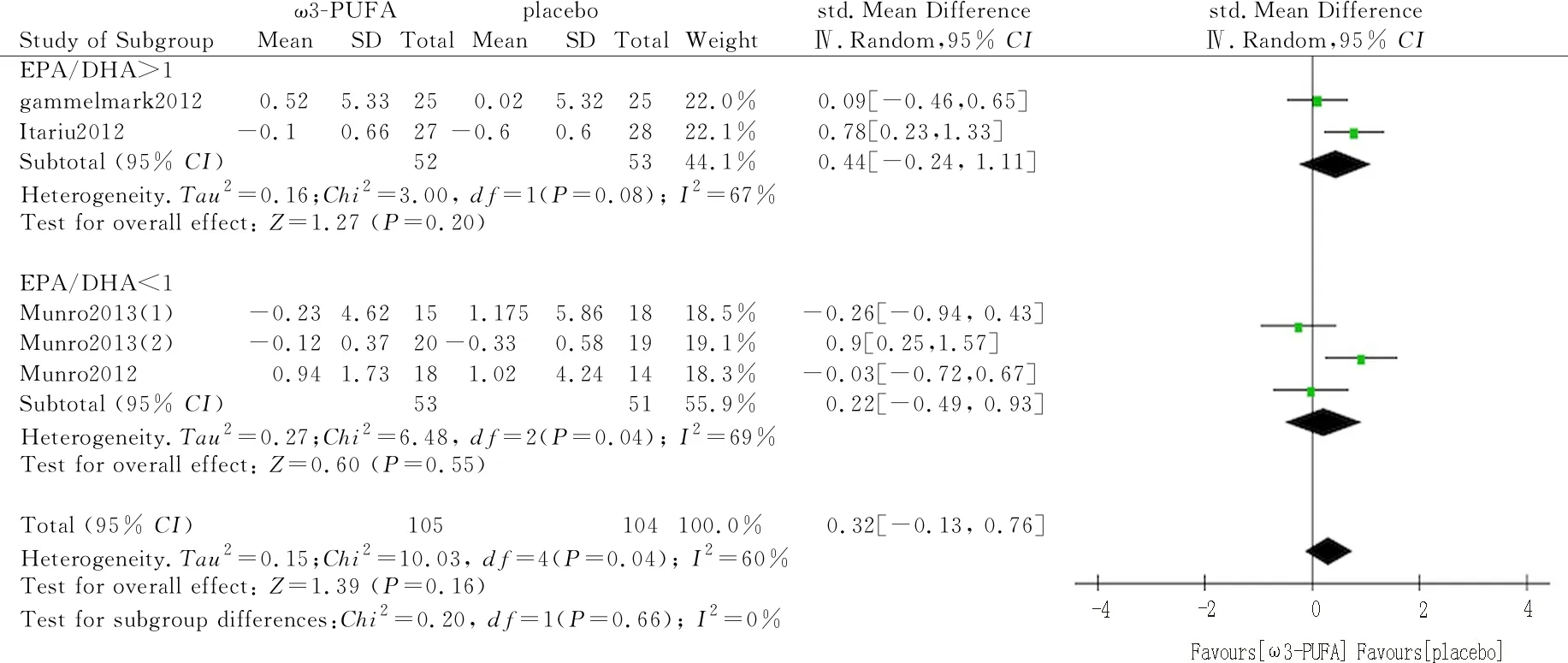
图5 EPA/DHA比值对脂联素影响亚组分析

图6 海洋来源Omega-3 PUFA每日用量对瘦素影响亚组分析
3 讨论
肥胖作为慢性低度炎症,其特征是脂肪细胞、巨噬细胞以及肠道菌群等过度分泌炎症介质,因此越来越多的临床、动物实验将焦点转向具有调节炎症反应的治疗干预手段,以此减轻病态肥胖带来的机体炎性负担[20]。Omega-3 PUFA为人体不可或缺的营养素,必须从食物中获得,包括植物来源的亚麻酸(alpha linolenic acid, ALA)和海洋来源的EPA、DHA[21]。其在炎症方面作用机制大体分为两个方面,首先是与过氧化物酶体增生物活化受体(peroxisome proliferator activated receptor, PPAR)在脂肪细胞和炎性细胞上相互作用,调节空腹甘油三酸酯水平,胰岛素敏感性和炎性介质;其次是抑制NF-κB和早期信号蛋白的激活,减少促炎因子TNF-α、IL-6的释放[22]。同时,许多临床和基础研究也发现,脂联素和瘦素可以通过自分泌或旁分泌调节炎症因子的分泌和胰岛素抵抗,而这一过程可以被Omega-3 PUFA所影响[23]。
本研究旨在评估海洋来源的Omega-3 PUFA对两种重要的肥胖相关脂肪因子脂联素和瘦素的影响。结果显示,Omega-3 PUFA能够降低肥胖超重患者的瘦素水平,尽管结果并不显著,但对于严重肥胖的患者作用效果较好。大剂量的Omega-3 PUFA作用效果明显优于小剂量。同时Omega-3 PUFA也能提高患者脂联素水平,但效果并不明显,且并未完全找到研究出现异质性的原因,但可为该方向的未来研究提供一定依据。
本研究仍然存在着一定的局限,由于此领域的研究数量少、样本量小,因此纳入的研究有限且文献质量不一。因此还需要更大规模、多中心和安慰剂对照的长期试验,调查补充海洋来源的Omega-3 PUFA在治疗超重和肥胖炎症方面的长期效果。
