脓毒性休克患者血清Kal、VE-Cad 水平变化及其预后预测效能
2021-02-24李超王军辉赵麦良
李超,王军辉,赵麦良
邢台市人民医院,河北邢台054031
脓毒症是因感染引起的全身炎症反应综合征(SIRS),是非心血管疾病ICU 患者死亡的主要原因,其病理机制复杂,尚缺乏有效药物[1],若出现严重细胞代谢紊乱和循环障碍,则会引起脓毒性休克(SS)。SS 起病急、进展迅速、病死率极高,故及早准确评估病变程度和预后,对提升其生存率具有重要意义。目前主要通过急性生理和慢性健康评估系统(APACHEⅡ)评分与全身性感染相关性器官功能衰竭系统(SOFA)评分评估SS 患者预后,但评分系统使用过程中难免受主观或客观因素的影响,评估价值有限,且评分使用繁琐,耗时较长,不够简便。研究表明,氧化应激和炎性反应损伤血管内皮,导致毛细血管渗漏是SS重要病理过程[2]。内皮屏障的完整由细胞黏附连接维持,而内皮细胞(EC)连接又由连环蛋白和血管内皮钙黏蛋白(VE-Cad)的复合体维持,因此VE-Cad 在SS 病理过程中扮演重要角色[3]。人源性激肽释放酶结合蛋白(Kal)为一种丝氨酸蛋白酶抑制剂(SERPIN),具备抗细胞凋亡、抗血管生成、抗氧化应激、抗炎等多种生物学作用[4]。研究显示,Kal 可有效缓解冠状动脉病变因氧化应激而引起的细胞凋亡和炎症[5]。目前有关血清VE-Cad、Kal对SS患者预后评估价值的报道较少,本研究观察了SS患者血清VE-Cad、Kal水平变化,探讨了其对患者预后的预测效能。
1 资料与方法
1.1 临床资料 选取邢台市人民医院2017年1月—2019 年12 月收治的201 例SS 患者为观察组。纳入标准:符合《中国严重脓毒症/脓毒性休克治疗指南(2014)》[6]中SS 诊断标准;患者及家属均知情研究;临床资料完整者;依从性良好者;无毒品、酒精、烟草依赖者。排除标准:年龄<18岁;住院时间<1 d;肿瘤晚期者;严重免疫抑制者;严重免疫缺陷者。根据28 d 预后情况分为死亡组与存活组。死亡组65 例,其中男34 例、女31 例,年龄45~82(64.13 ± 4.63)岁,感染部位:血流感染6 例、腹腔7 例、泌尿道12例、呼吸道34 例、其他部位6 例。存活组136 例,其中男75例、女61例,年龄46~80(63.02±5.24)岁;感染部位:血流感染14例、腹腔11例、泌尿道27例、呼吸道72例、其他部位12例。观察组入院后均根据《中国严重脓毒症/脓毒性休克治疗指南(2014)》进行 治疗。入 院当 日 进 行SOFA[7]及APACHE Ⅱ评估[8]。另选取同期200例体检健康者为对照组,其中男104 例、女96 例,年龄44~80(64.21 ± 4.78)岁。观察组与对照组年龄、性别有可比性。本研究经本院伦理委员会批准。
1.2 血清Kal、VE-Cad 的检测 采集观察组入院后第1、3、5 天清晨与对照组体检时3 mL 空腹静脉血,3 000 r/min 离心10 min,取上清液,酶联免疫法(上海晶抗生物工程有限公司)检测血清Kal、VE-Cad。
1.3 SS 患者预后相关其他指标的检测 观察组入院当日使用PICCO 监测仪(德国PULSION 公司)监测血管外肺水指数(EVLWI),连续进行3次,取平均值。监测吸氧浓度(FiO2)和动脉血氧分压(PaO2),计算氧合指数(OI)=PaO2/FiO2。抽取观察组入院后1 d清晨与对照组体检时3 mL 空腹静脉血,3 000 r/min离心10 min,取上清液,置于-80 ℃环境下保存,BRED 全自动生化免疫分析仪(深圳市博锐德生物科技有限公司)检测血清白蛋白(ALB)、降钙素原(PCT)、C反应蛋白(CRP)、白细胞计数(WBC)。
1.4 统计学方法 采用SPSS26.0 统计软件。计量资料以表示,比较采用t 检验,组间不同时间段比较采用重复测量方差分析;计数资料以例(%)表示,比较采用χ2检验;相关性采用Pearson 相关性分析;多因素逐步Logistic 回归分析SS 患者死亡影响因素;绘制ROC,分析血清VE-Cad、Kal 检测预测SS患者预后的价值。P<0.05为差异有统计学意义。
2 结果
2.1 两组血清VE-Cad、Kal水平比较 观察组血清VE-Cad、Kal 水平分别为(2.97±0.59)ng/mL、(5.80± 3.04)μg/mL;对照组分别为(0.27 ± 0.06)ng/mL、(81.84 ± 23.26)μg/mL;两组血清VE-Cad 比较,t=64.387,P=0.000;两 组 血 清Kal 水 平 比 较,t=45.955,P=0.000。死亡组与存活组各时间段血清VE-Cad、Kal 水平比较,F 分别为85.572、62.211,274.510、158.502;P 分别为0.000、0.000,0.000、0.000;死亡组第1、3、5 天血清VE-Cad 水平高于存活组(t分别为11.461、12.666、16.475,P 均<0.05),血清Kal 水平低于存活组(t 分别为8.740、11.680、13.504,P 均<0.05)。死亡组与存活组不同时间血清VE-Cad、Kal水平见表1。
表1 死亡组与存活组不同时间血清VE-Cad、Kal水平()
组别死亡组入院第1 天入院第3天入院第5 天存活组入院第1天入院第3天入院第5天n VE-Cad(ng/mL)Kal(μg/mL)65 3.51±0.36 3.09±0.70 2.36±0.39 2.36±0.55 3.10±0.38 3.36±0.63 136 2.69±0.52 2.02±0.48 1.34±0.42 3.38±0.86 4.28±0.77 5.39±1.13
2.2 死亡组与存活组感染部位、病原学分布及临床资料比较 死亡组感染部位在血液、腹腔、泌尿道、呼吸道、其他者分别为6(9.23%)、7(10.77%)、12(18.46%)、34(52.31%)、6 例(9.23%),存活组感染部位在血液、腹腔、泌尿道、呼吸道、其他者分别为14(10.29%) 、11(8.09%)、27(19.85%)、72(52.94%)、12 例(8.82%),两组呼吸道及其他部位感染阳性率比较,χ2值分别为0.007、0.009,P 均<0.05。两组血流感染、腹腔感染、泌尿道感染阳性率比较,χ2值分别为0.055、0.388、0.054,P 均>0.05。死亡组感染真菌、革兰阳性杆菌、革兰阴性杆菌、混合感染、不明确者分别为6(9.23%)、10(15.38%)、17(26.15%)、10(15.38%)、22 例(33.85%),存活组分别为7(5.15%)、20(14.71%)、47(34.56%)、17(12.50%)、45 例(33.09%),两组比较,χ2值分别为1.212、0.016、1.432、0.315、0.011,P 分别为0.271、0.899、0.232、0.575、0.915。
死亡组男/女为34/31 例,年龄(64.13 ± 4.63)岁;存活组男/女为75/61例,年龄(63.02±5.24)岁。两组性别、年龄比较,P 均>0.05。死亡组ICU 住院时间、机械通气时间、ALB、EVLWI、OI、PCT、CRP、WBC、SOFA 评分、APACHE Ⅱ评分分别为(9.09 ±1.49)d、(67.92 ± 11.13)h、(24.68 ± 2.79)g/L、(8.40 ± 2.21)mL/kg、(222.40 ± 22.43)mmHg、(12.28 ± 3.19)pg/mL、(138.28 ± 28.44)μg/mL、(13.27 ± 28.44)×109/L、(10.57 ± 2.46)分、(29.47± 3.47)分,存活组分别为(7.38 ± 1.20)d、(56.91± 8.21)h、(28.11± 4.25)g/L、(5.38± 1.66)mL/kg、(287.27 ± 40.24)mmHg、(8.26 ± 3.76)pg/mL、(75.55 ± 19.36)μg/mL、(14.69 ± 19.36)×109/L、(8.84 ± 1.84)分、(23.27 ± 4.04)分,除了WBC 外,两组其余指标比较,t 分别为8.721、7.893、5.921、10.798、12.129、7.433、18.342、5.570、10.636,P 均<0.05。
2.3 入院1 d 死亡组血清VE-Cad、Kal 水平与SO‑FA、APACHE Ⅱ评分的相关性 观察组SOFA、APACHE Ⅱ评分分别为(9.61 ± 2.21)分、(25.64 ±5.15)分;对照组分别为(2.61 ± 0.62)、(6.11 ±1.20)分;两组SOFA 评分比较,t=43.137,P=0.000;两组APACHE Ⅱ评分比较,t=52.238,P=0.000。入院1 d 死亡组血清VE-Cad 水平与SOFA、APACHEⅡ评分呈正相关(r 分别为0.460、0.586,P 均<0.05);血清Kal 水平与SOFA、APACHE Ⅱ评分呈负相关(r分别为–0.598、–0.630,P<0.05)。
2.4 SS患者死亡影响因素 以SS患者28 d预后状况为因变量(赋值:死亡=1;存活=0),以死亡组与存活组有差异的因素为自变量,多因素逐步Logistic 回归分析显示,EVLWI、VE-Cad为SS患者死亡危险因素,Kal为SS患者死亡保护因素(P均<0.05),见表2。

表2 SS患者死亡影响因素多因素逐步Logistic回归分析结果
2.5 入院1 d 血清VE-Cad、Kal 检测对SS 患者预后的评估效能 入院1 d 血清VE-Cad 联合Kal 检测预测SS 预后的曲线下面积(AUC)大于血清VE-Cad、Kal 单独检测(Z 分别为3.027、4.359,P 均<0.05),准确率、灵敏度、特异性也高于VE-Cad、Kal 单独检测,见图1、表3。
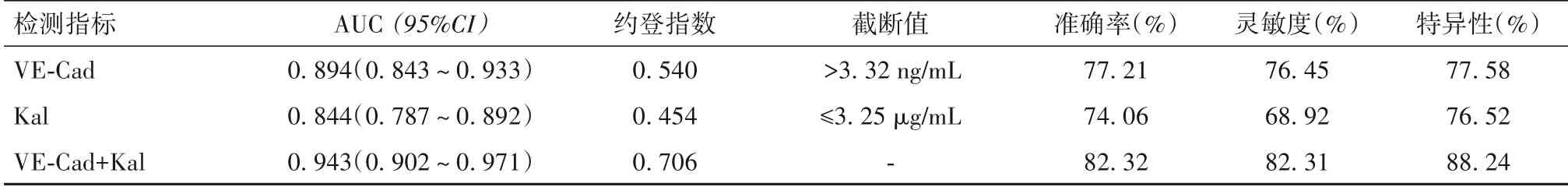
表3 入院1 d血清VE-Cad、Kal预测SS预后的准确度

图1 血清VE-Cad、Kal检测预测SS预后的ROC
3 讨论
脓毒症主要因宿主对感染反应失调而导致,随着病情的加重,可发展为SS,死亡风险较单纯脓毒症明显提升[9]。虽然近年来医学界对SS的发病机制和治疗等有了更好的认知,但其病死率依然较高,严重威胁患者生命安全,因此积极探索有效血清生物标志物,评估患者病情严重程度,对改善其预后具有重要意义。研究表明,在多器官功能衰竭和脓毒症的发生及发展过程中细胞凋亡扮演重要角色,该类患者存在广泛的血管内皮细胞凋亡[10]。内皮细胞凋亡可激活凝血系统,促进炎症,引起微循环血栓形成和血管渗漏,导致器官损伤进一步加重。近年多项动物模型研究表明,抑制细胞凋亡能促进器官功能改善,降低患者病死率[11]。同时研究表明,氧化应激和炎症导致血管内皮损伤是SS 核心病理过程[12]。故血管内皮屏障损伤和细胞凋亡成为了脓毒症疾病研究热点。
血管内皮分布于血管壁内层,是调控体液运输、免疫细胞、血管内微环境大分子的保护屏障,若血管通透性保护屏障功能受损,则会引起大量血液渗出,进而出现多种急慢性炎症。血管内皮的屏障功能由细胞间连接(紧密连接和黏附连接)蛋白调控,VECad 则是其中一种黏附蛋白,为构成血管EC 间黏附连接的主要结构分子,广泛分布于EC 细胞膜[13]。VE-Cad 为钙黏素家族成员,由1 个高度保守胞内区尾部和1个跨膜结构域及5个胞外结构域组成,于细胞表面呈顺式二聚体,相连细胞内肌动蛋白支架,维持细胞稳定性,确保血管完整[14]。因其定位于EC与EC的连接上,具备维持血管内皮层结构屏障和完整作用,所以在调节血管内皮通透性中发挥重要作用[15]。研究显示,在血管内皮新生早期,因VE-Cad可限制EC 迁移,并通过自身内吞和磷酸化引起失活,促进细胞迁移和新血管生成,且形成过程中,VE-Cad 水平增加,能促进EC 形成管状结构,建立并维护其血管屏障功能[16]。本研究结果显示,观察组血清VE-Cad 水平升高,提示SS 患者血管内皮屏障明显受损。死亡组与存活组各时间血清VE-Cad 水平对比差异明显,随时间延长呈逐渐升高趋势,且死亡组明显低于存活组,说明血清VE-Cad水平与患者病情严重程度有关,随着治疗时间的延长,病情逐渐好转,其水平也明显降低。存活组ICU 住院时间、机械通气时间、ALB、OI、PCT、CRP、EVLWI、SOFA 评分、APACHE Ⅱ评分均优于死亡组,分析是在氧化应激和炎症的刺激下,血清PCT、CRP 水平明显升高,破坏了VE-Cad 及连接蛋白,导致血管内皮屏障受损,ALB 渗漏到血液,高水平ALB 引起肺水肿,增加EVLWI,降低OI。入院1d 死亡组血清VE-Cad 水平与SOFA、APACHE Ⅱ评分呈正相关,且为SS患者死亡危险因素,进一步说明血清VE-Cad水平与患者预后有明显关系,随着其水平的提升,死亡风险越高。分析是随着SS病情进展,大量炎症介质和细胞因子如血栓素、血小板活化因子、TNF-α、缓激肽、组胺、血管内皮生长因子等均会诱导连环蛋白和VECad 胞内区尾部磷酸化,破坏细胞连接,形成缝隙,增加血管通透性,损害内皮屏障,富含ALB 液体渗漏于组织间隙,引起液体正平衡[17]。李燕玲等[18]研究证实,液体正平衡为SS 患者死亡独立危险因素。因此随着血清VE-Cad 水平的提升,SS 患者死亡风险越高。
Kal 是一种激肽释放酶结合蛋白,可通过蛋白二级结构中中心反应环结合组织型激肽释放酶(TK),参与内皮细胞增殖和血压调节,也可通过蛋白二级结构中肝素结合结构域发挥多种生物学作用。CHEN 等[19]研究显示,Kal 能竞争性结合血管EC 表面肿瘤坏死因子受体1(TNFR1),抑制TNF-α诱导的细胞凋亡信号通路,阻断其激活p38 丝裂原活化蛋白激酶(p38MARK)和核因子-κB(NF-κB),发挥抗炎并抑制EC 凋亡作用。DING 等[20-21]研究显示,Kal 可有效缓解脓毒症造模大鼠炎性反应,减轻器官损伤,提高生存率。本研究结果显示,观察组血清Kal 水平显著降低,提示SS 患者存在明显的血管EC凋亡。死亡组与存活组各时间血清Kal水平对比差异明显,随时间延长呈逐渐升高趋势,且死亡组明显低于存活组,说明血清Kal 水平与患者病情严重程度有关,随着治疗时间的延长,病情逐渐好转,其水平也明显提升。入院1 d 死亡组血清Kal 水平与SOFA、APACHE Ⅱ评分呈负相关,且为SS 患者死亡保护因素,进一步说明血清Kal 水平与患者预后也有明显关系,随着其水平的升高,死亡风险越低。其机制可能是Kal 参与了调控蛋白激酶B-叉头框蛋白O1、磷脂酰肌醇3-激酶-Akt-内皮型一氧化氮合酶(eNOS)、Kruppel样因子4-eNOS等多条细胞通路,调节胞内NO 水平,避免血管损伤,促进内皮祖细胞血管再生能力提高。ROC 显示,入院1 d 血清VE-Cad联合Kal 预测SS 预后的AUC、准确率、灵敏度、特异性均高于VE-Cad、Kal单独检测,说明联合检测血清VE-Cad和Kal水平评估SS患者预后价值更高。
综上所述,SS 患者血清Kal 水平降低,VE-Cad水平升高,二者为SS 患者死亡独立影响因素,血清Kal、VE-Cad 联合检测对SS 预后的评估效能高于单独各指标检测。但本研究为单中心研究,还需多中心大样本研究进一步证实。
