低温等离子体作用下亮氨酸转化路径的密度泛函理论研究
2021-02-24李月慧李先春孟繁锐王焕然葛玉洁
李月慧 ,李先春 ,孟繁锐 ,王 晴 ,王焕然 ,葛玉洁
(辽宁科技大学 化学工程学院,辽宁 鞍山 114051)
随着城市化进程加快,城市污水污泥处理量日益增加。污泥中含有大量的重金属、微生物、寄生虫和悬浮物质等有毒有害物质[1],会对环境及人体健康造成较大危害[2,3],传统的污泥处理方法有卫生填埋、焚烧、土地利用、建材等,但这些处理方法并不能彻底处理污泥,甚至还会产生二次污染。等离子体是物质的第四态,自身具有很高的能量,低温等离子体技术因能耗低、效率高、无二次污染等优点[4],在处理固废方面有较大的潜力。Du 等[5]研究了玉米芯在低温等离子体中气化的应用,发现在不干燥的条件下,气体收率可达到原料的79.0%,以空气为载气时产气率和CO 选择性提高,湿度增加有利于提高产气率及H2含量。孙世翼[6]研究表明,利用低温等离子体技术处理后的污泥中的重金属形态发生改变,能有效提高多种重金属酸溶态比例,导致重金属的浸出能力大幅上升,使污泥毒性降低,更利于填埋。
污泥成分复杂,蛋白质是污泥中的一大组分[7-9],而氨基酸是蛋白质的基本组成部分,有研究者选取氨基酸作为污泥的模型化合物进行探究。其中,Azadi 等[10]、Wang 等[11]分别选取谷氨酸、甘氨酸作为污泥的模型化合物,证明了氨基酸作为污泥模型化合物的可行性。Wei 等[12]选取苯丙氨酸(Phe)、脯氨酸(Pro)、亮氨酸(Leu)、天冬氨酸(Asp)作为具有不同化学结构的污泥模型化合物分析污泥的催化裂解行为。Chen 等[7]和Subrahmanyam等[13]都对污水污泥进行了氨基酸含量的分析,结果均表明亮氨酸的含量较高,占总氨基酸含量的9%-12%。张军[14]通过分析污泥中的蛋白质氨基酸组成及含量特征筛选出污泥的含氮模型化合物中,亮氨酸占比为21%,也是亮氨酸在污泥中具有一定含量的有力依据。因此,选取亮氨酸作为污泥中蛋白质的模型化合物是可行的,并且已有研究人员对亮氨酸的热解行为进行了一定的探索。Li 等[15]通过TG-FTIR 实验对亮氨酸的热解进行研究,结果显示亮氨酸的质量损失过程和热解过程不是同时发生的,亮氨酸首先在294.66 ℃升华,然后在302.56 ℃分解,红外光谱显示的CO2强烈吸收峰证明脱羧反应是主要的分解反应。Wei 等[12]对亮氨酸进行热重分析,发现亮氨酸的失重一步完成,并在500 ℃下对亮氨酸进行催化热解,发现裂解生成的饱和烃侧链促进了轻质烃的生成,能够生成较多的烷烃和烯烃;其次,亮氨酸的氨基和羧基结构受热易脱除并转化为氨和碳氧化物。
目前,对亮氨酸的热解行为有一定的研究,但有关亮氨酸反应路径的详细机理文献中鲜见报道。本文使用量子化学软件Gaussian 计算污泥模型化合物亮氨酸在低温等离子体作用下的分解路径,可为污泥处理的相关研究提供一定的理论基础,也为污泥模型化合物的研究提供了有价值的参考依据。
1 模拟计算方法
使用Gaussian09 软件包,基于密度泛函理论(DFT)的B3LYP 方法,在6-31G(d,p)的理论水平上对反应物、过渡态、中间体和产物进行优化,并计算振动频率和零点能(ZPE)矫正,保证除过渡态外的其他物质频率均为正。对纤维二糖[16,17]、葡萄糖[17,18]、脂肪烃[19]及木质素二聚体模型化合物[20]的研究证明了B3LYP/6-31G(d,p)水平对有机物分解路径的适用性。其次,通过TS 方法寻找过渡态,振动频率分析计算确保过渡态有且只有一个虚频,检查虚频的振动方式以及运行IRC 内禀坐标法进行反应路径追踪,确保过渡态的准确性。在模拟计算过程中,主要应用C-C 键[21]、C-H 键断裂[19,22,23],H 迁移[16,24]以及异构化[25,26]等反应完成,以下是在计算过程中应用到的定义,其中,基态能量E是电子能量E0和零点能矫正EZPE之和,反应焓指产物和反应物的能量差,而活化能是指过渡态和反应物的能量差。


2 模拟计算
2.1 亮氨酸的初步分解路径
作为一种脂肪族氨基酸,亮氨酸没有芳香族氨基酸和杂环氨基酸复杂的环状结构;作为一元中性酸,亮氨酸只包含一个酸性羧基和一个碱性氨基。图1 为亮氨酸(LEU)在等离子体中的初步分解可能发生的路径,每条路径括号中的数值表示反应的焓值,括号外的数值表示活化能。亮氨酸的转化机理包括脱氨优先机理、脱羧优先机理和其他C-C 键断裂优先机理,共七条路径。在以上机理中,亮氨酸C-N、C-C 共价键的断裂伴随着氨基、羧基和甲基的直接脱离,这三条路径不需要跨越活性势垒。在脱NH3优先机理中,生成4-甲基-2-戊烯酸(C6H10O2)所需要的活性势垒相对较低,为273.2 kJ/mol,该过程中H5 有逐渐靠近N 的趋势,经IRC 计算显示,H5 连到氨基上形成氨气,最后生成C6H10O2和NH3,吸热20.5 kJ/mol,这符合Li 等[15]利用TG-FTIR 对亮氨酸热解检测到NH3的结果。有研究显示,羧基脱离后可生成CO2[27,28],在脱羧优先机理中,生成C5H13N 的过程即是上述反应,亮氨酸跨越293.8 kJ/mol 的能垒脱除CO2并伴随着羧基上H 的迁移。在其他C-C 键优先断裂的机理中,亮氨酸吸收44.1 或61.8 kJ/mol 的热量使得C1,2键或C2-4键断裂,生成C2H3NO2和C4H10或C3H7NO2和C3H6。
所有路径中生成C6H10O2和NH3的反应因低能垒最容易发生,因此,对该过程做更进一步的路径分析。由图2(a)可以看出,C(2)-H(5)和N(16)-H(5)在反应物LEU 方向开始是平稳增加和平稳减小的,然后分别显著增加和减小,在这个过程中C(1)-N(16)键长波动一直很小,这表明反应开始于C(2)-H(5)的延伸和N(16)-H(5)的收缩,并逐渐向过渡态TS 靠近。图(b)中N(16)-H(5)的变化已不明显,趋于稳定,而C(1)-N(16)和C(2)-H(5)的距离仍逐渐增大,这是形成的NH3逐渐远离主分子的趋势,最终生成C6H10O2和NH3。
考虑到等离子体本身的条件,自身会产生较高的热量,张晓星等[29]指出,在低温等离子体中,大部分电子的能量是414.9-646.5 kJ/mol,当反应的活化能小于电子能量范围的最大值时均有可能发生,因此,其余路径的可能性仍无法消除。
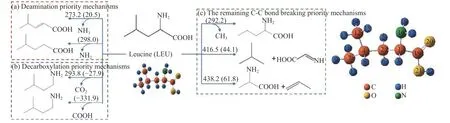
图1 亮氨酸的初步分解路径及其分子构型Figure 1 Leucine preliminary decomposition pathway and its molecular configuration
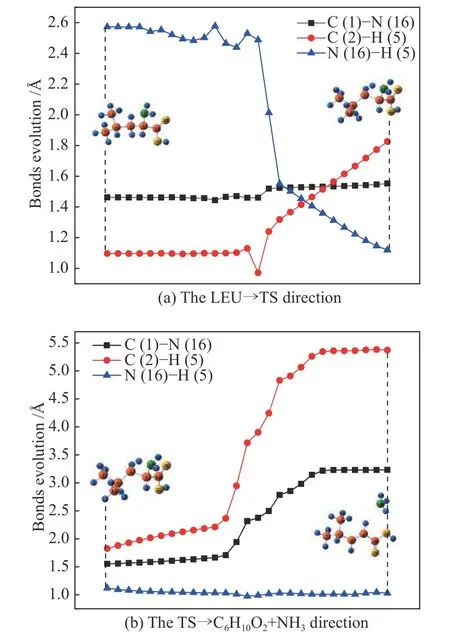
图2 反应过程中键的演化Figure 2 Evolution of the selected bonds in the reaction
2.2 脱氨优先机理
脱氨优先机理包括两条路径:脱NH2·优先和脱NH3优先,指的是氨基的直接脱除和NH2·接受转移的H 形成NH3脱除的过程。
2.2.1 脱NH3 优先机理
如图3 所示,亮氨酸脱除NH3生成4-甲基-2-戊烯酸(C6H10O2)后,羧基上的H 会发生夹角的变化,羧基的二面角由最初的0.00726°经过渡态的98.81370°转换到同分异构体的179.93731°。羧基上的H 完成二面角转换之后,逐渐向C1迁移,同时C1-19逐渐由同分异构体的0.147947 nm 经TS4的0.162267 nm 逐渐拉长至产物的0.175509 nm,羧基的C19、O20、O21原子逐渐远离主分子形成CO2分子,上述过程仅需吸热0.3 kJ/mol,脱去CO2分子后的链烃结构是3-甲基-1-丁烯(C5H10)。该路径符合Mudedla 等[27]及Huang 等[28]模拟计算煤中羧基的反应路径及木质素热解时CO2来源的过程。C6H10O2除了可以完成CO2的脱除外,也可以发生经历TS2 的反应过程,伴随着羟基的转移,C6H10O2跨越415.3 kJ/mol 的能量生成C4H9OH 和CO,并吸热35.6 kJ/mol,但是这个反应活化能较高,在动力学上不利,因此限制了CO 的产量,C6H10O2更容易向生成CO2的方向转化。
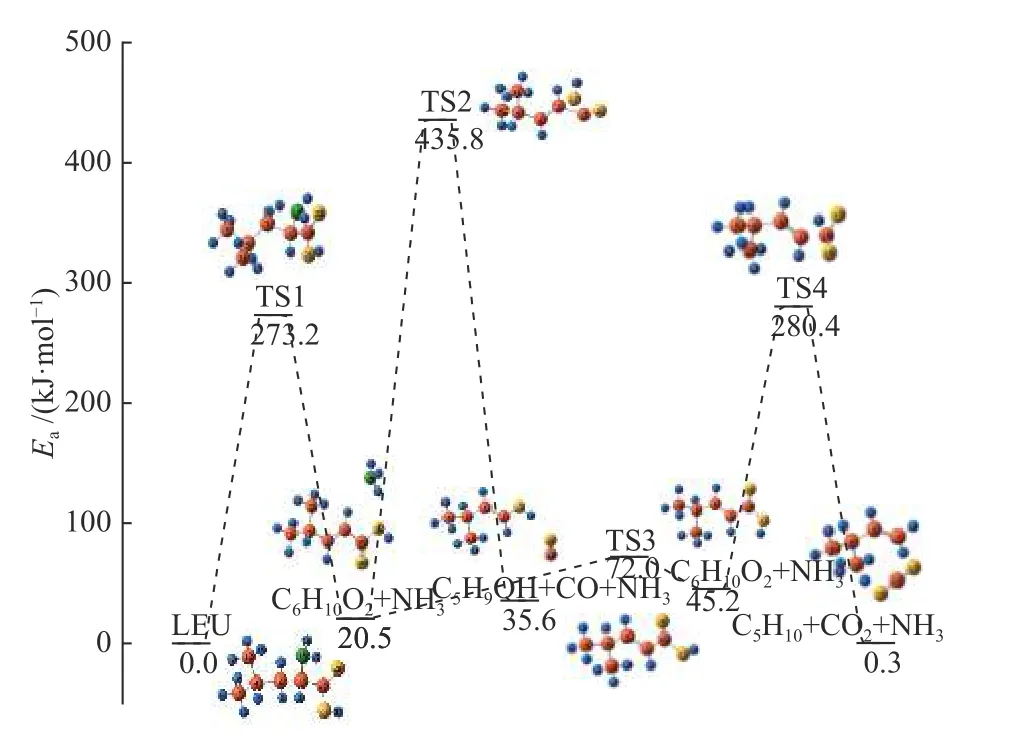
图3 脱NH3 优先机理反应路径Figure 3 Reaction pathway of NH3 removal priority mechanism
亮氨酸经过以上所述途径生成的C5H9OH 可继续吸收77.8 kJ/mol 热量生成丙烯和C2H3OH,如图4所示。C2H3OH 可经历过渡态TS7 或TS8、TS9、TS10,分解生成C2H2·、H2O 或CH4、CO。其中,C5H9OH生成CH4和CO 的反应跨越的最高能垒为346.1 kJ/mol,高于生成C2H2·和H2O 的反应(326.6 kJ/mol),因此,C5H9OH 更容易生成C2H2·和H2O。

图4 C5H9OH 反应路径Figure 4 Reaction pathway of C5H9OH
2.2.2 脱NH2·优先机理
图5 为亮氨酸脱除氨基NH2·生成C6H11O2·后的分解路径,首先经过TS11、TS12 生成C5H11·和CO2的路径依然是一个典型的脱羧反应,其中,涉及TS12 的反应是决速步骤。在另一条反应路径中,C6H11O2·经过一步H 转移生成它的同分异构体,该过程吸热27.7 kJ/mol 热量,随后通过两种反应途径分别生成C5H10和COOH、C5H11·和CO2,TS14的能垒要比TS15 高,但是TS14 的能垒却比TS16低,因此这两种路径存在一种竞争关系。以上提到的两种反应路径生成的C5H11·是同分异构体,都可以通过氢脱离生成C5H10。

图5 脱NH2·优先机理反应路径Figure 5 Reaction pathway of NH2·removal priority mechanism
对C6H11O2·第一步H 转移的两种路径作前线轨道分析,将经过45.3 和159.7 kJ/mol 能垒生成的同分异构体分别命名为1-C6H11O2·和2-C6H11O2·,结果如图6 所示。
3 Livin与STAT-5在鼻咽癌组织中表达呈正相关(χ2=41.302,r=0.552)。(见表 3)
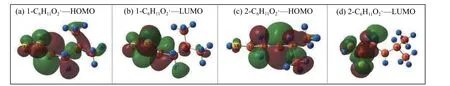
图6 1-C6H11O2·和2-C6H11O2·的前线轨道Figure 6 Front-line orbits of 1-C6H11O2·and 2-C6H11O2·
1-C6H11O2·和2-C6H11O2·都存在不饱和碳原子,由前线轨道结果图可以看出,1-C6H11O2·的不饱和碳原子对HOMO 轨道和LUMO 轨道有很大贡献,2-C6H11O2·的不饱和碳原子对HOMO 轨道有很大贡献。它们为后续的迁移、异构化反应提供了合适的化学环境,生成CO2和C5H10。通过计算两个分子的HOMO-LUMO 能隙,得出1-C6H11O2·的HOMO-LUMO 能隙为7.767 eV,大于2-C6H11O2·的HOMO-LUMO 能隙为 5.367 eV,该数值与两分子后续反应的能垒呈正相关,因此,1-C6H11O2·的化学稳定性更好,2-C6H11O2·更容易进行下一步反应,但反应的产物再次分解生成CO2的反应所需跨越的能垒大于1-C6H11O2·生成CO2所需的能垒,因此两条路径存在一定的竞争关系。
对比亮氨酸脱氨优先机理中的两条路径可以得出:(1)亮氨酸更容易优先脱除NH3,产物包括C5H10、CO2,这条路径中最高能垒为280.4 kJ/mol,且仅需吸热0.3 kJ/mol。(2)在脱NH3路径中生成CO 的反应因较高的活化能被限制,但是从其能垒来看,反应也能够在低温等离子体中进行,这也是CO 产量较少的原因。
2.3 脱羧优先机理
脱羧优先机理包括亮氨酸脱CO2优先和脱COOH·优先,这是羧基伴随着H 的转移以CO2的形式脱除和COOH·直接脱除的过程,反应路径如图7 和图8 所示。
亮氨酸脱除CO2后生成C5H13N,C5H13N 可以通过不需要跨越势垒的C-N 键的断裂以及跨越282.2 kJ/mol 能垒的反应生成C5H10,但是C-N 键的直接断裂明显不如伴随着H 迁移形成NH3的反应更容易发生,此时吸收热量12.0 kJ/mol 并生成C5H10,这和脱氨优先的路径计算出的中间体一致。如图8 所示,将亮氨酸脱除COOH·后生成C5H12N·,猜测TS20 为氨基上的一个H 向邻C 的迁移过程,并且IRC 计算证明了这一点。随后C2上的H 慢慢向N 迁移,导致NH2脱离主分子,同时C1和C2之间由单键形成双键,最终生成NH2·和C5H10,整个过程需要吸收热量436.8 kJ/mol。

图7 脱CO2 优先机理反应路径Figure 7 Pathway of CO2 removal priority mechanism
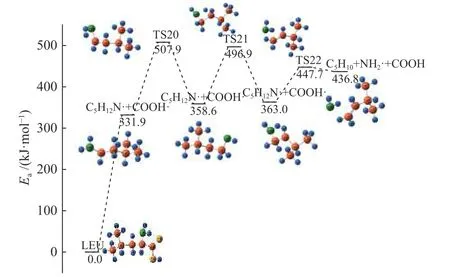
图8 脱COOH·优先机理反应路径Figure 8 Pathway of COOH·removal priority mechanism
对比上述脱羧优先机理的两条路径,亮氨酸直接脱除羧基的键能较高,因此,脱CO2的反应更容易发生。在脱CO2的路径中,C5H13N·分解为C5H11·和NH2·反应的决速步骤,整个反应共需吸热450.4 kJ/mol。脱羧优先机理中两条路径都会生成中间体C5H10,这在Simmonds 等[30]的研究中也被检测到。
如图9 所示,对中间体C5H10进行了C-C 键、C-H 键断裂的计算,C-C 键断裂是甲基脱除的过程,由于叔氢原子的反应活泼性较高,是伯氢原子的五倍,因此,C-H 键断裂是叔氢原子的脱除过程,生成C5H9·和H·自由基。TS23 和TS24 均是甲基受到H 原子影响生成CH4的过程,活化能分别是453.0 和466.7 kJ/mol。TS25 是C7上的H 向C=C双键转移,最终生成乙烯和丙烯的过程。三条需要跨越活性势垒的反应均是吸热过程,并且生成甲烷的途径所需的势垒明显较低,说明这个反应更容易发生。从图10 可以看出,C5H9·通过一步H 转移过程吸热214.9 kJ/mol 生成同分异构体,随着甲基的逐渐远离,最后生成1,3-丁二烯(C4H6),这个反应共需吸热157.2 kJ/mol。C4H6容易通过二面角的变化转化成更稳定的一种结构,这是C-C 键旋转的过程,生成的1,3-丁二烯是最简单的共轭二烯烃。C4H6可以通过C-C 键断裂生成两个C2H3·自由基,郑燕等[8]也对该过程进行了计算,其结果是需要464.4 kJ/mol 能量,与本模拟相近。C4H6还可以生成乙烯和乙炔,这是通过H 转移形成的,并且形成乙烯和C2H2·的反应势垒更小,为422.5 kJ/mol,这也是C4H6最可能发生的反应。
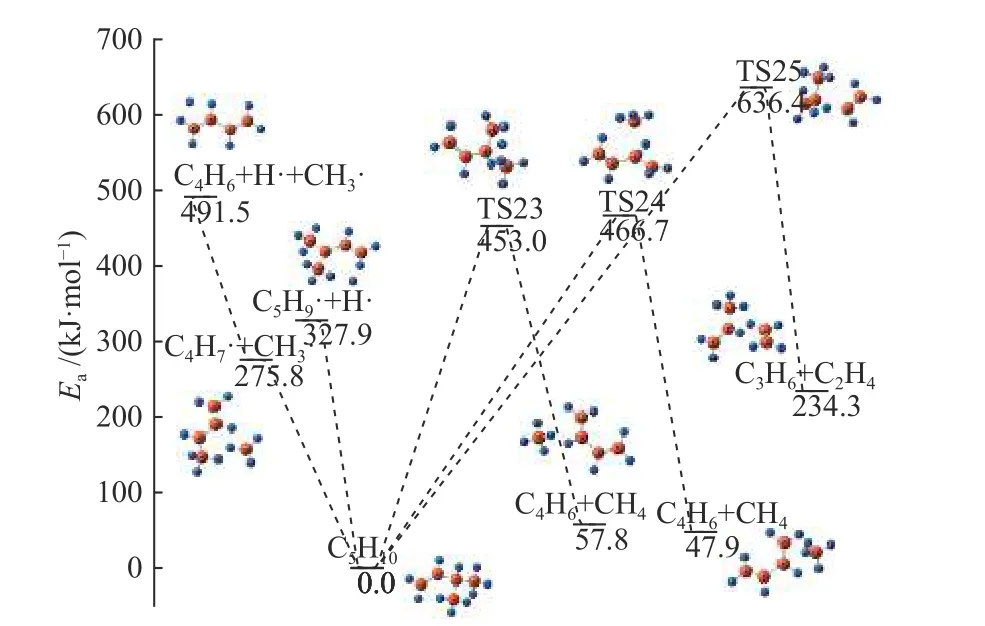
图9 C5H10 反应路径Figure 9 Reaction pathway of C5H9 decomposition
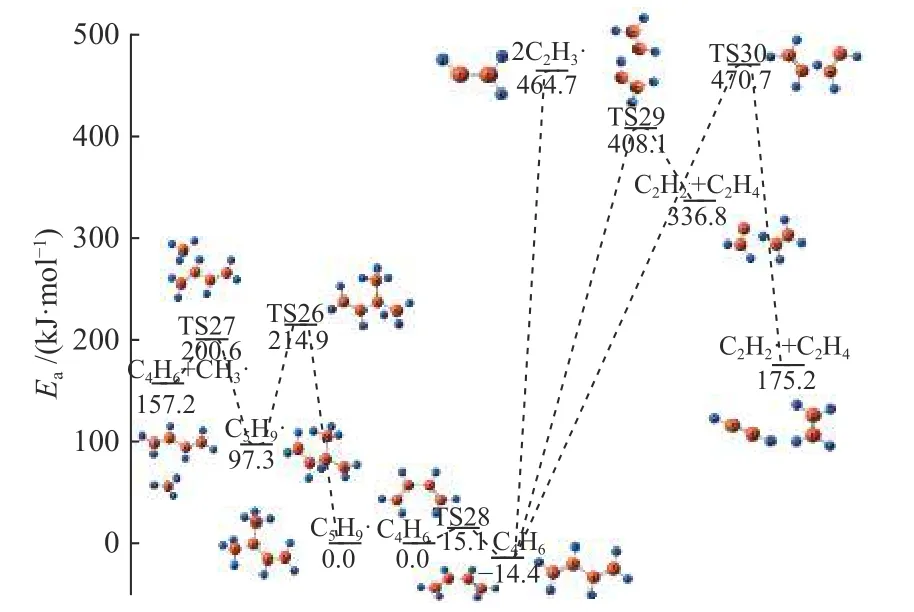
图10 C5H9·, C4H6·反应路径Figure 10 Reaction pathway of C5H9·, C4H6·
2.4 其他C-C 键优先断裂机理
2.4.1 脱甲基优先机理
图11 为亮氨酸脱除甲基后生成 C5H10NO2·的反应路径。首先发生的是 NH·自由基的脱除,这个过程伴随着 NH2·上 H 的迁移及 NH·的远离,生成 C4H8COOH·。C4H8COOH·可发生 COOH·、H·的 脱除,分别生成 C4H7COOH、C4H8,或者通过脱羧反应生成C4H9·和CO2。上述过程生成的C4H7COOH 也可以脱羧生成 CO2,此时还有C4H8 的生成。关于C4H8 的分解,分别计算了C-H 键的断裂以及C-C 键的断裂过程,C-C 键断裂生成 C2H5·和 C2H3·所需的能量相对较低,为397.6 kJ/mol。C4H8 也可以通过 H 转移生成乙烯,或者通过 H 的脱除生成 C4H6 和 H2,分别需要吸收 100.9l 和 106.4 kJ/mol 热量。
2.4.2 C1,2 键优先断裂机理
在亮氨酸的初始分解路径中已经提到,亮氨酸可以分解为C2H3NO2和C4H10,图12 展示了C2H3NO2的分解路径,它会跨越306.8 kJ/mol 的能量生成CO 和CH3NO,这是C2H3NO2的羟基逐渐向临C 靠近,形成C-O 键,同时脱除CO 的过程,整个过程吸热99.0 kJ/mol。图13 为CH3NO 的反应路径,在第一种路径中,CH3NO 可通过两步N 上的H 和O 上的H 的位置的转换(TS42、TS43)以及两个H 原子逐渐远离(TS44)的过程,生成CHNO 和H2。对于CH3NO 反应的第二条路径,CH3NO 上的一个H 首先通过迁移过程发生异构化反应生成一种同分异构体,下一步反应的产物和第一条路径的产物相同,均为CHNO 和H2。CHNO 又会通过吸收598.5 kJ/mol 的高热量生成CO 和NH·。
如图14 所示,C4H10的C-C 键和C-H 键的断裂分别发生在甲基和叔氢上,并且C-C 键断裂吸热较少。其次,也是因为叔氢的活泼性,它会转移到其中一个甲基上形成C3H6·自由基和甲烷,该过程的活化能为371.1 kJ/mol,需吸收热量341.0 kJ/mol。对 上 述 过 程 生 成 的C4H9·、C3H6·和i-C3H7·自 由 基进行了相应的模拟计算,计算结果显示C4H9·发生C-C 键 断 裂 会 生 成C3H6·和 甲 基,C3H6·和 上 一 步C4H10经过渡态生成的产物一样。随后C3H6·会因甲基上的一个H 向中间C 转移,生成丙烯。根据Huang 等[22]的计算结果,丙烯会发生C-C 键的断裂生成C2H3·自由基和甲基,并吸热404.2 kJ/mol,结果相差不大。

图12 C1,2 键优先断裂反应路径Figure 12 Reaction pathway of C1, 2 bond priority break

图13 CH3NO 的反应路径Figure 13 Reaction pathway of CH3NO decomposition
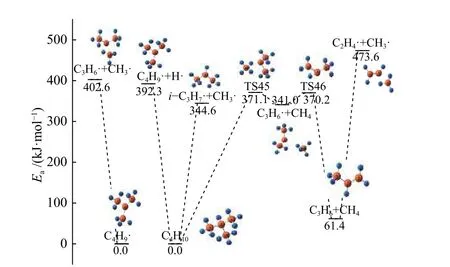
图14 C4H10 的反应路径Figure 14 Reaction pathway of C4H10
图15 是C4H10生成i-C3H7·后的分解路径,可以看出,i-C3H7·、C4H10、C5H10都是C-C 键断裂所需的能量小,这符合文献中提到的结论[19],即碳氢化合物的C-C 键断裂比C-H 键更容易断裂。其次,i-C3H7·会通过178.7 kJ/mol 的势垒转化成n-C3H7·,随后经过过渡态生成丙烯、H·或乙烯、甲基,其所需活化能分别是172.4、125.6 kJ/mol,与Huang 等[22]所计算的结果相差不大(152.7、142.3 kJ/mol)。
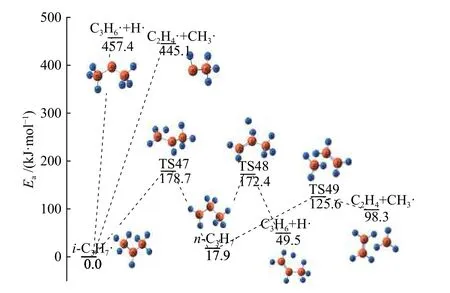
图15 i-C3H7 的反应路径Figure 15 Reaction pathway of i-C3H7
在i-C3H7·异构化的过程中,C(1)-H(9)键的形成和C(7)-H(9)键的延伸共存。在B3LYP/6-31G(d,p)的水平上进行势能面的柔性扫描,对每个点进行几何优化并得出C(1)-H(9)和C(1)-(9)的演化与所定位能量之间的关系。从i-C3H7·开始,变量C(1)-H(9)的键长从2.15309 Å减小到1.15309 Å,步长0.1 Å;变量C(7)-H(9)的键长从1.09836 Å增加到2.09836 Å,步长0.1 Å。扫描计算的结果如图16所示,可以看出i-C3H7·的能量最低,说明两个键的任何细微扰动都会导致吸热。此外可看出两个键长与能量之间的关系:(1)当C(7)-H(9)的键长小于2 Å时,所定位的能量随C(1)-H(9)键长的增加而增大。(2)当C(7)-H(9)的键长为1.7 Å时,尤其是在TS40 附近,观察到明显的能量扰动,过渡态结构的原因使得能量攀升。
2.4.3 C2-4 键优先断裂机理
图17 展示了亮氨酸C2-4键优先断裂机理的势能图,C2-4键伴随着C12上的H12向C2转移而断裂,生成丙烯C3H6和C3H7NO2,其中,关于C3H6的进一步转化路径已经在图14 中分析过。C3H7NO2会经过脱CO2、脱NH3的过程生成CO2、C2H4、和NH3,整个过程需吸收热量92.4 kJ/mol,第一步C2-4键的断裂是整个反应的决速步骤。
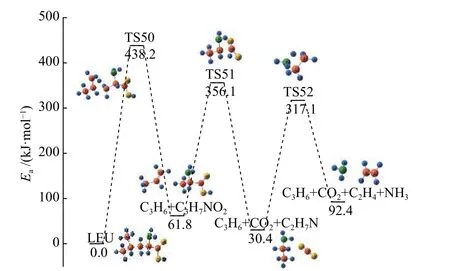
图17 C2-4 键断裂优先机理反应路径Figure 17 Reaction pathway of C2-4 bond break in priority
其他C-C 键优先断裂的机理中,优先脱甲基的反应中的决速步骤活化能最低,为377.4 kJ/mol,因此脱甲基的反应更容易进行,但是其他反应也可以在低温等离子体中进行。根据第二条路径,一旦形成了CH3NO,也会因为后续反应的低能垒而容易生成CHNO 和H2,但是CHNO 分解为CO 和NH·所需能量较高,因此,CO 的生成受到抑制,影响了CO 的产量。
2.5 小自由基间的相互结合
Azadi 等[10]指出,在等离子体中或者在C-H 键断裂的过程中,小基团可与本身或H.结合,形成相应的小分子烃,可能发生的反应如表1 所示。
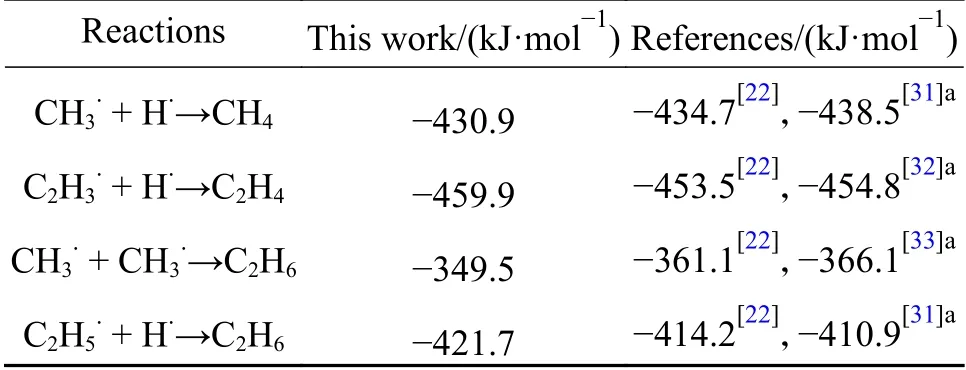
表1 生成小分子烃的反应焓Table 1 Reaction enthalpies of the formation of Small molecule hydrocarbon
2.6 亮氨酸的反应路径
对亮氨酸的所有路径进行总结,得到图18 所示的亮氨酸反应路径图。计算了亮氨酸分解的七种路径,初始分解路径分别是羧基、氨基、甲基的脱除以及其他C-C 键断裂的过程。羧基脱离后,容易吸收10 kJ/mol 的能量生成CO2和H 自由基;也会通过吸收133.2 kJ/mol 的能量生成CO 和OH·。所有路径中,生成NH3的路径所需跨越的能垒最低,为273.2 kJ/mol,在该反应过程中NH2·脱除伴随着H 的迁移,有研究表明[34],NH3可在高能电子的轰击下分解制氢。对亮氨酸的热解实验中[12,15,35],检测到CH4、CO、CO2、H2等小分子,模拟计算结果显示,CO2主要来自于羧基的脱除以及H 的转移过程,这与文献中的结果一致。CO 也会来自于羧基,此时是OH·的转移过程,除此之外,C2H3NO2、CHNO、C2H3OH 的分解也能生成CO,但直接生成CO 的反应所需跨越的势垒相对较高。C5H10中甲基的脱除可伴随着H 的转移产生CH4,同时,亮氨酸分解过程中产生的CH3也可以与H 自由基结合产生CH4。H2来自于H 自由基的结合、CH3NO 的分解以及C4H8生成1,3-丁二烯的过程。所有路径所需的能量均在低温等离子体高能电子的能量最大值范围内。

图18 亮氨酸的反应路径图Figure 18 Reaction pathway of leucine
3 结 论
脱氨优先机理中的脱NH3优先路径能垒最低,为273.2 kJ/mol,这是生成C5H10、CO2、NH3的过程。因此,亮氨酸会首先脱除氨基和羧基,生成的C5H10饱和烃会进一步分解成小分子烃类。
脱CO2优先机理中的第一步是脱羧并生成CO2的过程,这个过程和脱氨优先机理中第一步反应所需跨越的活性势垒相差不大,均在300 kJ /mol以内,因此,亮氨酸的第一步分解过程存在竞争关系,而脱CO2的反应是放热反应,在热力学上更有利,这也是亮氨酸在反应过程中生成CO2较多的原因。
亮氨酸在转化路径中生成的C5H10是一种重要的中间体,脱氨优先机理和脱羧优先机理共四条路径都会经历,这也在他人的亮氨酸热处理实验中被检测到。
羧基以及C2H3NO2、CHNO、C2H3OH 的分解可以生成CO,但生成CO 的反应所需跨越的能垒过高,这限制了CO 的生成,但是由于亮氨酸易脱羧形成CO2,CO2在等离子体中易被电离生成CO,并且生成CO 的路径较多,从而提高了CO 的产量,与实验结果一致。
对CH4、H2的生成路径进行模拟探究,发现C5H10中的甲基脱除可伴随着H 的转移产生CH4,亮氨酸分解过程中产生的CH3·也可以与H 自由基结合产生CH4,H2则来自于H 自由基的结合以及CH3NO、C4H8的分解过程。
