三阴性乳腺癌组织PD-1/PDL-1表达与肿瘤临床特征和T淋巴细胞免疫功能的相关性分析
2021-02-24王钢乐
王钢乐,董 懿,刘 恒
乳腺癌目前仍然是威胁全世界女性健康的主要恶性肿瘤,具有较高的发病率、复发率和病死率,并呈现年轻化趋势[1]。三阴性乳腺癌(triple negative breast cancer, TNBC)是指免疫组织化学染色显示雌激素受体、孕激素受体和原癌基因Her-2均为阴性的一种特殊类型乳腺癌,约占乳腺癌总体的10.0%~20.8%,具有特殊的生物学行为和临床病理特征,预后往往较差[2-3]。肿瘤的发生与恶性增殖、凋亡抑制、免疫逃逸、促血管新生、炎性反应等密切相关[4]。程序性死亡分子-1(PD-1)/程序性死亡配体-1(PDL-1)被证实参与多种肿瘤的发生和发展过程,钟亚春等[5]研究指出,PD-1/PDL-1在乳腺癌组织中高表达,抑制T淋巴细胞的杀伤作用,并且与肿瘤TNM分期和直径大小密切相关。吕淑贞等[6]则证实了乳腺癌组织PD-1/PDL-1高表达与肿瘤进展和不良预后密切相关。目前,关于TNBC和PD-1/PDL-1表达相关性方面的研究较少。因此,本研究主要探讨TNBC患者肿瘤组织PD-1/PDL-1表达与肿瘤临床特征和T淋巴细胞免疫功能的相关性,为明确TNBC的发生机制及临床干预提供依据。
1 对象与方法
1.1研究对象 选择2018年6月—2020年2月我院经病理确诊的TNBC患者76例作为TNBC组,纳入标准:①年龄18~75岁;②接受手术切除肿瘤组织,且病理确诊为TNBC;③自愿签署本研究知情同意书。排除标准:①复发性乳腺癌、转移性乳腺癌;②其他部位原发恶性肿瘤;③伴全身感染、自身免疫性疾病;④肿瘤标本不合格或被污染。另选取同时间段来我院就诊的非TNBC患者124例作为非TNBC组,乳腺良性肿瘤患者50例作为良性组。
TNBC组年龄45~69(53.4±6.9)岁;体质量指数(BMI)20.8~24.6(22.5±1.3)kg/m2;单侧肿瘤66例(左侧32例、右侧34例),双侧10例;肿瘤直径0.6~5.8(3.5±1.2)cm;导管癌32例,小叶癌44例;绝经45例,未绝经31例;肿瘤TNM分期:Ⅰ期15例,Ⅱ期30例,Ⅲ期22例,Ⅳ期9例;低分化30例,中分化21例,高分化25例;淋巴结转移24例。非TNBC组年龄43~72(54.5±7.2)岁;BMI 20.9~26.2(22.9±1.5)kg/m2;肿瘤直径0.5~5.6(3.6±1.3)cm;单侧90例(左侧43例、右侧47例),双侧34例;导管癌53例,小叶癌71例;绝经69例,未绝经55例;肿瘤TNM分期:Ⅰ期25例,Ⅱ期40例,Ⅲ期34例,Ⅳ期25例;低分化57例,中分化42例,高分化25例;淋巴结转移15例。良性组年龄42~74(54.1±7.0)岁;BMI 21.2~26.1(22.6±1.4)kg/m2;肿瘤直径0.7~5.9(3.4±1.1)cm;单侧42例(左侧20例、右侧22例),双侧8例;导管癌33例,小叶癌17例;绝经29例,未绝经21例;肿瘤TNM分期:Ⅰ期10例,Ⅱ期21例,Ⅲ期14例,Ⅳ期5例;低分化16例,中分化24例,高分化10例;淋巴结转移6例。3组年龄、BMI和肿瘤直径等比较差异无统计学意义(P>0.05),具有可比性。本研究经医院伦理委员会批准实施。
1.2研究方法 分别采用免疫组织化学染色法和Western blot法检测各组肿瘤组织中PD-1和PDL-1表达情况,采用流式细胞术检测各组肿瘤组织T淋巴细胞亚群CD4+、CD8+和调节性T细胞(Treg)百分比。采用Pearson相关分析探讨3组PD-1和PDL-1定量表达与CD4+、CD8+和Treg百分比的相关性。采用单因素分析探讨TNBC组PD-1和PDL-1表达与肿瘤临床特征的关系。
1.2.1免疫组织化学染色:将各组手术切除的新鲜肿瘤标本,制成厚度约4 μm的20~30个组织切片。根据免疫组织化学染色检测试剂盒和蛋白定量检测试剂盒(美国Sigma公司生产)操作步骤完成相应的检测过程。免疫组织化学染色过程中需要的兔抗人PD-1和PDL-1单克隆抗体一抗以及对应大鼠抗兔抗体二抗均购自美国R&D公司,以IgG抗体作为阴性对照。结果以200倍显微镜下计数视野中阳性细胞百分比,以黄染细胞为阳性细胞。每例随机挑选3个组织切片,取平均值为最终结果。
1.2.2Western blot:各组手术切除肿瘤组织剪碎匀浆,加入细胞裂解液提取总蛋白,测定浓度和纯度后应用内参β-actin抗体进行剂量标准化检测。吸取30 μg样本蛋白和等量内参蛋白,经冰浴变性、8%聚丙烯酰胺凝胶电泳分离,然后将分离区带电转移至聚偏二氟乙烯膜,先后滴加羊抗人PD-1、PDL-1和β-actin抗体一抗(稀释浓度为1︰2000,美国CA公司生产)静置过夜,磷酸缓冲盐溶液洗涤后滴加兔抗羊二抗(稀释浓度为1︰500,美国CA公司生产)室温孵育4 h,磷酸缓冲盐溶液洗涤,ECL显色。结果扫描保存,采用Lab Works4.5凝胶成像软件(美国Invitrogen 公司生产)行半定量分析,结果以样品蛋白与内参蛋白电泳条带的灰度值比值表示。
1.2.3流式细胞术:各组手术切除肿瘤组织剪碎匀浆,加入磷酸缓冲盐溶液调整浓度为2×106/ml,采用FACS Caliber型流式细胞仪进行检测,根据预设淋巴细胞亚群种类进行染色,保证预观察的淋巴细胞亚群损失降至最低,同时图像清晰度满意。

2 结果
2.1组间PD-1和PDL-1阳性表达情况比较 TNBC组PD-1和PDL-1阳性表达率明显高于非TNBC组和良性组,且非TNBC组亦明显高于良性组,差异有统计学意义(P<0.05)。见图1和表1。

图1 TNBC、非TNBC及乳腺良性肿瘤患者免疫组织化学染色(200×,DAB显色剂加苏木精复染) TNBC为三阴性乳腺癌,PD-1为程序性死亡分子-1,PDL-1为程序性死亡配体-1

表1 TNBC、非TNBC及乳腺良性肿瘤患者PD-1和PDL-1阳性表达比较[例(%)]
2.2组间PD-1和PDL-1定量表达比较 TNBC组PD-1和PDL-1定量表达水平明显高于非TNBC组和良性组,且非TNBC组亦明显高于良性组,差异有统计学意义(P<0.05)。见图2。
2.3组间T淋巴细胞亚群比较 TNBC组CD4+、CD8+和Treg百分比均明显低于非TNBC组和良性组,且非TNBC组亦明显低于良性组,差异有统计学意义(P<0.05)。见图3。
2.4相关性分析 Pearson相关分析发现,PD-1和PDL-1定量表达与CD4+、CD8+和Treg百分比呈负相关性(P<0.01)。见图4和表2。

图2 Western blot法检测TNBC、非TNBC及乳腺良性肿瘤患者PD-1和PDL-1定量表达 A:TNBC组,B:非TNBC组,C:乳腺良性肿瘤组;TNBC为三阴性乳腺癌,PD-1为程序性死亡分子-1,PDL-1为程序性死亡配体-1,β-actin为内参。与非TNBC组同指标比较,aP<0.05;与良性组同指标比较,cP<0.05

图3 流式细胞术检测TNBC、非TNBC及乳腺良性肿瘤患者T淋巴细胞亚群百分比 TNBC为三阴性乳腺癌,Treg为调节性T细胞;与非TNBC组同指标比较,aP<0.05;与良性组同指标比较,cP<0.05
2.5TNBC组PD-1和PDL-1表达与肿瘤临床特征的关系 单因素分析显示,TNBC组PD-1和PDL-1阳性表达率在患者年龄、BMI、肿瘤部位、肿瘤直径、病理类型、绝经状态方面无显著差异(P>0.05),但在肿瘤TNM分期、组织学分级和淋巴结转移方面有显著差异(P<0.05或P<0.01)。见表3。
3 讨论
肿瘤细胞凋亡或坏死不是杂乱无章的,而是众多基因间相互高度协调共同作用的结果[7]。PD-1/PDL-1是介导肿瘤细胞凋亡和免疫逃逸的最重要途径,PD-1属免疫球蛋白,由268个氨基酸残基组成;而PDL-1由CD274基因编码,主要参与调控T淋巴细胞对肿瘤的识别、呈递、细胞毒性和免疫杀伤作用[8-9]。
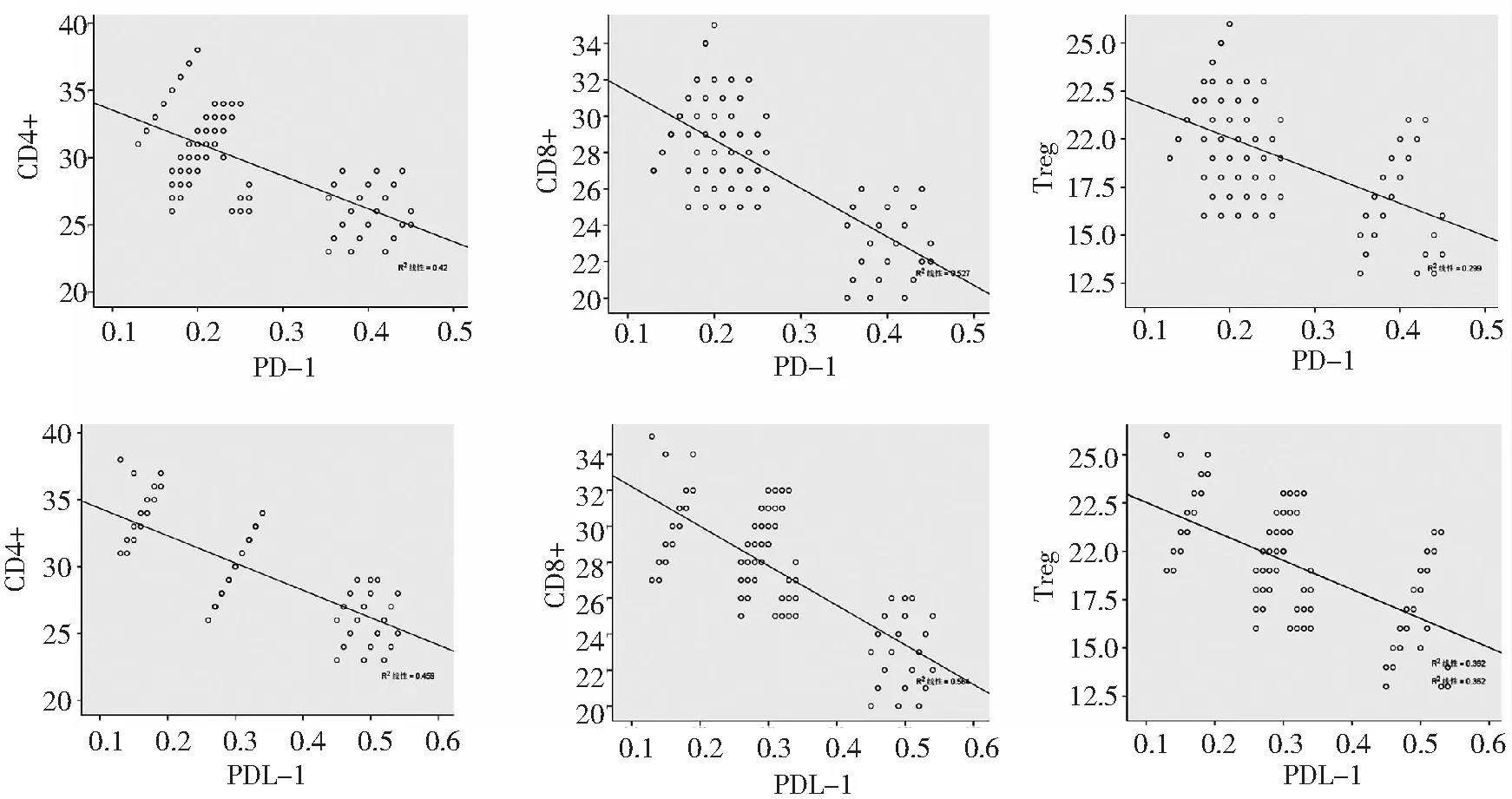
图4 Pearson相关分析TNBC、非TNBC及乳腺良性肿瘤患者PD-1和PDL-1定量表达水平与CD4+、CD8+和Treg百分比的相关性 TNBC为三阴性乳腺癌,PD-1为程序性死亡分子-1,PDL-1为程序性死亡配体-1,Treg为调节性T细胞
本研究发现,TNBC组PD-1和PDL-1阳性表达率和定量表达水平均明显高于非TNBC组及良性组,且非TNBC组亦明显高于良性组。提示PD-1和PDL-1高表达与TNBC的恶性程度有一定关系。PD-1通常被称为免疫调节的“检查点分子”,有助于维持自身的免疫耐受性[10]。PD-1在许多肿瘤浸润的CD8+ T细胞、CD4+T细胞、自然杀伤T细胞、B细胞、活化单核细胞和树突状细胞上表达[11]。PD-1参与T细胞的调节,通过与配体(PDL-1或程序性死亡配体-2)形成复合物,传递抑制信号,从而抑制肿瘤增殖,发挥免疫系统的负调节作用[12]。本研究还发现,TNBC组CD4+、CD8+和Treg百分比均明显低于非TNBC组和良性组,非TNBC组亦明显低于良性组。提示TNBC患者常伴随T淋巴细胞免疫功能的下降,该结果与免疫耐受和免疫逃逸的发生密切相关。PDL-1在造血细胞、内皮细胞、上皮细胞中大量表达,主要对炎症和肿瘤的发生起调节作用[13-14]。特别是,PDL-1在肿瘤细胞中的表达已被证明能抑制T淋巴细胞活化和诱导T淋巴细胞凋亡[15]。临床研究发现,抗PD-1单克隆抗体在大量预处理的TNBC队列中报告的总体反应率为18.5%[16]。

表2 TNBC、非TNBC及乳腺良性肿瘤患者PD-1和PDL-1定量表达与CD4+、CD8+和Treg百分比的相关性分析

表3 TNBC患者PD-1和PDL-1表达与肿瘤临床特征的关系(例)
本研究采用Pearson相关分析发现,PD-1和PDL-1定量表达水平与CD4+、CD8+和Treg百分比呈负相关性。提示乳腺癌患者PD-1和PDL-1表达常与T淋巴细胞亚群表达呈负相关性,也证实了PD-1和PDL-1与免疫抑制的重要联系。虽然PDL-1介导免疫逃避机制,并被认为与预后不良有关,但是肿瘤细胞表达PDL-1可能在抑制免疫反应方面无效,可能仅反映淋巴细胞浸润,在一些PDL-1高表达的恶性肿瘤中,这些肿瘤通常有良好的预后,包括乳腺癌[17-18]。其他研究也发现PDL-1并非总与预后不良相关,最近对非小细胞肺癌、黑色素瘤和结直肠癌的研究表明,PDL-1的表达与预后良好有关[19-20]。其中一项研究指出肿瘤浸润淋巴细胞(TIL)与98%的PDL-1阳性肿瘤相关,并且发现PDL-1与TIL显著相关,提示非小细胞肺癌PDL-1的表达可能反映了TIL介导的抗肿瘤炎性反应,而不是与肿瘤免疫逃逸有关[21]。
本研究单因素分析发现,TNBC组PD-1和PDL-1阳性表达率在肿瘤TNM分期、组织学分级和淋巴结转移方面有显著差异。但该发现与钟亚春等[5]结论不一致,他认为肿瘤直径>5 cm的乳腺癌组织中PD-1和PDL-1表达水平明显高于直径<5 cm的肿瘤组织。但总体来说,PD-1和PDL-1阳性表达与乳腺癌尤其是TNBC的恶性程度密切相关。
综上,TNBC患者肿瘤组织中PD-1/PDL-1异常高表达可能与T淋巴细胞免疫功能抑制和肿瘤恶性生物学行为有关。本研究创新点在于比较了不同类型肿瘤组织中PD-1/PDL-1及T淋巴细胞亚群的表达情况,能够直观反映肿瘤浸润的微环境变化,阐述PD-1/PDL-1表达与T淋巴细胞主导的免疫功能的相互作用机制。但本研究所采用样本来源为单中心,样本量有限,且未动态观察各指标变化情况,因此仍需后续研究加以证实本文结论。
