双核钌配合物与c-myc G-四链体DNA的键合性能
2021-02-24严双美米雅萱崔玥郑泽宝赵晓珑
严双美,米雅萱,崔玥,郑泽宝,赵晓珑
(1. 河北大学 化学与环境科学学院, 河北 保定 071002;2. 泰山学院 化学化工学院,山东 泰安 271021)
近年来,人们对能够识别G-四链体的新药物产生了浓厚的兴趣[1]. G-四链体是由富含鸟嘌呤(G碱基)的核酸序列形成的鸟嘌呤四分体组合构成[2-3]. 有证据表明,在人类的基因组[4]和mRNA[5]中都发现了G-四链体的存在,特别是在原癌基因启动子区域和端粒中. 原癌基因c-myc在高达80%的实体瘤中过表达,但在正常细胞中表达较低,并且与细胞增殖、凋亡密切相关[6].c-myc的过表达会引发一些癌症,如结肠癌、乳腺癌、宫颈癌和肺癌、骨肉瘤和白血病等[7-9]. 而c-myc中也含有富G序列,可以通过Hoogesten氢键形成G-四链体结构,进而来抑制c-myc的复制和翻译[10-11]. 因此,G-四链体已成为癌症研究中的生物学靶标,并且有可能成为基于DNA靶向治疗的新目标[1]. 同时,金属配合物与G-四链体的相互作用成为了新的研究方向,金属抗癌药物受到研究者们越来越多的关注[2-3].
顺铂是治疗癌症的金属药物之一[12],但因其有严重的副作用和耐药性,迫使人们去寻找能够替代的金属药物. 其中,钌配合物因具有较多优点而受到重视,如它对健康组织有较低的毒性,具有良好的光化学、光物理性能和丰富的光谱学性质等[3,13-17]. 据文献[18]报道,刘杰课题组发现配合物[Ru(phen)2(dhipH3)]2+对c-mycPu27 G-四链体有很强的结合力,而且可以通过诱导HeLa细胞产生活性氧,进而使线粒体膜电位去极化导致细胞凋亡. 在对钌配合物研究的过程中,人们发现一些双核或者多核配合物的中心金属能够提供更多的正电荷,它们与单核配合物相比,更具有优势[19]. 计亮年课题组[20]合成的双核钌配合物[(bpy)2Ru(ebipcH2)Ru(bpy)2]4+、[(bpy)2Ru(mbpibH2)Ru(bpy)2]4+和[(bpy)2Ru(hbpibH2)Ru(bpy)2]4+都能诱导端粒序列AG3(T2AG3)3形成G-四链体结构,并且对G-四链体有较强的稳定作用和较高的选择性,其中双核钌配合物[(bpy)2Ru(ebipcH2)Ru(bpy)2]4+能有效地抑制端粒酶活性以及HaLa细胞的增殖. Thomas课题组[21]合成了2个双核钌配合物[(phen)2Ru(tpphz)Ru(phen)2]4+和[(TAP)2Ru(tpphz)Ru(TAP)2]4+,它们对双链DNA和G-四链DNA都有很好的键合作用, 其中,配合物[(phen)2Ru(tpphz)Ru(phen)2]4+主要定位于人黑色素瘤细胞的线粒体中,而配合物[(TAP)2Ru(tpphz)Ru(TAP)2]4+主要定位于人黑色素瘤细胞的细胞核中,且[(TAP)2Ru(tpphz)Ru(TAP)2]4+在黑暗条件下没有毒性,一旦被光敏化,就会对人黑色素瘤细胞产生显著的毒性. 张丹课题组合[22]成了一个含有非环冠醚的双核钌配合物,其具有显著稳定G-四链体的能力,并且与G-四链体作用后的荧光强度增强约15倍,但与双链DNA结合后荧光强度不变,说明配合物能选择性结合G-四链体,可以作为G-四链体的荧光探针.
基于双核或多核钌配合物在与G-四链体作用中的优势,本文合成了一个含有苯酚基的双核钌配合物,并通过紫外可见吸收光谱和荧光光谱滴定、Job plot、圆二色光谱、PCR扩增反应、显色反应、FRET实验研究了其与c-mycG-四链体DNA (c-mycPu27和c-mycPu22)之间的相互作用.
1 实验部分
1.1 钌配合物的合成与表征
钌配合物参考文献[23]的方法合成,其表征结果与参考文献一致,该配合物结构如图1所示.

图1 钌配合物的结构Fig.1 Structure of ruthenium complex
1.2 主要原料与试剂
c-mycPu27 DNA (5′-TGGGGAGGGTGGGGAGGGTGGGGAAGG-3′), Pu27rev (5′-ATCGATCGCTTCTCGTCCTTCCCCA-3′),c-mycPu22 DNA (5′-GAGGGTGGGGAGGGTGGGGAAG-3′), Pu22rev (5′-ATCGCTTCTCGTCTTCCCCA-3′), F27T (5′-FAM-TGGGGAGGGTGGGGAGGGTGGGGAAGG-TAMRA-3′, FAM: carboxyfluorescein, TAMRA: 6-carboxytetramethylrhodamine) and F22T (5′-FAM-GAGGGTGGGGAGGGTGGGGAAG-TAMRA-3′)购自生工生物工程(上海)股份有限公司. 若无特殊说明,所有与c-mycDNA相关的实验均在Tris-KCl缓冲溶液 (10 mmol/L Tris, 100 mmol/L KCl, pH值为7.40±0.02)中进行. 实验中缓冲溶液采用超纯水配制. 其他试剂均为分析纯,没有进一步纯化处理.c-mycPu27 DNA和c-mycPu22 DNA固体样品通过高速离心机离心20 min后,加入定量缓冲液,充分振荡后,将样品稀释到一定浓度,90 ℃水浴5 min,冷却至室温,4 ℃过夜保存.
2 结果与讨论
2.1 紫外可见吸收光谱
紫外可见吸收光谱是一种用来研究配合物和DNA相互作用的普遍方法. 一般来说,配合物在紫外可见光谱中会表现出对一定波长光的吸收,但在DNA存在时,吸收峰会发生减色和红移现象,并且变化强度取决于配合物与DNA的结合力[24].c-mycDNA加入到钌配合物溶液时的紫外光谱变化,如图2所示. 从图2中可以看出,配合物在286、468 nm处有2个吸收峰,分别是由配体内的电荷转移(IL)和金属离子到配体的电荷跃迁(MLCT)引起. 当增加c-mycDNA浓度时,配合物的IL吸收谱带出现显著的减色和红移现象,但MLCT谱带变化不明显. 图2a所示为c-mycPu27和配合物作用后的紫外可见吸收光谱图,当键合作用达到平衡时,IL谱带的减色率为52.3%,红移了6 nm;图2b所示为c-mycPu22和配合物作用后的紫外可见吸收光谱图,当键合作用到达平衡后,IL谱带的减色率为58.6%,红移了4 nm,说明配合物和c-mycPu27、c-mycPu22之间有强烈的π-π*堆积作用. 配合物与c-mycDNA相互作用的减色率大于文献中报道的[Ru(bpy)2(p-tFMPIP)]2+(20.1%)[25]、[Ru(phen)2(p-tFMPIP)]2+(28.0%)[25]、[Ru(phen)2(TMSEPIP)]2+(42.3%)[17]、[Ru(phen)2(BEPIP)]2+(45.0%)[17]等,进一步表明配合物与c-mycDNA有较强的结合作用.
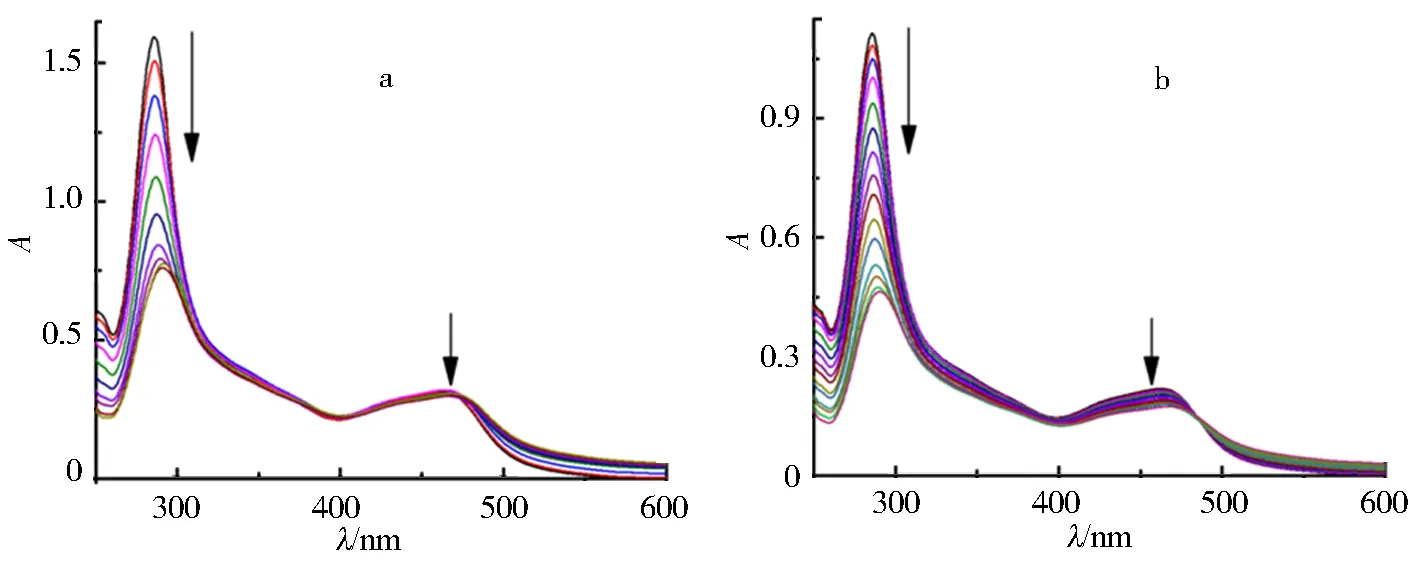
a.c-myc Pu27,c(Ru)=10 μmol/L;b.c-myc Pu22,c(Ru)=6.13 μmol/L.图2 随着c-myc DNA的增加,钌配合物紫外可见吸收光谱的变化Fig.2 UV-visible spectra changes of ruthenium complex with increasing c-myc DNA
2.2 荧光光谱
荧光光谱可以进一步阐明配合物与DNA之间的相互作用. 一般情况下,当配合物与DNA结合时,由于受到DNA碱基疏水环境的作用,使配合物的荧光不易被淬灭,从而产生荧光增强的现象. 图3为c-mycDNA与配合物作用后的荧光光谱图. 随着c-mycDNA浓度逐渐增加,钌配合物在550~600 nm 波长内的荧光显著增强,表明配合物与c-mycDNA作用后,受到DNA碱基疏水环境的保护,避免了配合物荧光的淬灭. 当配合物与c-mycPu27和c-mycPu22达到键合饱和时,荧光强度增大为原来的8.69倍和5.63倍,即I/I0分别为8.69和5.63,高于文献中报道的一些钌配合物,如配合物[Ru(phen)2(mitatp)]2+(I/I0= 2.4)[26]、[Ru(L1)(dppz)2](PF6)4(I/I0= 4.8) {L1= 5,5′-二(1-(三甲基氨基)甲基)-2,2′-联吡啶基阳离子}[27]、[Ru(bpy)2(mitatp)]2+(I/I0= 6.5)[26]、[Ru(L2)(dppz)2](PF6)4(I/I0= 7.6) {L2= 5,5′-二(1-(三乙基氨基)甲基)-2,2′-联吡啶基阳离子}[27]等,表明配合物有良好的“G-四链体DNA分子光开关”的性质.
通过曲线拟合得到配合物与c-mycG-四链体DNA的键合常数分别为Kb= 6.21×107L/mol (c-mycPu27),Kb= 2.33×106L/mol (c-mycPu22)[28],大于已经报道的[Ru(phen)2(tip)]2+(Kb= 1.43×106L/mol)[29]、[Ru(bpy)2(dhipH3)]2+(Kb= 2.45×106L/mol)[30]、[Ru(bpy)2(p-BEPIP)]2+(Kb= 1.09×107L/mol)[16],再一次表明配合物与c-mycDNA之间存在较强的键合作用.

a.c-myc Pu27,c(Ru)=3.43 μmol/L;b.c-myc Pu22,c(Ru)=2.45 μmol/L.图3 随着c-myc DNA的增加,钌配合物荧光光谱的变化(插图:曲线拟合法求键合常数)Fig.3 Emission spectra of ruthenium complex in the presence of increasing amounts of c-myc DNA, (the nonlinear fitting for calculation of binding constant)
2.3 Job plot
配合物与c-mycG-四链体DNA键合的物质的量比可以通过Job plot实验来确定. 通过荧光强度的变化ΔI对配合物的摩尔分数X作图,图4中所示拐点即为配合物与c-mycDNA的物质的量比. 如图4所示,当配合物的摩尔分数增大时,荧光强度变化呈先上升再下降的趋势,图4中的最高点分别为X=0.64 (c-mycPu27)和X=0.66 (c-mycPu22),表明配合物与c-mycPu27和c-mycPu22 G-四链体的键合物质的量比都为2∶1,即每一个c-mycG-四链体DNA分子可以结合2个配合物. 已报道的配合物也有相
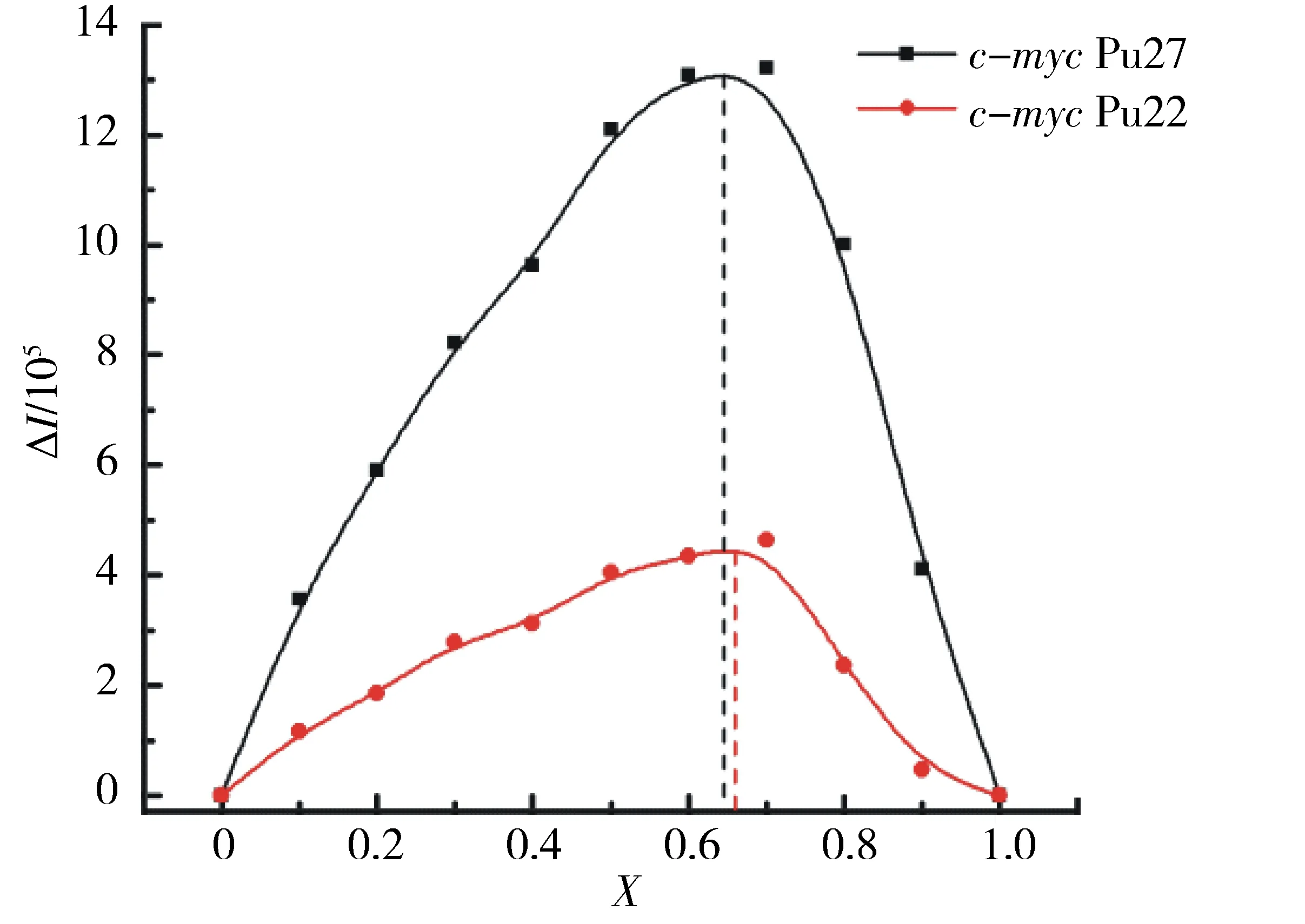
钌配合物与c-myc G-四链体DNA总浓度恒定(10 μmol/L).图4 随着钌配合物摩尔分数的增加,配合物荧光强度的变化曲线Fig.4 Job plot constructed from mixing the ruthenium complex and c-myc G-quadruplex DNA together in variable ratios
同的计量比,如[Ru(phen)2dpq-df]2+和[Ru(bpy)2dpq-df]2+[31]与22AG G-四链体的键合计量比也为2∶1. 而有些配合物的键合物质的量比则为1∶1,即1个配合物结合1个G-四链体DNA分子,如[Ru(bpy)2(dppz)]2+与22AG G-四链体[32]、[Ru(bpy)2(p-BEPIP)]2+和[Ru(bpy)2(p-TEPIP)]2+与c-mycPu22 G-四链体[16].
2.4 圆二色(CD)光谱
CD光谱是一种研究核酸构像的方法,可以为生物大分子与DNA的相互作用提供一些有用的信息. 当c-mycG-四链体DNA与钌配合物作用后,其CD光谱会发生变化. 图5为配合物与c-mycG-四链体DNA在Tris-KCl缓冲溶液中的CD光谱图. 图5a为c-mycPu27与配合物作用后的变化趋势,可以看出,c-mycPu27在241 nm处出现负峰,在264 nm处出现正峰,逐渐增加配合物的浓度,264 nm处的正峰强度(ICD)出现下降趋势,强度降低了70.2%,并在300 nm处诱导出新的负峰;图5b为c-mycPu22与配合物反应后的谱图,观察到c-mycPu22在264 nm处的峰强度随着配合物的增加而逐渐降低,强度降低了70.9%,在295 nm处诱导出现新的负峰. 这些现象与文献中报道的化合物[Ru(bpy)2(p-BEPIP)]2+和[Ru(bpy)2(p-TEPIP)]2+与c-mycPu22 G-四链体键合时的现象相同,表明配合物与c-mycPu27和c-mycPu22是沟槽结合[16].

a.c-myc Pu27,c(Ru)=70 μmol/L;b.c-myc Pu22,c(Ru)=60 μmol/L.图5 随着钌配合物的增加,c-myc DNA CD光谱的变化曲线 Fig.5 CD spectra changes of c-myc DNA in the presence of increasing amount of ruthenium complex
2.5 PCR (polymerase chain reaction)
通过聚合酶链式反应停止分析,可以检测钌配合物能否诱导DNA形成G-四链体结构. 该反应以Taq DNA聚合酶为催化剂,使DNA序列与其互补序列杂交,形成PCR产物. 如果钌配合物可以诱导c-mycDNA形成G-四链体结构,则杂交会阻断,PCR反应终止,且检测不到PCR产物[16]. 配合物与c-mycPu27和c-mycPu22 DNA反应的PCR结果如图6所示. 从图6可以看出,随着配合物的加入,杂交被抑制,并且配合物浓度越大时,检测到的PCR产物越少,出现条带变暗的现象. 当配合物浓度分别达到4 μmol/L G-四链(c-mycPu27)、6 μmol/L (c-mycPu22)时,几乎检测不到PCR产物,表明配合物可以诱导c-mycDNA形成G-四链体结构. 在报道的文献中,许多配合物完全抑制PCR扩增产物的浓度略大,如[(η6-HC6H5)Ru(m-MOPIP)Cl]+[33]、[(η6-CH3C6H5)Ru(m-MOPIP)Cl]+[33]、Λ-[Ru(bpy)2(H2iip)]2+[24]的抑制PCR扩增产物的浓度分别为12、9、8 μmol/L,进一步说明了配合物是有效的G-四链体诱导剂.
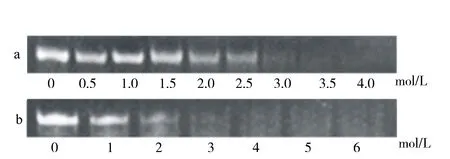
a.c-myc Pu27;b.c-myc Pu22.图6 钌配合物对c-myc DNA作用的PCR扩增Fig.6 Effect of ruthenium complex on the hybridization of c-myc Pu27 and c-myc Pu22 DNA in PCR-stop assay
2.6 显色反应
为了进一步证明配合物能否诱导c-mycDNA形成G-四链体结构,笔者采用了一种肉眼可见的视觉方法. 因为K+或者配合物可以促使G-四链体有效形成,并且G-四链体可与氯化血红素结合形成一种过氧化物脱氧核酶[11];在这种酶的存在下,过氧化氢介导的TMB (3,3′,5,5′-四甲基联苯胺)的氧化过程急剧加速,形成肉眼可见的蓝色,而且颜色变化非常敏感,易于鉴定,所以用这种视觉方法来鉴别G-四链体的形成. 图7是配合物的显色反应结果,从图7中可以看到,对照组和加入了ct-DNA的钌配合物溶液颜色没有变化,但加入K+和钌配合物的c-mycDNA溶液从无色变为蓝色. 此结果表明,配合物和K+都能诱导c-mycPu27和c-mycPu22形成G-四链体结构,而不能诱导双链DNA形成G-四链体结构.

a. c-myc Pu27;b.c-myc Pu22.c(K+)=500 nmol/L,c(Ru)=500 nmol/L.图7 在TMB-H2O2体系中,加入配合物或K+后c-myc DNA的酶功能表征Fig.7 Characterizations of the DNAzyme functions of c-myc DNA and ct-DNA in the presence of K+ and ruthenium complex in the TMB-H2O2 system.
2.7 FRET (Fluorescence resonance energy transfer)
通过荧光共振能量转移熔炼法可以测定配合物对c-mycG-四链体DNA的稳定作用. 图8为F27T和F22T的熔解曲线. 在Tris-KCl (10 mmol/L Tris, 60 mmol/L KCl, pH = 7.40 ± 0.02)溶液中,F27T的

图8 钌配合物与F27T(a)和F22T(b)作用的FRET熔解曲线Fig.8 Normalized FRET melting curves of F27T(a) and F22T(b) with increasing concentrations of ruthenium complex


图9 钌配合物对F27T(a)、F22T(b)的FRET竞争曲线Fig.9 Competition FRET melting curves of F27T(a) and F22T(b) with increasing concentrations of duplex ct-DNA
3 结论
本文合成并表征了一个含有苯酚基的双核钌配合物. 通过紫外可见吸收光谱、荧光光谱、Job plot和圆二色光谱研究表明,配合物与c-mycPu27和c-mycPu22 DNA均有较强的键合力,键合常数为6.21×107L/mol (c-mycPu27)和2.33×106L/mol (c-mycPu22),键和模式为沟槽结合,键合物质的量比也都为2∶1,并且配合物与c-mycPu27和c-mycPu22 DNA相互作用后,荧光强度增强为原来的8.69倍和5.63倍,表现出良好的“分子光开关”性质.PCR实验和显色反应表明,配合物可以将c-mycPu27和c-mycPu22诱导形成G-四链体结构. FRET及其竞争实验表明,配合物对c-mycPu27和c-mycPu22都有较强的稳定作用,并且在双链DNA存在条件下都能选择性结合c-mycPu27和c-mycPu22 G-四链体.
