3株氟咯草酮降解菌株的筛选及其生物降解效果研究
2021-02-23雷向荣
雷向荣,沈 硕,4,李 玮,3,5*
(1. 青海大学,西宁 810016;2. 青海省农林科学院,西宁 810016;3. 青海省农业有害生物综合治理重点实验室,西宁 810016;4. 青海省马铃薯育种重点实验室,西宁 810016;5. 农业农村部西宁作物有害生物科学观测实验站,西宁 810016)
随着农业的发展,农药被广泛用于获得更高的作物产量,由于残留水平高、利用率低,许多农药残留在土壤、水、作物和空气中,造成环境污染[1-3]。包括人类在内的非目标生物接触农药,会引发严重的不良影响[4,5];除草剂作为应用最广泛的农药,显著提高了农业生产力和作物产量[6],但大规模使用农药会对作物和环境造成间接的不利影响,除草剂可能会影响植物酶或中断生物系统,从而伤害或破坏正常的植物生长和发育,最终导致植物死亡[7-9];其不可避免地通过沥滤和地表径流进入地表水,这种除草剂会对水生生物和无脊椎动物以及土壤环境造成严重损害[10,11]。所以,大量的除草剂的土壤残余会对农业生态可续性发展造成极大阻碍[12]。氟咯草酮(flurochloridone,FLC)作为一种新型的吡咯酮类芽前施用的选择性除草剂,可有效防除冬小麦、棉花、向日葵、胡萝卜和土豆田的大部分阔叶杂草,近年来得到了广泛的推广,并于2014年被我国列为农药优势开发项目[13-16]。然而,氟咯草酮在农业生产中的普遍使用会在生态环境中留下大量的残余[6]。研究表明,在青海高原三个不同地区(海东、海西和海北)进行25%氟咯草酮乳油在马铃薯中的消解动态和残留分析,氟咯草酮在三个地区土壤中的半衰期分别为25.7、27.7和19.3 d,叶片中分别为8.1、10.2和7.0 d[17]。由此可见,氟咯草酮的半衰期较长且在自然条件下降解速率较为缓慢,如何对其进行快速而安全地降解是亟待解决的问题。
生物修复是一种利用活的绿色植物或微生物来去除土壤、地表水和地下水中的污染物的技术,而以微生物修复理论为基础的除草剂的残留降解技术是解决土壤修复问题的有效途径[18]。微生物修复法被广泛用于除草剂阿特拉津(Atrazine)在农业生产中残留的降解研究中,具有阿特拉津生物降解性的不同类型的微生物(细菌、真菌)已被大量识别、分离,并广泛应用于阿特拉津残余的去除。由铁氧化菌(iron-oxidizing bacteria)、采绒革盖菌Coriolus versicolor和白腐菌(white rot fungi)组成的混合微生物也可有效降解阿特拉津,降解率甚至可达到98%[19]。近年来,关于除草剂微生物降解的研究较多,其中磺酰脲类、氯乙酰胺类、咪唑啉酮类、三嗪类除草剂降解菌的研究取得了突破性的进展[20-35],然而对除草剂氟咯草酮降解菌株的相关研究和报道较少。本研究以应用青海马铃薯田间杂草防除的氟咯草酮为研究对象,在前期引进手性除草剂氟咯草酮并进行该药剂在高原马铃薯田的除草效果、安全性、使用方式、使用剂量、杀草谱等方面研究的工作基础上[36],筛选来源于青海本地生境的微生物降解菌株,初步探明氟咯草酮在高效降解菌作用下的降解效率以及降解菌株对后茬作物的安全性,以期为该药剂的推广应用提供科学依据,对保护三江源生态环境具有重要意义。
1 材料与方法
1.1 供试材料
1.1.1 土壤样品 土样来自青海省农林科学院植物保护研究所试验地施用氟咯草酮的马铃薯田,该试验地连续3年施用制剂量为1250.0 g a.i./hm2的25%氟咯草酮进行播后苗前封闭处理土壤。
1.1.2 试剂 氟咯草酮原药由上海泰禾集团有限公司提供。
1.1.3 培养基 LB液体培养基:肉提取物3 g,蛋白胨10 g,乳糖5 g,溴麝香草酚蓝0.024 g,pH 7.0,115 ℃灭菌30 min;固体培养基加入1.5%的琼脂。改良马丁培养基:酵母浸出粉2 g,葡萄糖20 g,蛋白胨5 g,磷酸氢二钾1 g,硫酸镁0.5 g,pH(6.4±0.2),121 ℃灭菌30 min;固体培养基加入1.5%的琼脂。高氏1号培养基:氯化钠0.5 g,可溶性淀粉20 g,硝酸钾1 g,磷酸氢二钾0.5 g,硫酸亚铁0.01 g,无水硫酸镁0.244 g,121 ℃灭菌30 min;固体培养基加入1.5%的琼脂。无机盐培养基:硫酸铵0.4 g,硝酸铵1.2 g,磷酸二氢钾0.5 g,磷酸氢二钾1.5 g,硫酸镁0.5 g,氯化钠0.5 g,酵母提取物0.05 g,pH 7.0,121 ℃灭菌30 min。固体培养基加入1.5%的琼脂。
1.1.4 仪器 液相三重四级杆液质联用仪(型号LCMS-8040,日本岛津公司)条件为雾化气流量3.0 L/min;DL管温度:250 ℃;加热块温度:450 ℃;干燥气流量:15 L/min;柱温箱:40 ℃;流速:0.25 mL/min;梯度洗脱:B泵浓度50%,2 min变为5%,5.01 min变为50%,8 min结束。多反应监测模式(Multiple Reaction Monitoring,MRM)来检测氟咯草酮,并且正电离和负电离模式均用于调整质谱(Mass Spectrometry,MS)参数。色谱条件:色谱柱,C18柱;柱温,40 ℃;流动相A为甲醇,流动相B为0.1%乙酸+5 mmol/L乙酸铵;流速,0.4 mL/min;进样体积,2.0 µL。质谱条件见表1。
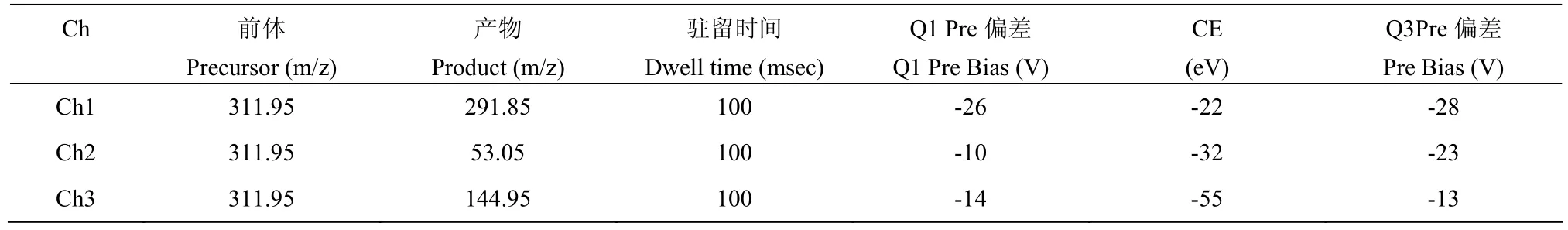
表1 质谱条件Table 1 Mass spectrometry conditions
1.2 试验方法
1.2.1 菌种的分离纯化 称取10 g土样加有90 mL无菌水的250 mL三角瓶中,28 ℃、180 r/min恒温振荡培养30 min获得稀释10倍的菌悬液,吸取1 mL菌悬液加到含9 mL无菌水的试管中,稀释成10-2,按此方法依次10倍系列稀释,分别吸取0.1 mL浓度在10-4、10-5和10-6的菌液,在提前准备好的高氏1号、改良马丁和LB固体培养基中用灭过菌的涂布棒进行涂布,每组3次重复;将涂布好的平板置于生化培养箱中培养,LB平板在37 ℃下培养1 d,改良马丁培养基28 ℃培养5~7 d;高氏1号培养基28 ℃培养4~14 d,在平板中挑取单菌落重复多次划线分离培养,直至分离出单菌落,将单菌落保存于相应的固体斜面培养基中。
1.2.2 微生物的驯化 配置500 mL无机盐固体培养基,高压灭菌,待温度冷却到40 ℃左右时吸取10 mg/L的氟咯草酮标准母液5 mL,制备成氟咯草酮浓度为0.1 mg/L的无机盐培养基,将分离纯化得到的菌株接种在此平板上28 ℃条件下培养2~3 d,将能够在0.1 mg/L的氟咯草酮无机盐培养基中生长的菌种转代接种于浓度为0.2 mg/L的无机盐固体培养基中,继续驯化转代培养,当氟咯草酮浓度增大到1 mg/L时若还能在平板上生长,即此菌株具有降解氟咯草酮的潜能,保存菌株研究其降解特性。
1.2.3 标准曲线的绘制 将氟咯草酮标准品配置成0.01、0.05、0.1、0.2、0.5和1 mg/L的标准溶液,根据氟咯草酮出峰的保留时间定性、峰面积定量,以氟咯草酮进样浓度和峰面积关系制作标准曲线。
1.2.4 菌株降解能力的测定 将驯化得到的具有降解氟咯草酮潜能的菌株分别接种至无机盐液体培养基中,28 ℃、180 r/min振荡培养72 h,作为种子液。将种子液以5%的接种量接到浓度为1 mg/L的氟咯草酮无机盐液体培养基中,28 ℃、180 r/min振荡培养,每隔1、3、5、7和14 d取样,以添加相同浓度氟咯草酮不接菌的各培养基为对照,高效液相色谱-串联质谱法检测分析各菌株对氟咯草酮的降解率。吸取10 mL培养液,置于50 mL具塞离心管中,加入10 mL乙腈溶液。涡旋振荡3 min至充分混匀。加入3 g NaCl,涡旋1 min,5000 r/min离心5 min,取上清液1.5 mL,加入50 mg PSA和100 mg无水硫酸镁,涡旋1 min,以12000 r/min离心2 min。取上层清液,经0.22 µm膜过滤后,供液相三重四级杆液质联用仪测定。降解率计算公式[37]:Q(%)=(C0-Ct)/C0×100,式中Q为氟咯草酮降解率(%),C0为氟咯草酮的初始浓度(mg/L);Ct为培养结束后培养基中残留的氟咯草酮含量(mg/L)。
1.2.5 降解菌株的形态学鉴定 菌株FL-G-2在高氏1号固体培养基上培养2 d,菌株FL-M-2、FL-M-3分别在改良马丁培养基上培养5 d,分别于载玻片上点无菌水1滴,用解剖针挑取少许孢子均匀分散涂抹于水中,于40×光学显微镜下观察其形态特征。
1.2.6 降解菌株的分子鉴定 使用Ezup柱式真菌基因组DNA抽提试剂盒,分别提取菌株FL-M-2、FL-M-3的基因组DNA[38],选择ITS基因进行PCR扩增;使用Ezup柱式细菌基因组DNA抽提试剂盒提取菌株FL-G-2的基因组DNA[39],选择16S rDNA基因进行PCR扩增(表2)。扩增产物由上海生工生物公司完成测序,获取序列后,登录NCBI网站选择Blast窗口,输入获得的基因序列进行同源性序列比对,用MEGA 6.0软件构建系统发育树。

表2 构建系统发育树引物信息Table 2 Primers of phylogenetic tree
1.2.7 降解菌株生长曲线测定 将筛选得到的3株降解菌分别在28 ℃、180 r/min振荡培养,每隔1 d取样,每次取样100 μL菌液,用酶标仪测定菌株FL-M-2和FL-M-3菌液在OD620下的吸光值,菌株FL-G-2菌液在OD600下的吸光值,分别作菌株生长曲线图。
1.2.8 降解菌株的安全性评价 采用种子萌发法[40]。在28 ℃、180 r/min的培养条件下,在平板上挑取菌株FL-G-2单菌落接种到高氏1号液体培养基中培养3 d,在平板上挑取菌株FL-M-2、FL-M-3单菌落分别接种到改良马丁液体培养基中培养3 d,分别制成种子液,再将各种子液以5%的接种量分别接入各液体培养基中培养5 d,将菌悬液浓度均调整为1×108cfu/mL;以小麦和油菜种子为受体,向每个培养皿中播入16粒种子,用移液管每皿添加5 mL菌悬液,共设置4个处理:(1)FL-M-2菌悬液(1×108cfu/mL);(2)FL-M-3菌悬液(1×108cfu/mL);(3)FL-G-2菌悬液(1×108cfu/mL);(4)清水对照。每个处理设置3次重复,在智能光照培养箱中25 ℃恒温保湿光照培养,光照12 h,黑暗12 h。种子在生测前进行灭菌消毒,之后分别加入蒸馏水催芽直至露白,7 d后计算各小麦和油菜种子萌发的根长、芽长、鲜重和干重。
1.3 数据统计与分析
采用Origin 2019软件和SPSS 25软件进行数据处理分析,LSD法进行差异显著性检验。
2 结果与分析
2.1 土壤中降解菌的分离与纯化
对经过富集与驯化的土样培养液混合菌群分别进行梯度稀释涂布平板,挑取菌落外观特征存在差异的菌株进行纯化,在氟咯草酮无机盐培养基中得到11株菌,供试菌株在28 ℃、pH 7.0的条件下均能够生长且长势良好。
2.2 标准曲线的绘制
使用氟咯草酮标准品建立标准曲线(图1),标准方程为y=185382+4.0253×106x(R2=0.9989),标准样品在浓度范围内峰面积呈良好的线性关系,表明该方法测定培养基中氟咯草酮的含量比较精确,并且操作简便、可靠,符合农药残留分析质量控制的技术要求。
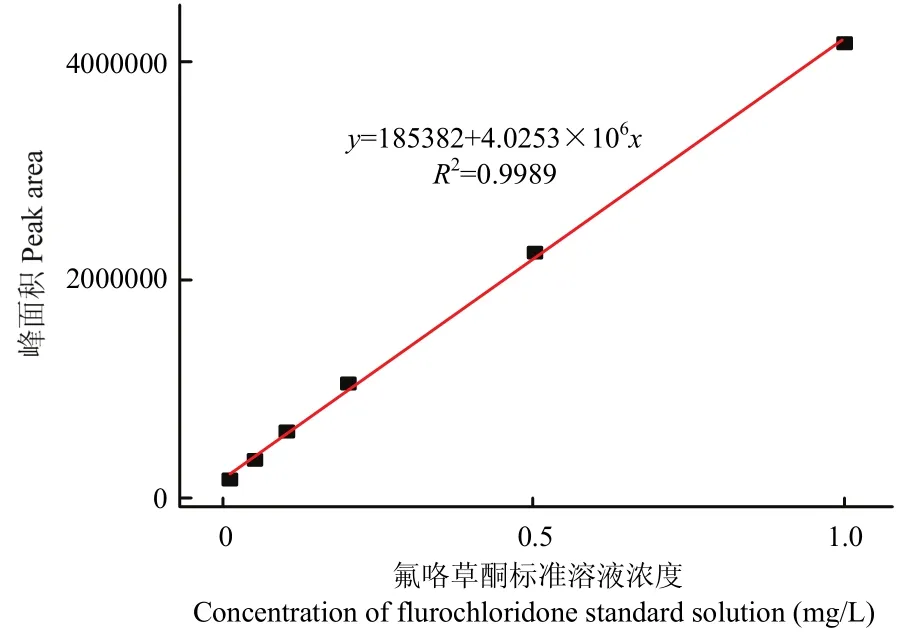
图1 氟咯草酮标准品的标准曲线Fig. 1 Standard curve of flurochloridone standard product
2.3 菌株降解能力的测定
降解能力的测定结果表明,菌株FL-M-2、FL-M-3和FL-G-2培养14 d 时,对氟咯草酮的降解率分别为50.82%、73.43%和84.37%,均显著高于其他菌株,各培养液中氟咯草酮浓度随着处理时间的延长均呈现逐渐降低趋势,其中菌株FL-M-2培养液中氟咯草酮浓度14 d内缓慢平稳降低,菌株FL-M-3培养液中氟咯草酮浓度7 d内降低较快,由初始浓度1 mg/L降低到0.28 mg/L,但随着处理时间延长至14 d,氟咯草酮浓度只下降了0.01 mg/L;菌株FL-G-2培养液中氟咯草酮浓度14 d内快速降低,并于14 d降低到0.16 mg/L;其余8株菌与其对应空白对照组相比,对氟咯草酮无明显的降解作用(表3)。
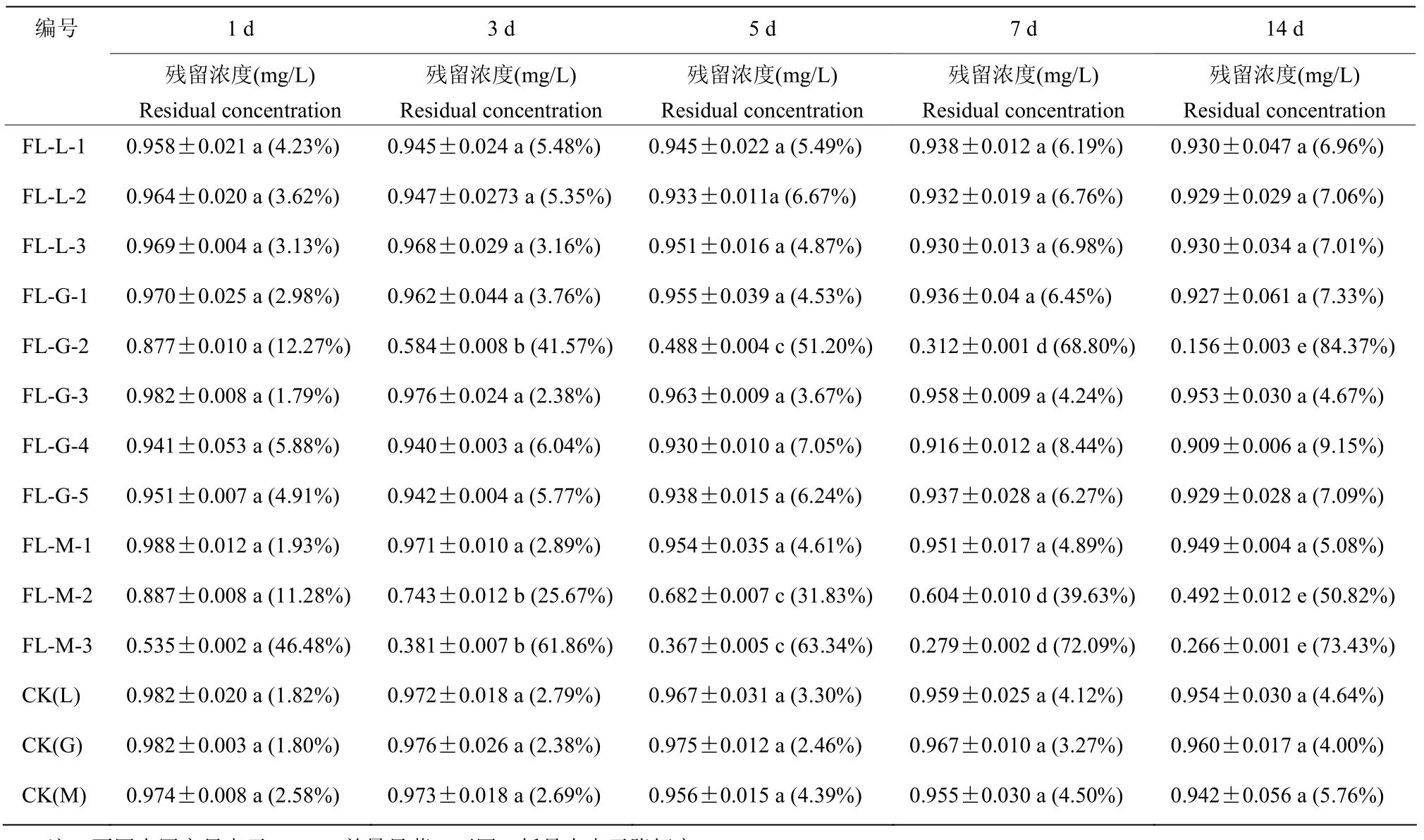
表3 不同时期各菌株培养液中氟咯草酮残留浓度Table 3 Residual concentration of flurochlorid in the culture broth of each strain at different periods
2.4 降解菌株的鉴定
2.4.1 降解菌株的形态观察 菌株FL-M-2在改良马丁培养基上,菌落近圆形,初期为白色,后为淡紫色,边缘呈绒毛状;分生孢子梗呈树状,各分支顶端含小梗(图2 a,d)。
菌株FL-M-3在改良马丁培养基上,菌落圆形,初期为白色,后为灰白色,边缘呈纤毛状;分生孢子梗有分支,壁光滑(图2 b,e)
菌株FL-G-2在高氏1号培养基上,菌落灰白色,干燥不透明,表面呈致密的丝绒状;孢子表面呈光滑状,孢子链呈直链状,孢子丝弯曲,无螺旋(图2 c,f)。
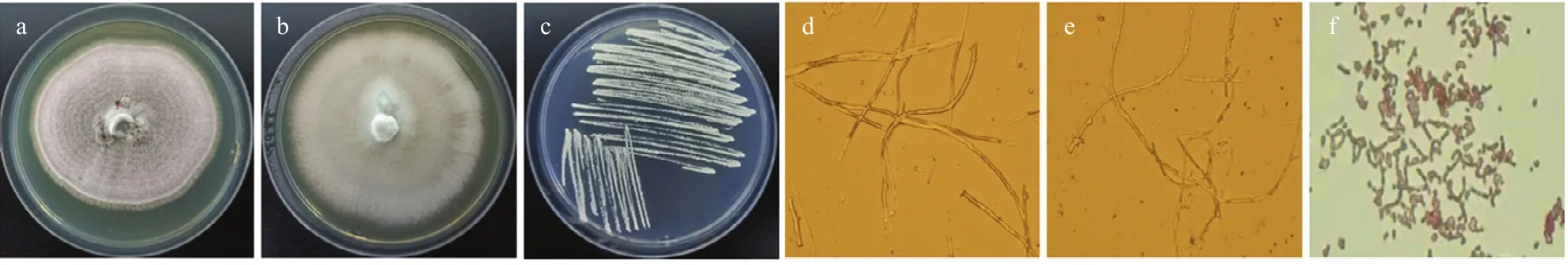
图2 菌株FL-M-2、FL-M-3、FL-G-2的形态结构Fig. 2 Morphology of strain FL-M-2, FL-M-3 and FL-G-2
2.4.2 降解菌株的分子鉴定 通过PCR扩增,分别从菌株 FL-M-2、FL-M-3 和 FL-G-2获得1294、1343和1459 bp基因片段;经过裁剪后,利用MEGA 6.0的邻近法构建系统发育树,菌株FL-M-2(登录号:MW686879)、FL-M-3(登录号:MW686880)和 FL-G-2(登录号:MW686908)分别与紫色紫孢菌(FR775516.1)、小双胞腔菌属(MT453292.1)和小链霉菌(MF359745.1)聚为同一分支(图3)。因此,结合形态学特征和分子鉴定结果,将3株菌分别鉴定为紫色紫孢菌Purpureocillium lavendulum、小双胞腔菌属Didymellaceaesp.和小链霉菌Streptomyces parvus。
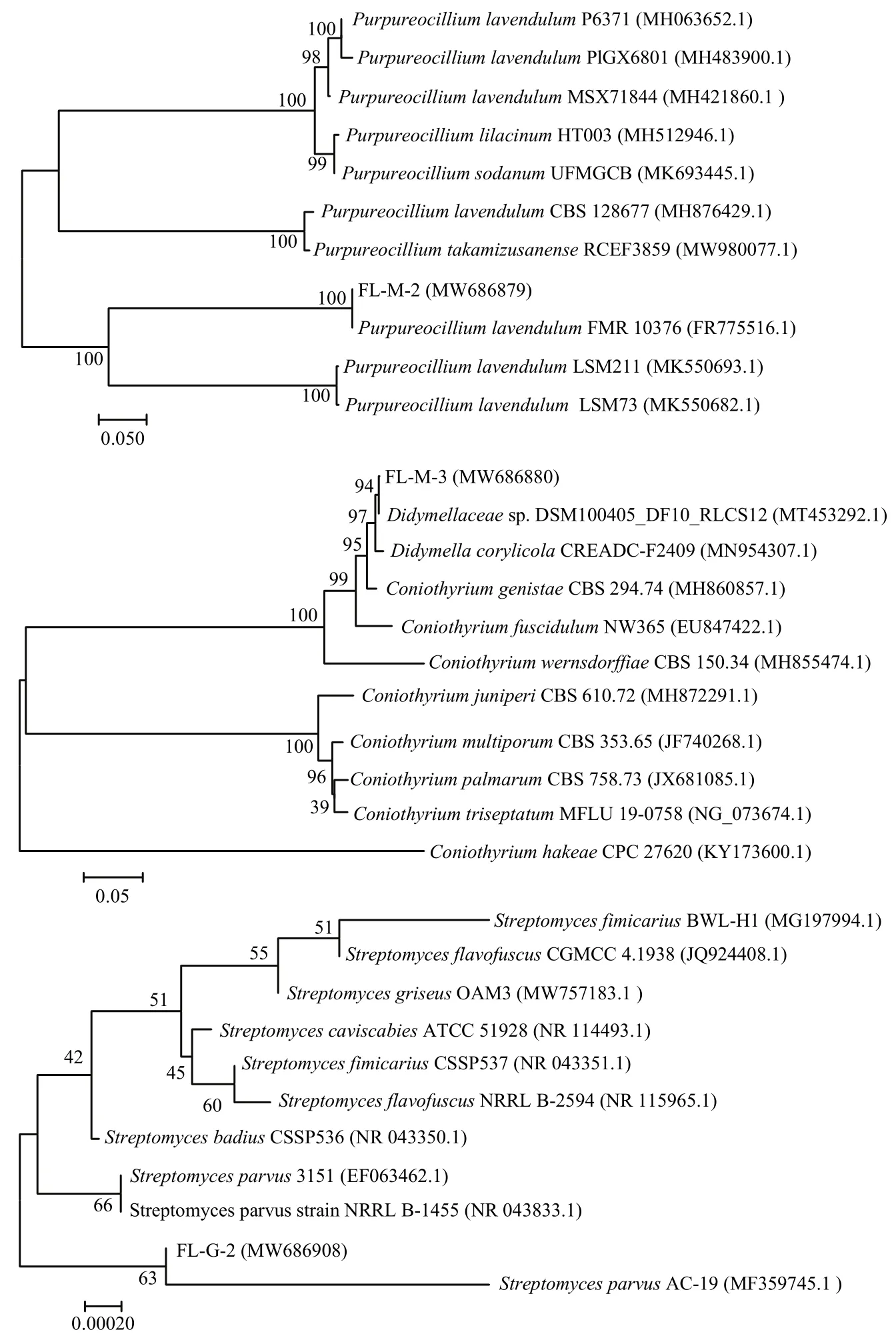
图3 降解菌株的系统发育树图Fig. 3 Phylogenetic tree diagram of degrading strains
2.5 降解菌株生长曲线测定
由图4可知,菌株FL-M-2和菌株FL-M-3在前3 d内均生长较快,培养的第3~6 d进入了生长稳定期;菌株FL-G-2前3 d生长较快,培养的第3~5 d进入了生长稳定期。
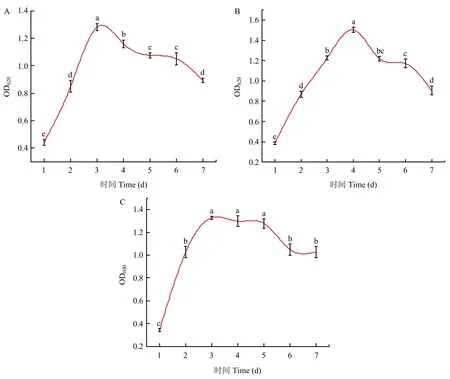
图4 降解菌株的生长曲线图Fig. 4 Growth curve of degrading strains
2.6 降解菌株的安全性评价
经恒温保湿光照培养7 d后,分别对菌株FL-M-2、FL-M-3和FL-G-2处理的油菜和小麦幼苗生长进行调查结果显示,菌液浓度为1×108cfu/mL时,3株降解菌处理的油菜的根长和干重与对照相比无明显差异,其中菌株FL-M-2菌液处理的油菜芽长为4.86 cm,较对照增加了1.3 cm,菌株FL-M-2菌液处理的油菜的鲜重为0.93 g,较对照组增加了0.4 g;3株降解菌处理的小麦的根长、芽长和干重与对照组相比无明显差异,菌株FL-M-3菌液处理的鲜重显著高于其他菌株,比对照处理小麦的鲜重增加了1.53 g(表4)。结果表明,3株降解菌对油菜和小麦生长均无明显的抑制作用。
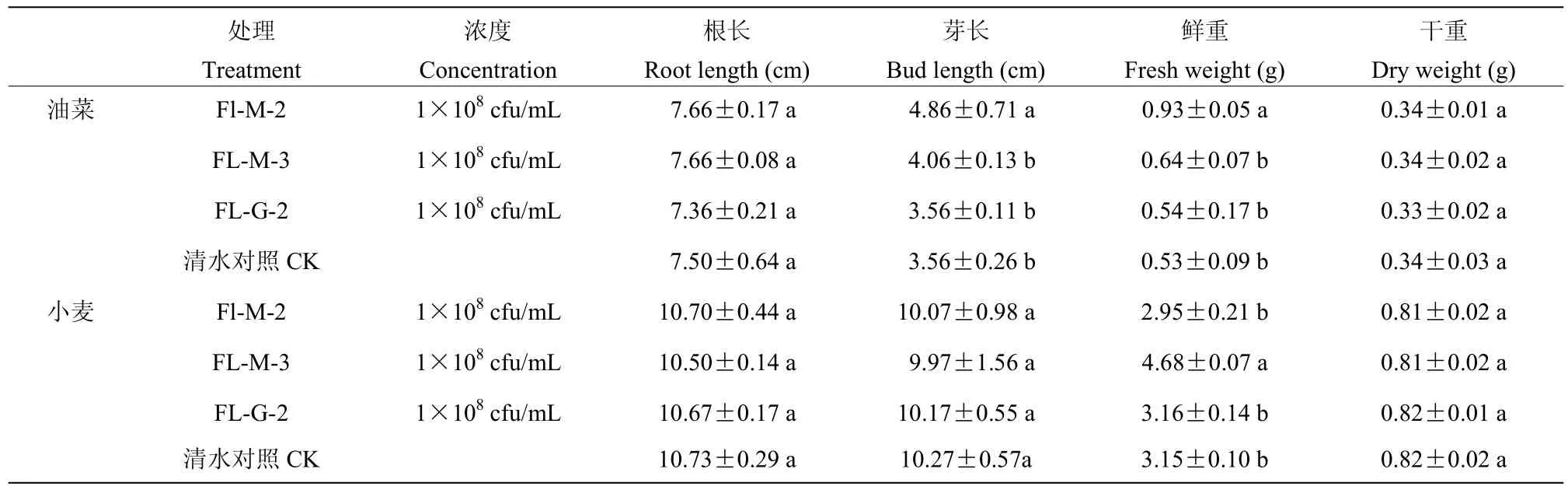
表4 降解菌株对油菜和小麦幼苗生长的影响Table 4 Effects of strains with degrading ability on the growth of rape and wheat seedlings
3 讨论
氟咯草酮对马铃薯田杂草具有较好的防除效果,后期具有一定的推广应用价值[36]。然而,由于其残效期长、在自然条件下难降解、易对后茬作物产生药害等限制性因素制约了该药剂的大面积推广应用,因此筛选安全高效的降解菌株,开发微生物降解产品,可为该药剂后期的大面积安全应用提供配套保障。目前,国内外学者报道了多种具有降解除草剂的微生物菌株,但关于吡咯烷酮类除草剂氟咯草酮的降解微生物研究较少,本研究从青海高原土壤中分离到 3株优势降解菌紫色紫孢菌、小链霉菌和小双胞腔菌属,3株菌能够高效地降解氟咯草酮,尤其是小链霉菌的降解效果最好,发酵培养14 d对1mg/L氟咯草酮降解率达到84.37%,研究结果可为后续研究氟咯草酮及吡咯烷酮类除草剂的生物降解提供基础,揭示吡咯烷酮类除草剂的生物降解途径、降解代谢产物和生物降解机制方面是后续研究的重点。
研究表明,紫色紫孢菌在防治植物病原线虫中有突破性进展,该菌已成为商品化应用最广泛的食线虫真菌之一[41];此外该菌对植物的生长呈现“低促高抑”的浓度效应[42]。在本试验中,当FL-M-2菌液浓度为1×108cfu/mL时,菌液处理的油菜芽长和鲜重显著高于清水对照组,可能的原因是该浓度的FL-M-2菌液可以促进油菜的生长,根据此特性可开发天然抑草剂和催芽剂。作为苦马豆、藏沙蒿、披针叶黄华等多种药用植物的内生真菌[43-45],小双胞腔菌属可有效促进药用植物生长发育,提高植物的抗逆性,本试验初步探究了该菌株在微生物降解方面的功能,构建多功能的小双胞腔菌属。小链霉菌可有效地防治黄瓜枯萎病并提高小麦的耐干旱能力[46],同时小链霉菌还是一类重要的防治番茄溃疡病的生防菌株[47],此外小链霉菌分离可获得较高抗性的抗病毒蛋白,可有效防治烟草花叶病毒及黄瓜花叶病毒[48]。而关于这3株菌在微生物降解方面的研究均尚未见报道,本试验探究了菌株对目标除草剂的降解作用,不断提高3株菌株的功能性,使其具有兼顾防治农业病害,降低土壤农药残留等优点,期望实现农药高效减量的同时并改善微生物环境,从而探索出一种经济高效的微生物降解途径。
温湿度、酸碱度、碳氮含量、粘度、盐度、通气情况和基质吸附作用等都会影响微生物降解农药残留的速率,微生物的适应性、代谢活性以及种类等因素也可以直接影响微生物对农药降解和转化过程[49]。本研究在pH为7.0,温度为28 ℃,接种量为5%的条件下,菌株FL-G-2和菌株FL-M-2在14 d内呈现平稳降解趋势,而菌株FL-M-3起始降解速率较其他两株高效降解菌降解速率较快,而后其降解速率逐渐平缓,后续将对其降解速率变化的原因以及降解菌株最优发酵条件下的最佳降解速率进一步深入探究,以期得到优势降解菌株对氟咯草酮的最优降解效果。从本地生境中筛选到的微生物降解菌株,较为容易适应田间生态环境,经田间驯化,将形成的生物产品以生物激励和生物强化的方式应用于田间生产,具有较好的应用价值。
微生物修复处理方法必须监测和评估生物修复过程[50],以最大程度地避免新的环境污染问题的产生,本试验在筛选出具有降解氟咯草酮能力的菌株的基础上,通过研究降解菌株对青海马铃薯田常见后茬作物(小麦和油菜)幼苗的生长的影响对其进行安全性评价,结果表明3株菌的发酵液对小麦和油菜幼苗的生长均无明显的抑制作用。这一结论为降解菌株的安全应用提供了理论基础。由此可见,作为降解吡咯烷酮类除草剂的新型菌种资源,FL-M-2、FL-G-2和FL-M-3具有良好的研发和应用潜力,其菌株及其发酵代谢产物对多种作物的生长安全。
