基于生物信息学整合分析醒脾舒肝汤调节自噬治疗中医郁病的分子机制*
2021-02-23杨仁义龚翠兰车雄宇颜思阳周德生傅馨莹陆展辉
杨仁义,龚翠兰,车雄宇,颜思阳,周德生,傅馨莹,陆展辉
1.湖南中医药大学,湖南长沙410208;2.湖南中医药大学附属常德医院,湖南常德415000;3.湖南中医药大学第一附属医院,湖南长沙410007
中医郁病主要以心情抑郁、烦躁易怒、精神恍惚、悲伤欲哭、胁肋胀痛、全身不适等为主要症状[1],西医属于“焦虑症”“抑郁症”“躯体形式障碍”等范畴。世界卫生组织预测2020年后抑郁症可能成为人类健康问题的第二大因素[2]。西医一般予以阿米替林、氟西汀等药物治疗,其作用机制主要与神经鞘磷脂在溶酶体和高尔基膜中的缓慢蓄积,及神经酰胺在内质网中的缓慢蓄积,诱导海马神经细胞的自噬有关[3-4]。自噬是一种溶酶体依赖性降解、回收、利用机体内大分子和细胞器的程序性死亡方式,受LC3-II、Beclin、p62、Vps等多种分子及信号通路调控,参与机体复杂生理病理过程,是当前研究的热点问题。中医从整体观念、辨证论治的角度出发,在郁病的依从性、接受度、症状改善及疗效等方面具有一定的优势[5]。研究发现,加味逍遥散能刺激自噬小体的形成,并激活ATG5及LC3-II的表达,减轻神经细胞凋亡,从而改善抑郁症状,所以,中医药可能通过激活自噬机制发挥抗抑郁作用[6]。本研究根据郁病病因病机,结合多年临床经验认为,郁病病机属脾虚湿盛,肝郁气滞的范畴,治法当以醒脾疏肝为主,基于此理论立方的醒脾舒肝汤,由麻黄、红花、川芎、细辛、艾叶、柴胡、吴茱萸、白术、白芍、香附组成。该药在长期临床应用中取得了较好的疗效,但是其分子机制尚不明确。本研究从神经细胞自噬机制出发,整合中药及疾病靶点大数据,采用计算机技术多学科交叉分析方法,揭示醒脾舒肝汤调控自噬通路治疗郁病的分子机制,为后续机制验证及进一步开发醒脾舒肝汤提供理论依据。
1 资料与方法
1.1 醒脾舒肝汤活性化合物收集及筛选利用TCMSP[7](http://tcmspw.com/tcmsp.php)数据库,收集醒脾舒肝汤中麻黄、红花、川芎、细辛、艾叶、柴胡、吴茱萸、白术、白芍、香附10味中药的主要化学成分。根据人体对药物吸收、分布、代谢及毒性的药代动力学ADMT参数[8],以口服生物利用度[9](oral bioavailability,OB)≥30%,化合物类药性[10](drug likeness,DL)≥0.18,血脑屏障(blood brain barrier,BBB)≥-0.3为筛选条件[11],初步筛选出醒脾舒肝汤有效高活性化合物。
1.2 活性化合物作用靶点预测与“中药—疾病—表型”共同靶点筛选通过PubChem[12](https://pubchem.ncbi.nlm.nih.gov/)数据库收集各活性化合物成分信息,以2D、3D结构保存为SDF格式。将活性化合物导入Swiss Target Prediction[13](http://www.swisstargetprediction.ch/)数据库预测活性化合物相关靶点,剔除无化学结构、无靶点的化合物。
通过Pubmed中“MeSH”检索功能检索“anxiety neurosis(MeSH)”“depressive disorder(MeSH)”“somatoform disorder(MeSH)”及“autophagy(MeSH)”,收集所有检索词。将“焦虑症”“抑郁症”“躯体形式障碍”及“自噬”的所有检索词纳入GeneCards(https://www.genecards.org/)数据库中检索,收集“焦虑症”“抑郁症”“躯体形式障碍”和“自噬”的作用靶点。
通过Bioinformatics Gent(http://bioinformatics.psb.ugent.be/webtools/Venn/)中Van de Peer Lab在线工具取交集获得“醒脾舒肝汤”“郁病”“自噬”的“中药—疾病—表型”共同靶点,并绘制韦恩图。
1.3 共同靶点关键基因筛选及蛋白PPI网络构建
通过String[14](https://string-db.org/)数据库,将所得到的共同靶点导入,选择Multiple Protenin,限定物种为Homo sapiens,设定最低要求互动分数为最高可信度0.900[15],得到PPI相关信息。
将导出的PPI相关信息中Node1、Node2、Combined score值导入Cytoscape软件,使PPI相关信息网络图可视化,并利用Network analyzer计算Degree值,进行可视化。同时采用Cytoscape软件中Cyto-Hubba、MCODE功能中MCC算法、MCODE算法分别对PPI网络图进行亚网络拓扑分析,筛选出关键基因,将3种算法筛选出的基因取并集,整合出共同靶点关键基因。
1.4 共同靶点GO 和KEGG 富集分析
利用WebGestalt[16](http://www.webgestalt.org/#)数据库,将共同靶点进行GO与KEGG通路富集分析。初步设定基本参数,物种为“Homo sapiens”,采用“ORA”(Over-Representation Analysis,ORA)算法分析,选用“Funtional Database”子数据库,进行GO和KEGG富集分析。进阶参数设定中,设定“Significance Level”P<0.05,余为默认设置。收集BP、CC、MF、KEGG富集分析数据,进行“加权集合覆盖”分析,并绘制火山图。
同时利用Metascape[17](http://metascape.org/gp/index.html#/main/step1)数据库,导入共同靶点,基于MCODE算法对KEGG富集分析进行聚类亚网络分析,并进行可视化。
1.5 关键基因非编码RNA(m iRNA)反向预测及多基因网络调控模式构建
利用TargetScan[18-20](http://www.targetscan.org/mamm_31/)数据库反向预测关键基因mRNA的miRNA,筛选并收集保守性miRNA,同时利用Cytoscape软件构建miRNAmRNA相互作用网络调控模式。
2 结果
2.1 醒脾舒肝汤活性化合物筛选通过TCMSP数据库共收集醒脾舒肝汤中化合物422个,其中麻黄363个,红花189个,川芎189个,细辛192个,艾叶135个,柴胡349个,吴茱萸176个,白术55个,白芍85个,香附104个。初步筛选后得出醒脾舒肝汤有效高活性化合物,麻黄10个,红花12个,川芎6个,细辛6个,艾叶7个,柴胡9个,吴茱萸21个,白术4个,白芍3个,香附10个,基本信息见表1。
2.2 活性化合物靶点预测与“中药—疾病—表型”共同靶点筛选通过Swiss Target Prediction数据库对候选化合物相关靶点进行预测,剔除无化学结构及无靶点化合物,得到醒脾舒肝汤中麻黄、红花、川芎、细辛、艾叶、柴胡、吴茱萸、白术、白芍、香附共4 025个靶点,重复靶点整合后得到799个中药靶点。通过GeneCards数据库收集得到中医郁病靶点,即“焦虑症”“抑郁症”“躯体形式障碍”,共得到8 364个抑郁症疾病靶点。通过GeneCards数据库收集得到自噬靶点,共得到5 096个自噬表型靶点。利用Bioinformatics Gent取交集获得“中药—疾病—表型”共同靶点,共同靶点312个,绘制韦恩图见图1,共同靶点见表2。

图1 “中药—疾病—表型”共同靶点韦恩图
2.3 “中药—疾病—表型”共同靶点蛋白PPI网络构建及亚网络拓扑分析利用String数据库及Cytoscape软件对共同靶点蛋白进行相互作用网络分析,得出PPI网络图(图2A)。设定1≤Degree值≤10为绿色;11≤Degree值≤20为紫色;21≤Degree值≤30为粉红色;31≤Degree值≤63为红色,根据Network analyzer分析中Degree值设定节点大小,Degree值越大,节点越大。同时采用PPI网络图亚网络拓扑分析,MCC算法、MCODE算法结果分别见图2B,图2C,整合3种算法得到的基因,取三者并集得到关键基因39个,结果见表3。
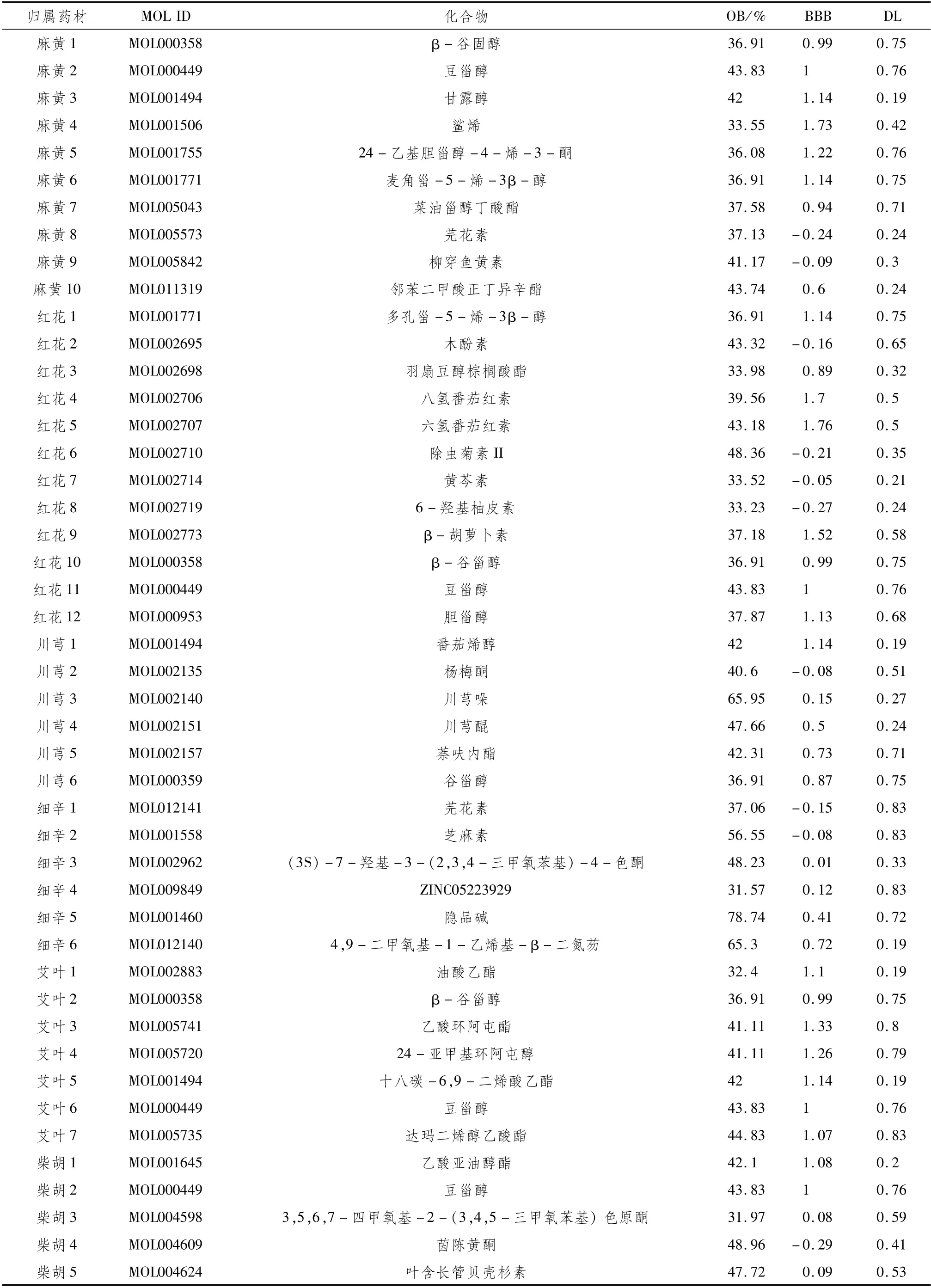
表1 醒脾舒肝汤中有效高活性化合物基本信息

续表1 醒脾舒肝汤中有效高活性化合物基本信息
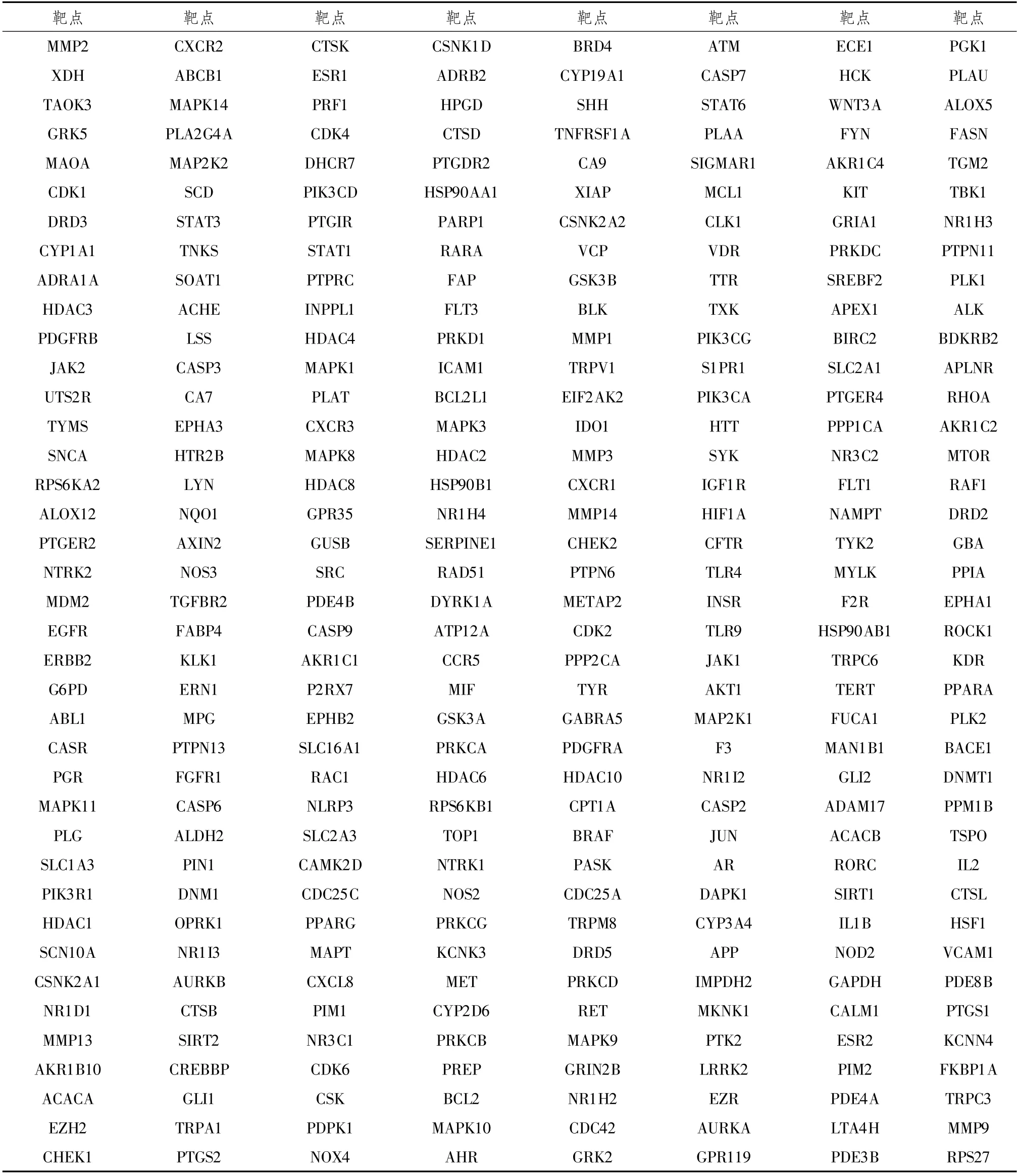
表2 “中药—疾病—表型”共同靶点
PPI网络图中有312个节点,1 627条边,P-value<<1.0e-16,平均节点度为10.4,聚类系数为0.459,其中Degree值大于30的基因为SRC(Degree值 =63);MAPK1(Degree值 =62);PIK3CA(Degree值=61);PIK3R1(Degree值=58);MAPK3(Degree值=58);STAT3(Degree值=57);AKT1(Degree值=53);FYN(Degree值=53);LYN(Degree值=46);HSP90AA1(Degree值=45);PTPN11(Degree值=39);RAC1(Degree值=39);RHOA(Degree值=38);MAPK8(Degree值=35);CREBBP(Degree值=35);EGFR(Degree值=35);APP(Degree值=35);PTK2(Degree值=34);JUN(Degree值=33);JAK2(Degree值=33);JAK1(Degree值=33);MAPK14(Degree值=33)。
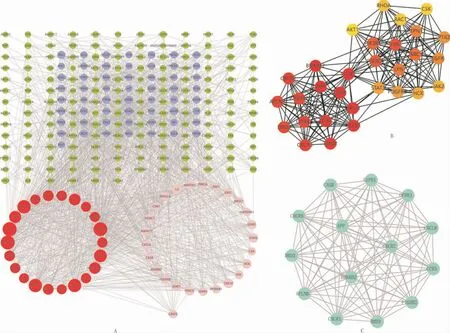
图2 共同靶点PPI网络图及亚网络拓扑分析图
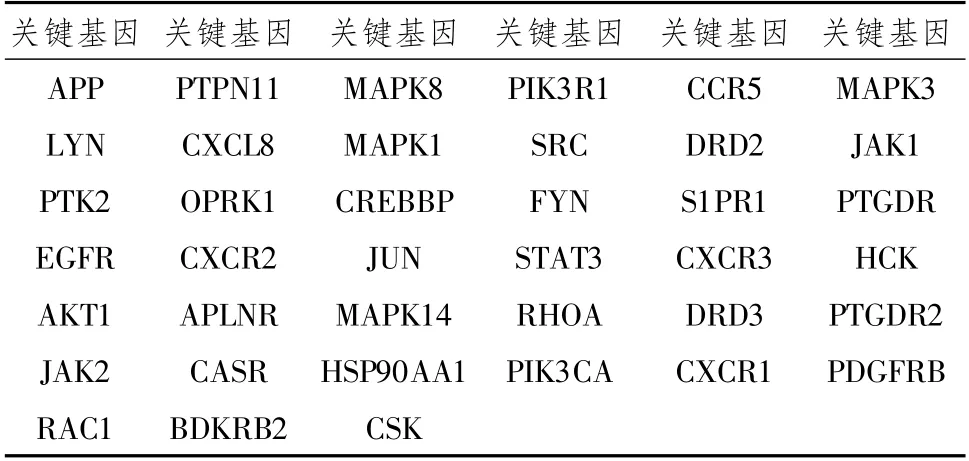
表3 整合Degree、MCC、MCODE算法的关键基因
2.4 共同靶点GO和KEGG富集分析BP富集结果,共富集537个生物过程,加权集合覆盖分析出10个最相关生物过程,根据“P-Value”升序排列,主要富集于对有毒物质的反应、蛋白质丝氨酸/苏氨酸激酶活性的调节、细胞内信号转导的负调控、肽基酪氨酸修饰、对氧气水平的反应等生物进程。根据“Ratio”“P-Value”“FDR”值绘制火山图如图3A。
CC富集结果,共富集34个细胞成分,加权集合覆盖分析出10个最相关细胞成分,根据“P-Value”升序排列,主要富集于膜区、受体复合体、神经细胞体、膜面、谷氨酸能突触等。根据“Ratio”“P-Value”“FDR”值绘制火山图如图3B。
MF富集结果,共富集71个分子功能类别,加权集合覆盖分析出10个最相关分子功能类别,根据“P-Value”升序排列,主要富集于蛋白质丝氨酸/苏氨酸激酶活性、蛋白质酪氨酸激酶活性、转录因子活性,直接的配体调节序列特异性DNA结合、磷酸酶结合、磷蛋白结合等。根据“Ratio”“P-Value”“FDR”值绘制火山图如图3C。
KEGG富集结果,共富集154条信号通路,加权集合覆盖分析出10条最相关信号通路,根据“P-Value”升序排列,主要为癌症途径、MicroRNA通路、细胞凋亡、AGE-RAGE信号通路、胰岛素抵抗、MAPK信号通路、趋化因子信号通路等。根据“Ratio”“P-Value”“FDR”值绘制火山图如图3D。
Metascape[17]数据库MCODE算法对KEGG富集分析进行聚类亚网络分析,并进行可视化,共同靶点主要聚9类,主要以Ⅰ、Ⅱ、Ⅲ、Ⅳ类为主,Ⅰ类靶点主要富集于R-HSA-9006934、R-HSA-449147、R-HSA-5674499通路;Ⅱ类靶点主要富集于R-HSA-9006925、R-HSA-449147、RHSA-1257604通路;Ⅲ类靶点主要富集R-HSA-5633007、R-HSA-9006934、R-HSA-3700989通路,Ⅳ类靶点主要富集于R-HSA-418594、RHSA-373076、R-HSA-500792通路,具体结果见图4、表4。
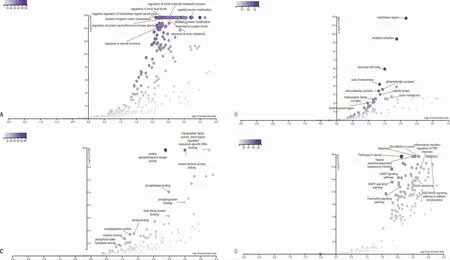
图3 共同靶点GO、KEGG富集分析结果图

图4 KEGG聚类亚网络分析图
2.5 关键基因m iRNA预测分析TargetScan数据库中反向预测39个关键基因的保守性miRNA,其中8个关键基因CCR5、CXCR1、CXCR2、CXCR3、CXCL8、DRD3、HCK、PTGDR2未预测到miRNA,共919个miRNA-mRNA相互作用关系,在Cytoscape软件中将共同靶点的mRNA设置为“三角形”“红色”;将反向预测的miRNA设置为“圆形”“蓝色”,可视化如图5。

表4 KEGG聚类亚网络结果
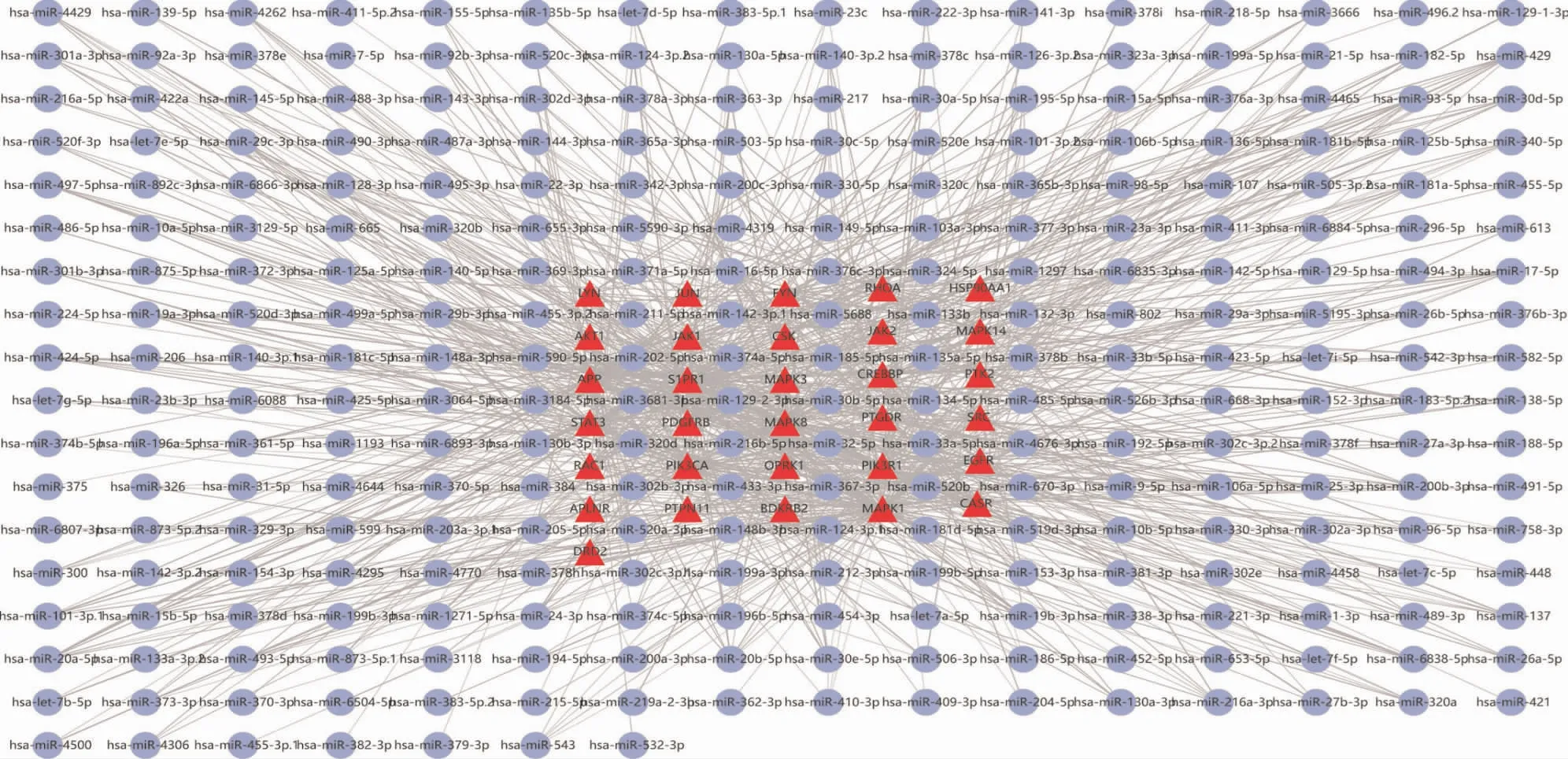
图5 关键基因mRNA-m iRNA相互作用预测关系图
3 讨论
郁病源于《黄帝内经》,发展于《伤寒杂病论》。《素问·六元正纪大论》中谈及郁病甚者,木、火、土、金、水郁分别当以达、发、夺、泻、折为法治疗,从而奠定了郁病学说的基础。《素问· 举痛论》云:“思则心有所存,神有所归,正气留而不行,故气结矣。”提出郁病与情志之间的病因关系。此后,张仲景《伤寒论》《金匮要略·妇人杂病脉证治》从六经辨证理论出发,认为郁病属少阳之枢,气机升降出入、枢纽开合、肝木调达都赖肝胆疏泄,并创小柴胡汤。郁病多与情志有关,情志过极则气血失和,气机不畅,不思饮食,郁久五脏俱伤,主要累及肝脾两脏,气滞及痰湿内生,则肝郁气滞兼有脾虚湿盛,当以疏肝行气,醒脾祛湿治之。根据多年临床经验,结合肝郁气滞兼有脾虚湿盛病机,制定具有疏肝行气、醒脾祛湿功效的醒脾舒肝汤,由麻黄、红花、川芎、细辛、艾叶、柴胡、吴茱萸、白术、白芍、香附按特定比例组成,同时采用中医定向透药联合灸法的方式,临床治疗躯体形式障碍、焦虑抑郁状态取得了较好的疗效。
生物信息学是生物医学与计算机科学的综合体,利用数学分析方法,已成为系统生命学的重要组成部分。网络药理学以中药为研究对象,以大数据为基础,研究中药潜在作用靶点及机制,为推动中医药现代化创造了巨大的潜力。分子网络数据挖掘分析是DNA、RNA、蛋白质等生物分子以网络整体调控模式参与机体生命过程。“辨证论治”“整体观念”是中医学基本特色,网络药理学、分子网络数据挖掘等生命信息学从系统整体对药物、疾病、机制进行科学认识,两者具有高度契合性。本研究采用生物信息学方法,挖掘醒脾舒肝汤活性成分、筛选分析“中药—疾病—表型”共同靶点,从分子、基因角度研究其作用机制。
本研究收集醒脾舒肝汤麻黄、红花、川芎、细辛、艾叶、柴胡、吴茱萸、白术、白芍、香附中化合物共422个,初步筛选得到具有良好生物活性及口服利用度的化合物,已被文献报道具有抗脂类沉积、抗损伤、免疫调节等活性。如Vanmierlo等[21]研究发现,麻黄活性化合物谷固醇(beta-sitosterol)和豆甾醇(Stigmasterol)能通过影响脑胆固醇稳态改善Abcg5-/-小鼠焦虑行为,López-Rubalcava等[22]研究发现β谷固醇能使GABA(A)与其受体结合形成复合物,从而发挥抗抑郁作用。Li等[23]通过代谢组学的方法揭示了豆甾醇能应激抗性大鼠外周血单核细胞的潜在抗抑郁和抗逆机制,其作用机制可能与能量代谢、神经递质、O-GlcNAcylation和cAMP信号级联等有关。由此可见,筛选所得醒脾舒肝汤的活性化合物具有抗抑郁的作用。
本研究以中医“郁病”作为切入点,中西医结合对应研究“焦虑症”“抑郁症”“躯体形式障碍”的作用机制可能与自噬有关[3],结合GeneCards数据库挖掘“中药—疾病—表型”,即“醒脾舒肝汤—郁病—自噬”的共同靶点共312个,充分体现了中药多成分、多靶点的网络调控关系,验证了醒脾舒肝汤可能以其多成分、多靶点、整体协同方式通过自噬机制发挥抗抑郁的作用。进一步分析共同靶点蛋白相互作用网络图,结合MCC算法、MCODE算法及拓扑分析,筛选出“醒脾舒肝汤—郁病—自噬”调控关系中关键基因39个,其中已有文献报道,淀粉样前体蛋白[24]被证实是NRF1基因网络的靶基因,参与人脑多种疾病的发生,其中包括焦虑抑郁。JUN基因在外周血中过表达,可作为抑郁治疗的预测分子[25],能增强自噬,稳定焦虑抑郁情绪[26]。由此可见,多个关键基因既能作为郁病治疗的预测靶标,也能参与增强自噬途径,从而发挥抗抑郁稳定情绪的作用。
本研究对关键基因进行富集分析,主要富集于膜区、受体复合体、突触等细胞成分,通过磷酸化、泛素化等直接作用机制调节蛋白质活性及蛋白结合能力等,影响蛋白—蛋白、蛋白—DNA、蛋白—RNA相互作用关系,从而影响细胞内信号传导的调控及氧利用等生物进程,其主要作用机制可能与MicroRNA通路、细胞凋亡、AGE-RAGE信号通路、胰岛素抵抗等多通路网络模式调控自噬通路有关。Wang等[6]研究发现,逍遥散加减能通过细胞凋亡机制介导自噬小体形成,增强自噬从而发挥抗抑郁作用,证实细胞凋亡与自噬表型嵌套模式能发挥协同抗抑郁作用。Gulbins等[3]研究发现,抗抑郁药通过诱导鞘磷脂神经酰胺控制的自噬发挥作用,其作用机制主要与酪氨酸激酶受体通路调控自噬发挥抗焦虑作用有关。研究发现T淋巴细胞与白细胞介素-10介导的炎症信号通路[27],激活下游自噬通路[28],从而发挥抗焦虑抑郁作用。由此可见,关键基因能在多细胞成分、多分子功能、多生物进程中与多条通路网络调控有关。结合预测结果及文献报道得出,醒脾舒肝汤在细胞膜区改变膜蛋白结构,影响蛋白与蛋白、RNA、DNA结合,影响细胞内信号传导的生物进程抗焦虑抑郁,其机制可能与网络化调控多通路机制介导自噬增强有关。
本研究进一步以miRNA通路介导自噬增强为方向,反向预测关键蛋白相关miRNA,得出919个miRNA与关键蛋白mRNA 相互作用关系。Ma等[29]高通量测序结果显示,miR-378、miR-34b、miR-194、miR-206、miR-10a、miR-10a、let-7a、miR-34c、miR-34b、miR-21a等在抑郁样行为的小鼠中异常表达,并且荧光素酶基因报告实验证实异常表达的miRNA-mRNA相互作用,参与GABA能突触、自噬通路、神经递质合成等多种机制发挥抗抑郁作用,其中高通量筛选及实验验证结果与本研究预测结果相吻合。由此可见,miRNA-mRNA相互作用模式可能通过调控自噬发挥抗抑郁作用。
综上所述,基于生物信息学方法分析醒脾舒肝汤治疗郁病的作用,预测其治疗的关键基因,富集分析得出关键基因的蛋白互作关系、生物进程和信号通路,同时采用miRNA-mRNA模式反向预测关键基因的miRNA,最终得出醒脾舒肝汤多成分、多靶点、多通路、多miRNA参与增强自噬机制发挥抗抑郁作用,为中医郁病治疗,西医抑郁症、焦虑症、躯体形式障碍的治疗提供理论靶点及临床预测标志物,推进中西医结合诊断治疗郁病的发展,同时为进一步开发醒脾舒肝汤提供分子层面依据,为后续实验提供预测理论基础。
