紫草素对人大肠癌HT29细胞化疗增敏作用研究*
2021-02-23孙艳华徐建立李明曹学彬董路孟小晶
孙艳华,徐建立,李明,曹学彬,董路,孟小晶
1.沧州市人民医院,河北沧州061000;2.沧县医院,河北沧县061009
大肠癌是我国最常见的消化道恶性肿瘤之一,发病率仍呈逐年增长趋势,严重威胁着人们的生命健康。近年来,虽然手术技术及化疗方案取得了很大进步,但大肠癌患者术后复发率达40% ~50%,5年生存率仍不足40%[1-3]。而化疗耐药所致化疗敏感性降低是导致大肠癌患者复发的主要因素之一[4-6]。因此,寻找高效化疗增敏剂或许是解决化疗耐药、延长大肠癌患者生命的有效手段。紫草是我国传统中药品种,《神农本草经》《本草纲目》中均有记载,具有清热凉血,解毒透疹之功效。现代药理学研究表明,紫草素具有明显的抗肿瘤活性,对肺癌[7]、肝癌[8]、宫颈癌[9]、子宫内膜癌[10]、乳腺癌[11]等均具有一定的抑制作用,且能提高肺癌H1975细胞对埃克替尼[12]和绒毛膜癌细胞对甲氨蝶呤[13]的化疗敏感性。本研究通过紫草素+奥沙利铂联合干预人大肠癌HT29细胞,并对比奥沙利铂组、空白对照组疗效,研究紫草素对人大肠癌HT29细胞奥沙利铂化疗敏感性的作用及其机制。
1 材料
1.1 细胞人大肠癌HT29细胞(中科院上海细胞库)。
1.2 药品与试剂紫草素(中国食品药品检定研究院,纯度≥98%,批号:110769-201904);注射用奥沙利铂(江苏恒瑞医药股份有限公司,批号:1812016);DMEM培养基(高糖)、胰蛋白酶(上海碧云天生物技术有限公司,批号:20190419、20190403);胎牛血清(杭州四季青生物工程材料有限公司,批号:190527);CCK-8试剂盒(南京立乔生物科技有限公司,批号:190318);Annexin-PE/7-AAD细胞凋亡检测试剂盒(美国BD公司,批号:556418);Bcl-2抗体(上海碧云天生物技术有限公司,批号:201901004);Bax抗体(上海碧云天生物技术有限公司,批号:201811012);激活型Caspsae-3多克隆抗体(上海碧云天生物技术有限公司,批号:201812009)。
1.3 仪器EPICS-XL型流式细胞仪(美国Bcekman公司);iMark型酶标仪(美国BIO-RAD公司);BB5060U型CO2细胞培养箱(德国Hereaus公司);DYY-11型多用电泳仪、DYCZ-40B型转印泳槽(北京六一仪器厂)。
2 方法
2.1 细胞分组与给药人大肠癌HT29细胞培养于含10%胎牛血清的DMEM培养基,置恒温37℃、饱和湿度、5%CO2的培养箱中进行细胞培养。取对数生长期HT29细胞,经0.25%胰酶消化后,调整细胞浓度至5×104mL-1,设空白对照组、紫草素(0.5 mg·L-1)组、奥沙利铂(25 mg·L-1)组[14]、联合[紫草素(0.5 mg· L-1)+奥沙利铂(25 mg·L-1)]组,每组设10个复孔,给药干预48 h后进行指标检测。
2.2 指标的检测
2.2.1 细胞增值率的测定采用细胞活力检测试剂盒(CCK-8)测定细胞增值率:调整细胞浓度至3×103mL-1接种于96孔板(接种量50μL),每组10个复孔,每孔加入10μL的CCK-8溶液,置细胞培养箱培养1 h后,通过酶标仪测定A570 nm值。
细胞增殖率(%)=[(空白对照组A570 nm值-干预组A570 nm 值)/空白对照组A570 nm值]×100%
2.2.2 细胞凋亡及细胞周期的检测各组分别取约1×106个细胞,经离心半径10 cm、10 000 rpm离心5 min后去上清、取沉淀细胞,经PBS溶液洗涤后加入5 mL浓度70%乙醇,恒温4℃放置48 h后再次离心取细胞,经PBS溶液洗涤后加入5μL浓度为10 g·L-1的水解酶Rnase,恒温37℃放置1 h后加入碘化丙啶染液行避光孵育0.5 h,然后经流式细胞仪检测并分析细胞周期时相;遵照Annexin-PE/7-AAD细胞凋亡检测试剂盒操作说明,通过流式细胞仪检测细胞凋亡状况并计算凋亡率。
2.2.3 Bcl-2、Bax、激活型Caspase-3蛋白表达检测取各组细胞经半径10 cm、10 000 r·min-1离心5 min后取细胞,行3次PBS溶液洗涤后超声破碎细胞,恒低温4℃条件下高速12 000 r·min-1离心20 min取沉淀,BCA法蛋白质定量试剂盒进行蛋白定量后,行水沸浴高温变性,然后采用Western blot法进行蛋白表达检测:上样、SDS-PAGE凝胶电泳、转PVDF膜、丽春红染色、5%脱脂奶粉封闭后,恒温4℃环境一抗(Bcl-2、Bax、激活型Caspase-3、β-actin)孵育12 h,PBS溶液洗膜后二抗室温孵育1 h,DAB显色,以β-actin为内参,条带灰度值以半定量蛋白表达。
2.3 统计学方法计量结果以均数±标准差(±s)方式表示,多组间均数比较通过SPSS 17.0软件行单因素方差分析,两两比较行LSD-t检验,率的比较采用χ2检验,取检测限α=0.05。
3 结果
3.1 各组人大肠癌HT29细胞增殖检测结果较空白对照组,紫草素组、奥沙利铂组和联合组人大肠癌HT29细胞增殖率显著降低(P<0.01);较奥沙利铂组,联合组HT29细胞增殖率明显降低(P<0.05)。见表1。
3.2 各组人大肠癌HT29细胞凋亡检测结果较空白对照组,紫草素组、奥沙利铂组和联合组HT29细胞凋亡率显著升高(P<0.01);较奥沙利铂组,联合组细胞凋亡率显著升高(P<0.01)。见表1,图1。
表1 各组人大肠癌HT29细胞增殖率和凋亡率(±s,%)

表1 各组人大肠癌HT29细胞增殖率和凋亡率(±s,%)
注:较空白对照组,*P<0.05,**P<0.01;较奥沙利铂组,△P<0.05,△△P<0.01
组别n 细胞增殖率细胞凋亡率空白对照组10-1.80±0.45紫草素组10 22.05±3.48**16.72±1.79**奥沙利铂组10 17.93±2.27**21.38±2.43**联合组10 14.48±1.71**△27.42±3.85**△△

图1 各组人大肠癌HT29细胞凋亡情况
3.3 各组人大肠癌HT29细胞周期检测结果较空白对照组,紫草素组、奥沙利铂组和联合组处于细胞周期G0/G1期细胞比例显著升高,S期、G2/M期细胞比例显著降低(P<0.05;P<0.01);较奥沙利铂组,联合组G0/G1期细胞比例显著升高,G2/M期细胞比例显著降低(P<0.05;P<0.01),S期细胞比例两组间差异无统计学意义(P>0.05)。结果见图2,表2。
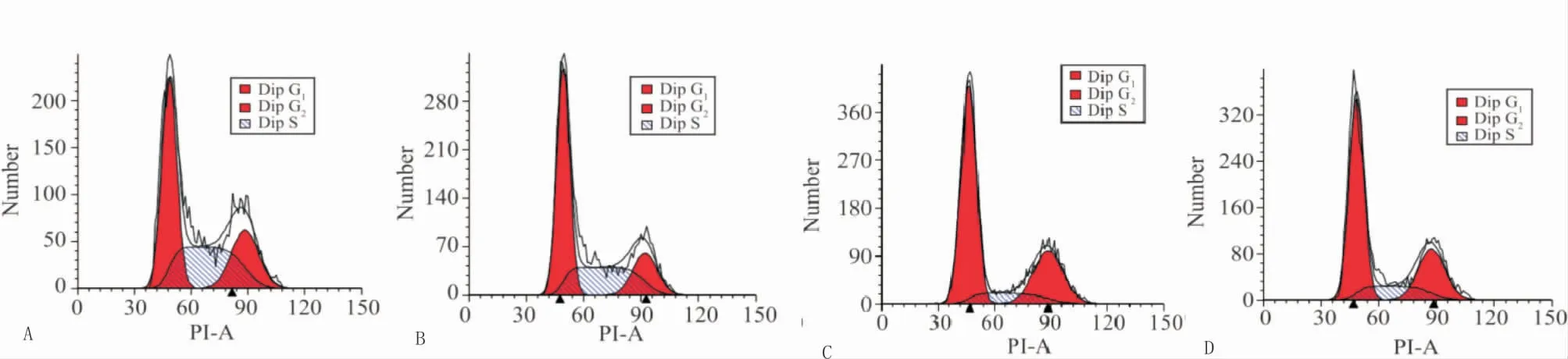
图2 各组人大肠癌HT29细胞周期分布
表2 各组人大肠癌HT29细胞周期(±s,%)
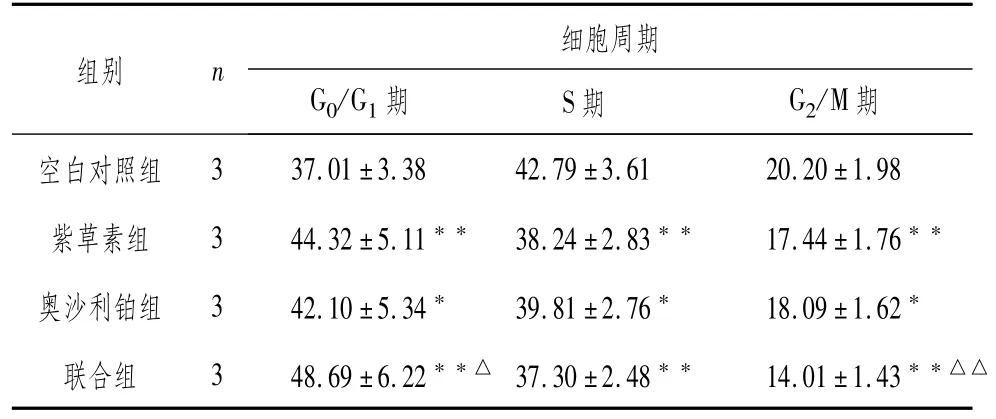
表2 各组人大肠癌HT29细胞周期(±s,%)
注:较空白对照组,*P<0.05,**P<0.01;较奥沙利铂组,△P<0.05,△△P<0.01
组别n细胞周期G0/G1期S期G2/M期空白对照组3 37.01±3.38 42.79±3.61 20.20±1.98紫草素组3 44.32±5.11**38.24±2.83**17.44±1.76**奥沙利铂组3 42.10±5.34*39.81±2.76*18.09±1.62*联合组3 48.69±6.22**△ 37.30±2.48**14.01±1.43**△△

3.4 各组人大肠癌HT29细胞Bcl-2、Bax、激活型Caspase-3蛋白表达检测结果较空白对照组,紫草素组、奥沙利铂组和联合组HT29细胞Bcl-2蛋白表达量显著降低而Bax、激活型Caspase-3蛋白表达量显著升高(P<0.05;P<0.01),Bax/Bcl-2值显著升高(P<0.01);较奥沙利铂组,联合组Bcl-2表达量显著降低而Bax、激活型Caspase-3表达量显著升高(P<0.05;P<0.01),Bax/Bcl-2值显著升高(P<0.01)。见表3、图3。
表3 各组人大肠癌HT29细胞Bcl-2、Bax、激活型Caspase-3蛋白表达及Bax/Bcl-2值(±s)
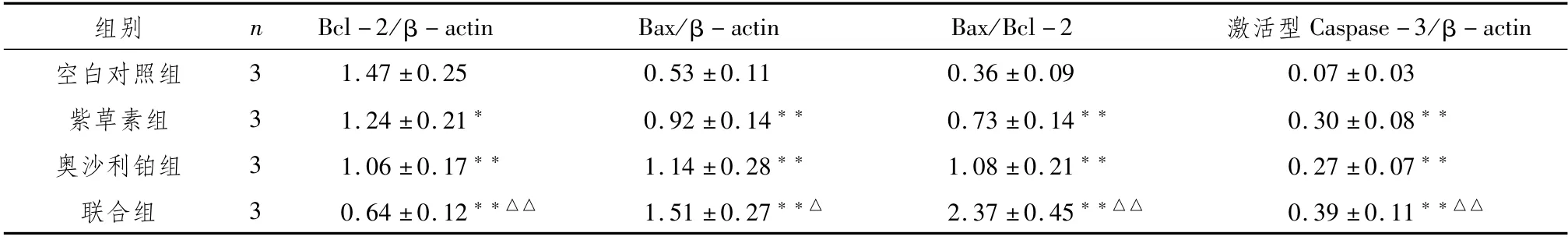
表3 各组人大肠癌HT29细胞Bcl-2、Bax、激活型Caspase-3蛋白表达及Bax/Bcl-2值(±s)
注:较空白对照组,*P<0.05,**P<0.01;较奥沙利铂组,△P<0.05,△△P<0.01
-actin空白对照组3 1.47±0.25 0.53±0.11 0.36±0.09 0.07±组别n Bcl-2/β-actin Bax/β-actin Bax/Bcl-2 激活型Caspase-3/β 0.03 紫草素组3 1.24±0.21*0.92±0.14**0.73±0.14**0.30±0.08**奥沙利铂组3 1.06±0.17**1.14±0.28**1.08±0.21**0.27±0.07**联合组3 0.64±0.12**△△1.51±0.27**△2.37±0.45**△△0.39±0.11**△△
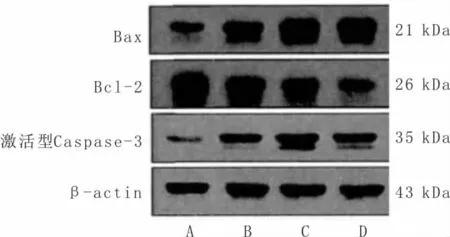
图3 各组人大肠癌HT29细胞Bcl-2、Bax、激活型Caspase-3蛋白表达
4 讨论
目前,临床上对于大肠癌的治疗主要采取外科手术切除结合术前、术后化疗的治疗方案,能相对延长患者生存期,但仍无法控制大肠癌的复发和转移。奥沙利铂是大肠癌化疗一线用药,耐药所致化疗敏感性的降低是导致其术后复发的主要原因之一,因此,研发高效的化疗增敏剂或许能够提高其疗效和预后。
紫草素是中药紫草的主要活性成分,近年来,紫草素抗肿瘤活性逐渐得到证实。杨阳等[9]研究发现紫草素能够通过改变细胞周期而对宫颈癌SiHa细胞生长起到抑制作用;张萍等[15]发现紫草素能够通过调节凋亡相关基因(上调促凋亡基因Bax,下调抑凋亡基因Bcl-2表达),促进人肝癌HepG2细胞凋亡,进而抑制其生长。紫草素的化疗增敏作用也得到了广泛关注。研究发现,紫草素能够逆转人肺腺癌A549细胞[16]和卵巢癌SKOV3细胞[17]顺铂耐药并提高其化疗敏感性。本研究发现,与奥沙利铂单药组比较,紫草素+奥沙利铂联合给药干预能够更加明显地阻滞人大肠癌HT29细胞周期、抑制HT29细胞增殖并提高其凋亡率,提示紫草素具有提高人大肠癌HT29细胞奥沙利铂化疗敏感性的作用。
抑制细胞增殖并诱导细胞凋亡是奥沙利铂抗肿瘤最主要的作用机制[18-19]。激活型Caspase-3参与细胞凋亡全过程调控,是诱导细胞凋亡最关键的蛋白酶[20-22],Bcl-2和Bax同属Bcl-2基因家族,二者相互作用而发挥对细胞凋亡的调控作用。Bcl-2能够抑制Caspase-3蛋白酶的激活、抑制Ca2+内流超载,表现为抑凋亡作用[23-25];而Bax则能够促进细胞色素释放、破坏线粒体膜通透性等而表现出促凋亡作用[26-27];且Bcl-2、Bax二者对凋亡的调控作用正向依赖于比值[28-30]。本研究发现,与奥沙利铂单药组比较,紫草素+奥沙利铂联合给药干预能够显著提高人大肠癌HT29细胞Bax、激活型Caspase-3蛋白表达并降低Bcl-2表达,提高Bax/Bcl-2值;与空白对照组比较,紫草素单药干预能够显著提高Bax、激活型Caspase-3蛋白表达并降低Bcl-2蛋白表达,提高Bax/Bcl-2值,这可能是紫草素增强奥沙利铂促进人大肠癌HT29细胞凋亡的重要分子机制。
综上所述,紫草素具有提高人大肠癌HT29细胞奥沙利铂化疗敏感性的药理学作用,其作用机制可能与紫草素阻滞细胞周期进程而抑制HT29细胞增殖、调节凋亡相关蛋白表达而促进其凋亡有关。
