湿法净化磷酸与热法磷酸在微生物发酵应用中的差异研究
2021-02-23李文飞王凤霞
李文飞,王凤霞,2,杨 坤
(1 中低品位磷矿及共伴生资源高效利用国家重点实验室,贵州 贵阳 550016;2 瓮福(集团)有限责任公司,贵州 贵阳 550000;3 黔东南州食品药品检验检测中心,贵州 凯里 556012)
腺嘌呤核苷三磷酸(Adenosinetriphosphate)简称三磷酸腺苷(ATP),是由1分子腺嘌呤,1分子核糖和3分子磷酸基团组成的一种不稳定的高能磷酸化合物,也是生物体内最直接的能量来源,从而保证了细胞各项生命活动的能量供应。对于动物、人、真菌和大多数细菌来说,合成ATP的主要途径都是来自于细胞自身进行的呼吸作用释放的能量。ATP中的P既是代表的磷酸基团。由此可知,磷在生命体中起到重要作用。在微生物培养基中添加适量的磷,可促进菌体健康快速的生长繁殖,提高微生物代谢产物的合成量[1-4]。微生物培养基制备过程中一般添加磷酸盐以满足微生物繁殖及生长。但在工业化生产过程中需考虑成本、添加方式等问题,由此微生物发酵厂家多采用磷酸代替磷酸盐产品。国内市售磷酸产品目前有热法磷酸和湿法净化磷酸两种。热法磷酸的生产工艺能耗较大、成本相对较高,且容易产生对人体有害的毒性气体,在国际上已被湿法净化磷酸产品所替代。国内的磷酸市场有80%以上都被湿法净化磷酸所占据,但仍有部分企业由于某方面原因,还在生产并使用热法磷酸[5]。《GB2760-2014食品安全国家标准 食品添加剂使用标准》中,对食品工业用加工助剂使用中明确规定指出,磷酸可作为食品工业用加工助剂(发酵用营养物质)在发酵工艺上使用[6],因此本文特将湿法净化磷酸与热法磷酸同时作为发酵营养物质在微生物发酵工艺中进行试验,以验证两者是否存在差异。本试验选取了真菌菌株(酿酒酵母菌SaccharomycescerevisiaeHansen)、与细菌菌株(枯草芽孢杆菌Bacillussubtilis)进行相关微生物发酵试验。
1 实 验
1.1 原料及试剂
试验菌种:真菌(酿酒酵母菌)、细菌(枯草芽孢杆菌),贵州大学生命科学学院菌种保存室提供。
磷酸:食品添加剂磷酸(湿法)(85%),瓮福(集团)有限责任公司;食品添加剂磷酸(热法)(85%),市售。
试剂:磷酸二氢钾、葡萄糖、琼脂、硫酸铵、氧化钙、氢氧化钠、碘粒、碘化钾等,以上试剂均为分析纯。
培养基及试剂配制:
培养基参照参考文献[7]进行配制。
真菌培养基:YPD基础培养基、YPD磷酸盐培养基(在基础培养基中添加磷酸二氢钾10 g)、YPD磷酸培养基(在基础培养基中添加与磷酸二氢钾同等磷含量的磷酸)。
细菌培养基:LB基础培养基、LB磷酸盐培养基(在基础培养基中添加磷酸二氢钾0.35 g)、LB 磷酸培养基(在基础培养基中添加磷酸二氢钾同等磷含量的磷酸)。
淀粉培养基:配制方法参照文献[15]进行配制。
固体培养基配制:按照以上配方,每1000 mL培养基中加入20 g琼脂即可。
1 mg/mL葡萄糖标准液、DNS显色液:配制方法参照文献[13]进行配制。
卢哥氏碘液:碘粒1 g,碘化钾2 g。先将碘化钾溶解在少量水中,再将碘粒溶解在碘化钾中,待碘完全溶解后加纯水定容至300 mL。
1.2 主要仪器和设备
DB-XAB型石墨加热板,力辰科技;BXM-30R型立式压力蒸汽灭菌锅,上海博迅;TDL-5-A高速离心机,上海安亭;DHP-9052B型恒温培养箱,上海一恒;VD-650型超净工作台(带紫外灯),力辰科技;PL-180型偏光显微镜,德国蔡司;PE Lambda型紫外可见分光光度计,美国热电等。
1.3 实验方法
1.3.1 真菌菌株(酿酒酵母)发酵试验
采用固体发酵、液体发酵两种方式进行试验。固体发酵检测指标:菌株单菌落直径;液体发酵检测指标:真菌生长量、菌丝体干重、发酵能力、产酒精量等。
1.3.2 细菌菌株(枯草芽孢杆菌)发酵试验
采用固体发酵、液体发酵两种方式进行试验。固体发酵检测指标:菌株单菌落直径、产淀粉酶能力;液体发酵检测指标:细菌生长曲线、细菌生长量等。
1.3.3 检测方法
单菌落直径:用接种针挑取单一菌落点于平皿中间,待生长72小时后(枯草芽孢杆菌生长48小时),用游标卡尺测量单菌落直径大小。
生长曲线:参照微生物学实验教程(第四版)[7]采用比浊法测定生长曲线进行测定。枯草芽孢杆菌生长曲线测定参照文献[8-9]测定。
发酵液中生长量、菌丝干重测定、发酵能力(二氧化碳产生量)参照文献[10-12]检测方法进行测定。
发酵液残糖量参照文献[13]检测方法进行测定。
产酒精量(气相色谱法)、发酵液总酸、氨基酸态氮含量参照GB/T13662-2008标准进行测定[14]。
产淀粉酶能力测定参照文献[15]测定。
1.3.4 数据处理方法
采用SPSS17.0软件中进行分析,多重比较(LSD)确定组间差异,结果以“均值±标准偏差”表示,并以Origin软件作图, EXCEL软件作表。表中标相同字母无差异(P>0.05),不同字母代表有差异(P<0.05)。
2 结果与分析
2.1 真菌菌株(酿酒酵母)发酵试验结果与分析
2.1.1 单菌落测定
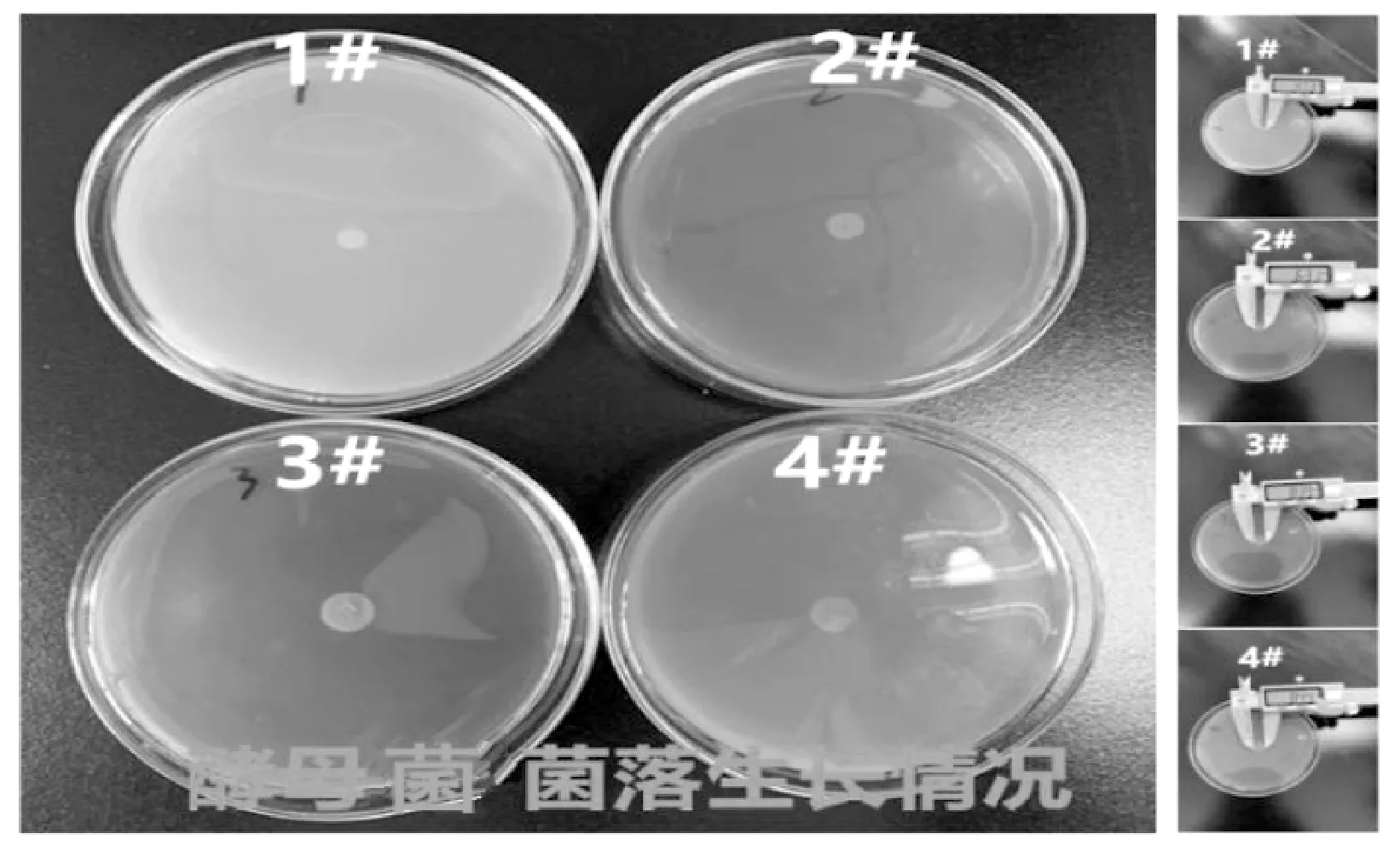
图1 酵母菌单菌落
由图1可看出,在添加热法磷酸(3#)、湿法净化磷酸(4#)的固体培养基上,酵母单菌落直径要比基础培养基(1#)和添加磷酸盐的培养基(2#)大。
2.1.2 生长曲线绘制
由图2酿酒酵母生长曲线可以看出,培养基中添加磷酸盐(磷酸二氢钾)、热法磷酸及湿法净化磷酸均能促进酵母菌的生长,能够促使酵母菌提前进入生长对数期,且在稳定期持续时间与基础培养基相比有所延长,这对微生物的次级代谢发酵具有重要意义。
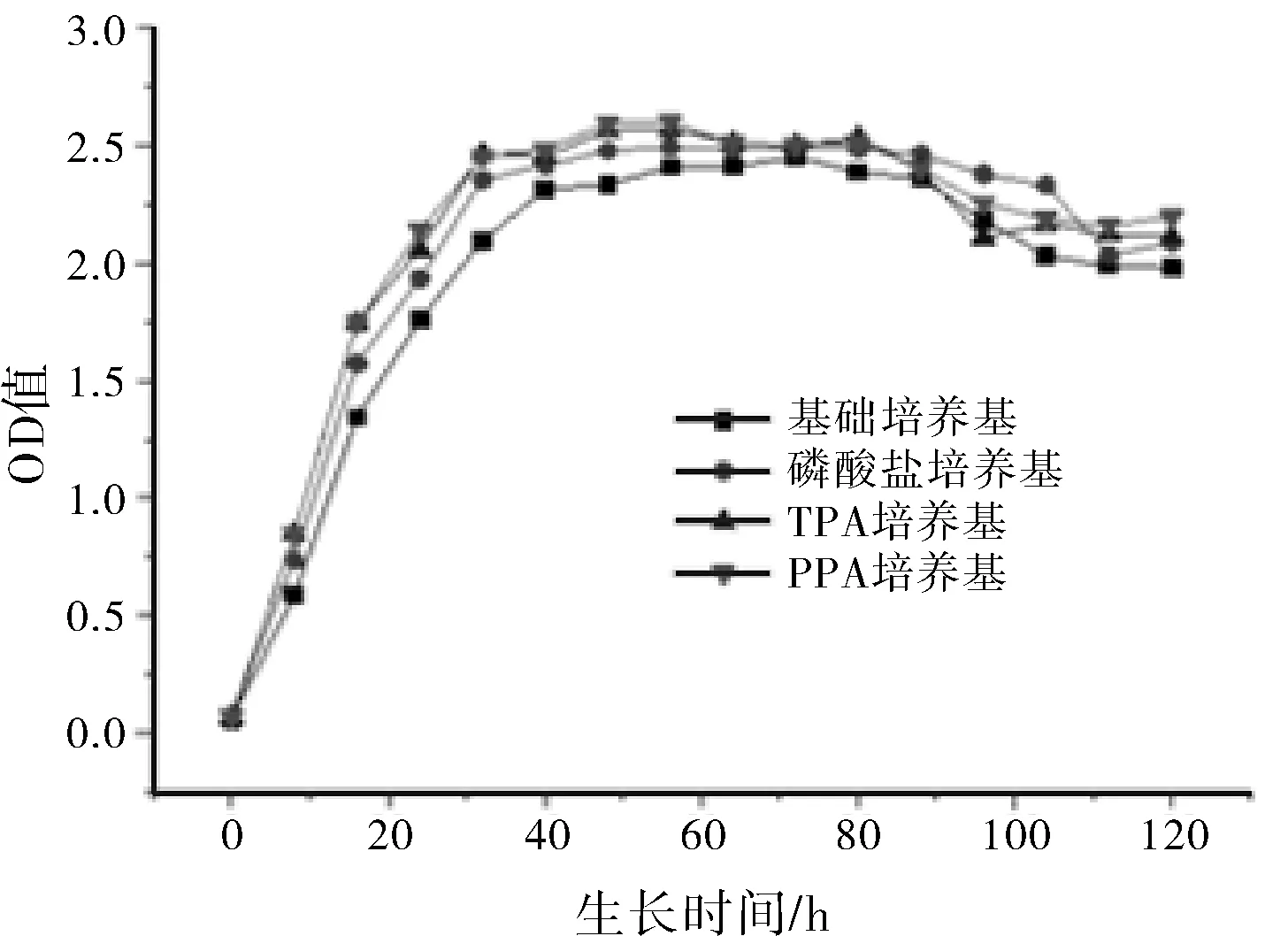
图2 酿酒酵母生长曲线
2.1.3 生长量测定
真菌类生长状况可根据发酵液中细胞含量以及菌丝体干重两个指标进行判断,由此将酵母菌进行了72 h液体发酵。结果见表1。

表1 真菌菌株液体发酵
2.1.4 发酵能力(二氧化碳产生量)
酵母发酵72 h后称量发酵液的重量,因每瓶液体发酵培养体积相同,因此测单位时间内发酵液失重量为CO2的产生量即可反应发酵能力。

表2 真菌菌株(酵母菌)产CO2量
由表2可知培养基中添加适量磷酸及磷酸盐与基础培养基相比能够产生更多的CO2,且热法磷酸与湿法磷酸培养基的CO2产生量略有差异但不显著。
2.1.5 发酵液残糖量测定
(1)吸收光谱的测定
将葡萄糖与DNS试剂反应液在波长190~750 nm进行扫描,可知在500 nm处具有最大吸收峰,因此选择λmax=500 nm进行检测。

图3 葡萄糖与 DNS试剂反应液的紫外一可见吸收光谱
(2)葡萄糖标准曲线测定
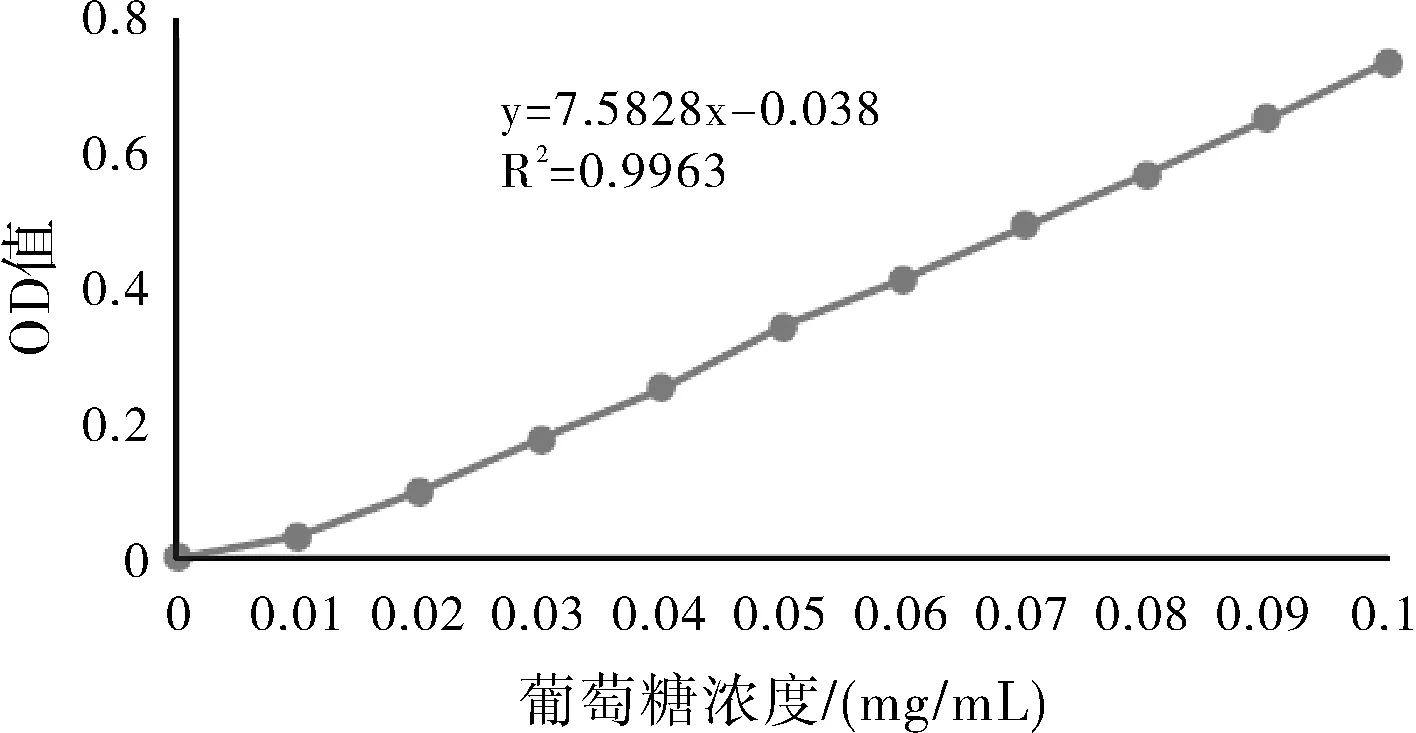
图4 葡萄糖标准曲线
(3)发酵液中残糖量测定

表3 酵母菌发酵液残糖量
由表3可知培养基中添加适量热法磷酸或湿法磷酸,与基础培养基相比消耗了较多的糖分,且存在显著性差异,而湿法磷酸和热法磷酸试验组差异不明显,进一步说明热法磷酸与湿法磷酸在酵母发酵过程中不存在显著差异。
2.1.6 产酒精量测定结果

表4 真菌菌株(酵母菌)发酵液酒精度
表4可知3#热法磷酸培养基与4#湿法净化磷酸培养基发酵后的酒精度分别为4.47、4.49,在统计学分析上没有显著性差异,说明培养基中添加湿法磷酸与热法磷酸的发酵效果一致。
2.1.7 总酸、氨基酸态氮含量测定

表5 真菌菌株(酵母菌)发酵液总酸、氨基酸态氮含量
由表5可以看出液体培养基中添加湿法磷酸PPA与热法磷酸TPA均能提高发酵液中总酸和氨基酸态氮含量,且提高量无显著差异。
2.2 细菌菌株(枯草芽孢杆菌)发酵试验
2.2.1 单菌落测定

图5 枯草芽孢杆菌单菌落
通过对单菌落直径检测,基础培养基、磷酸盐培养基、热法磷酸培养基和湿法净化磷酸培养基中单菌落直径分别为7.579、10.021、11.051、11.363 mm;经统计学分析可知,磷酸盐培养基、热法磷酸培养基和湿法净化磷酸培养基均与基础培养基存在显著性差异。
2.2.2 生长曲线绘制

图6 枯草芽孢杆菌生长曲线
由图6枯草芽孢杆菌生长曲线可以看出,培养基中添加磷酸盐、热法磷酸及湿法磷酸均能促进枯草芽孢杆菌生长量的增加,能够促使菌株提前进入生长对数期,且在稳定期持续时间与基础培养基相比有所延长。

图7 枯草芽孢杆菌产淀粉酶能力测试
由图7可知,从四种培养基上挑取的枯草芽孢杆菌在产淀粉酶能力上均未收到影响。从透明圈直径/单菌落直径数值来看,产酶能力相当,不存在显著差异。
2.2.3 发酵试验结果与分析

表6 枯草芽孢杆菌发酵试验结果
由表6可知,枯草芽孢杆菌在1#培养基与2#、3#、4#中的生长量、单菌落直径上存在一定差异,说明培养基中添加适量热法磷酸和湿法净化磷酸对枯草芽孢生长具有一定促进作用;在产淀粉酶透明圈直径、产淀粉酶菌落直径、产淀粉酶透明圈直径/菌落直径值上不存在显著性差异,由此说明说明培养基中添加适量热法磷酸和湿法磷酸对枯草芽孢产淀粉酶能力不会产生抑制。
3 结 论
微生物培养基中加入磷酸盐、热法磷酸和湿法净化磷酸对真菌菌株酿酒酵母和细菌菌株枯草芽孢杆菌发酵,并菌株单菌落直径、生长量、发酵能力、产酒精量、总酸量、产淀粉酶能力等指标进行统计学分析,得出磷酸盐、热法磷酸与湿法净化磷酸在以上指标上并无显著性差异,从使用效果来看,在微生物发酵应用过程中三者不存在显著性差异,进一步可说明湿法净化磷酸和热法磷酸与磷酸盐一样能够做为微生物发酵营养物质用。
