金刚石UV-Vis-MIR光谱常见特征综述
2021-02-23李建军范澄兴程佑法刘雪松山广祺李桂华丁秀云赵潇雪
李建军,范澄兴,程佑法,刘雪松,王 岳,山广祺,李 婷,李桂华,丁秀云,赵潇雪,黄 准,燕 菲,杜 冉
(1.山东省计量科学研究院,山东省计量检测重点实验室,济南 250014;2.国家黄金钻石制品质量监督检验中心,济南 250014;3.国家首饰质量监督检验中心深圳实验室,深圳 518020)
0 引 言
瑞典通用电气公司于1953年宣布首次成功合成了金刚石,美国通用电气公司(GE)于1954年12月16日宣布获得了人造金刚石[1]。这被认为是金刚石产业发展的里程碑,从此金刚石最大消耗领域的原材料开启了由人工生产的时代。
1963年12月6日,由北京通用机械研究所(现中国工业机械集团有限公司合肥通用机械研究院)、中国地质科学院、郑州磨料磨具磨削研究所组成的课题组第一次成功合成出中国的人造金刚石[1]。到2001年,中国借助六面顶设备生产的人造金刚石年产量达到13.9亿克拉,自此中国已成为人造金刚石第一生产大国[2]。几十年来,中国的人工金刚石绝大多数采用高温高压法生产,多用于磨料磨具磨削产业[3-4]。
科学家一直致力于研究如何让金刚石充分发挥其卓越性能,涉及光电、医疗、航天、量子通信等领域,近些年已经取得了一定的突破。但应用领域的开拓面临两大瓶颈:一是生产高纯度或高均匀性、大尺寸大直径单晶存在困难;二是对金刚石诸多晶格缺陷的研究不透彻。两大瓶颈引发的问题是,无满足条件的大单晶可用,也无法充分驾驭金刚石的晶格缺陷,因此将金刚石材料引用到众多领域尚难以精准控制其潜在属性。
近年来,高温高压(HPHT)和化学气相沉淀法(CVD)合成金刚石互相促进,在实现金刚石单晶生产尺寸上,取得了较大的进步;而金刚石微观领域,对晶格缺陷的研究,却是一个复杂的、庞大的基础性工程,进展缓慢,特别是在国内,研究进展不大。随着谱学测量效率和精度的提高,庞大数量的金刚石谱学特征被识别到,准确解析这些谱学特征,成为金刚石光、电、热应用的基础。国内外众多科学家投入大量精力对一些光谱特征对应的微观结构模型进行了较为合理的解读,逐步促成这些晶格微观模型成为金刚石作为各类功能材料的“开关”,有望通过这些微观模型开关控制金刚石成为多个领域的关键神经元。
本文将前人研究的金刚石常见光谱表现出的一些特征的部分成果进行汇总,为开展新的研究提供一定参考。
1 金刚石按谱学进行的分类
金刚石谱学分类是金刚石研究的重要基础。Robertson等[5-6]依据谱学表现,率先将金刚石分为I型、II型。近30年来,随着微区测试技术的出现与成熟,进一步深化了分类内涵,较为合理地解释了一些谱学特征产生的机理,被认为是金刚石最基础的分类,成为了金刚石最为经典的分类法则,也变得更具有广泛的科学价值。
1.1 金刚石经典分类法对应的谱学依据
金刚石经典分类法是基于紫外可见光谱(主要是230~400 nm)和(近-中)红外光谱(主要是1 430~500 cm-1)进行的,最初的基本规则是:I型金刚石对300 nm以下的紫外光不透明,并且在1 430~500 cm-1范围内有强吸收表现[7];II型金刚石因对上述波段透明而被认为晶体“近乎完美”。如图1所示。
1.2 金刚石分类基本谱图的解释
能带理论是研究材料的一种量子力学模式,能较好地解释金刚石的呈色机理及金刚光泽产生的原因。根据能带理论,杂质元素浓度极低的金刚石带隙能量间隔(禁带阈)为5.47 eV。由光量子能量方程可换算得到金刚石禁带阈的光量子波长:
(1)
其中h为普朗克常数,v为某波长光量子的频率,即速度与波长的比值。2019年5月20日起正式生效的国际单位制千克定义为“普朗克常数为6.626 070 15×10-34J·s时的质量单位,J·s即相当于kg·m2/s”;同时生效的国际单位制电流的基本单位安培的定义为“将基本电荷e的量取固定数值1.602 176 634×10-19,以库仑(C)为单位”,即等于“安培·秒(A·s)”,所以能量电子伏特与焦耳的换算关系为“1 eV=1.602 176 634×10-19J”;而米的定义为“光在真空中行进1/299 792 458 s的距离”[8]。
由光量子能量方程可推得:杂质元素浓度极低的金刚石紫外可见光谱在227 nm处具有强吸收峰,这与实测谱图一致(见图1(b))。由于各光波长可见光透过金刚石几乎不被吸收(或只有均衡的弱吸收),因此金刚石呈无色透明状。
当金刚石中有较高(超过谱图识别限)浓度的氮元素时,由于氮原子外层电子比碳原子多一个,且氮作为非等价的原子无论以何种形式引发晶格缺陷,必将在禁带中生成至少一个杂质能级,由此缩小了带隙的能量间隔,电子从杂质能级跃迁到导带所吸收的能量约为4.59 eV(270 nm),但该能级并不恒定,最小仅为2.2 eV(564 nm),即引发紫外可见光谱中,560 nm至禁带阈(227 nm)产生吸收,由于可见光区紫、蓝、绿光被广泛吸收,金刚石会呈现不同饱和度的黄色。当金刚石中的氮原子发生聚集,单原子替位氮浓度降低,多数氮以聚集态形式存在时,金刚石的黄色饱和度减弱甚至呈无色透明,即透过金刚石的可见光各波长段几乎无吸收或吸收大致相当,所以金刚石可呈无色透明状。
同样可以是无色透明的金刚石,II型金刚石紫外可见光谱的吸收特征归属于金刚石禁带阈;而I型金刚石谱图的特征归属为金刚石禁带阈与氮元素引发的吸收。
对于无色样品,相比II型金刚石,只要在紫外230~300 nm范围强吸收的金刚石,均为I型金刚石。
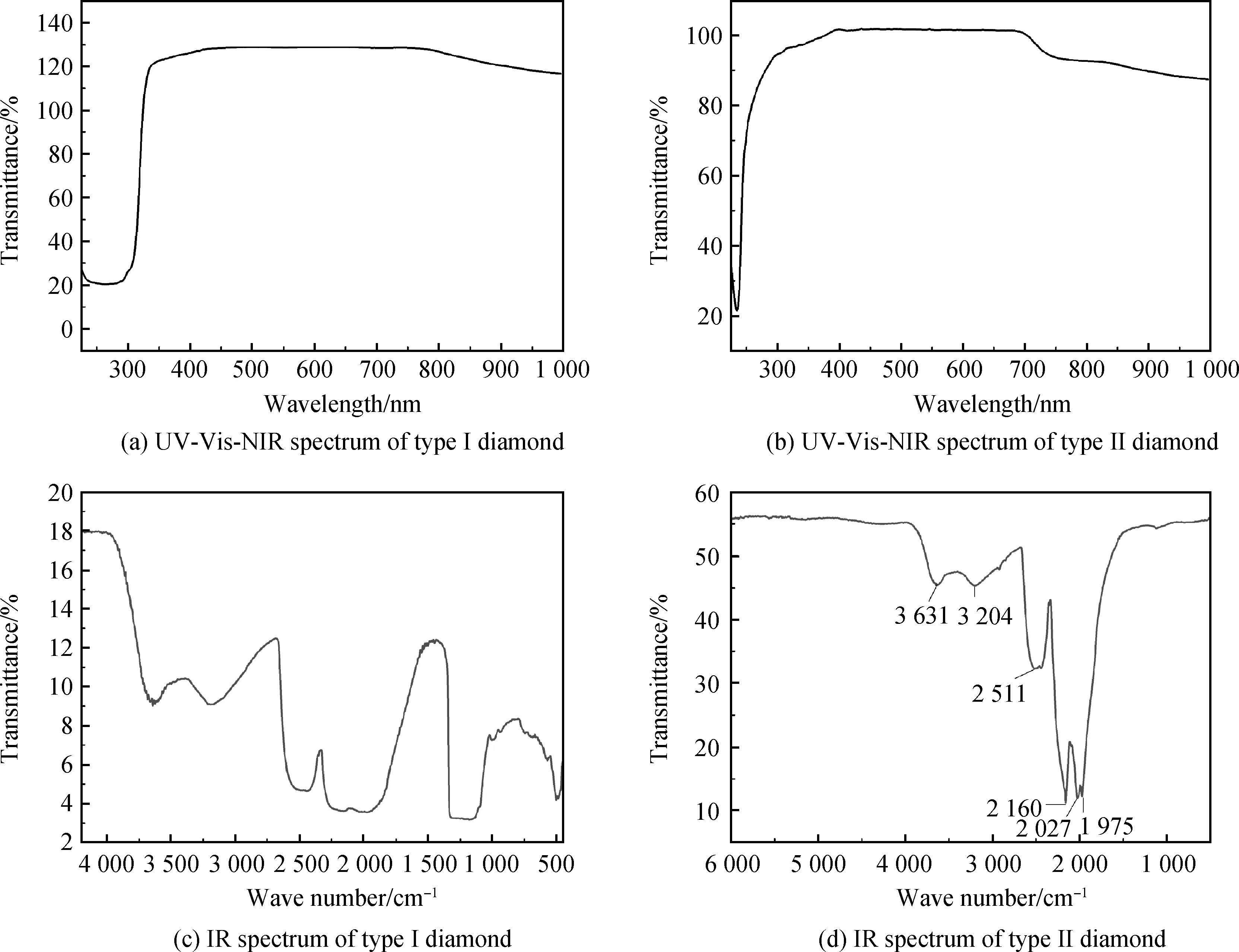
图1 I型、II型金刚石分类基本依据[5-7]
1.3 金刚石类型细分特征谱图
1944年著名科学家Raman先生(因拉曼效应发现获诺贝尔物理学奖)对几百粒金刚石的光学性质进行研究[7],以其为代表的前后诸多学者——如Nayar、anderson、Mitchell等[9-14]大量的研究得到了扩展,最终将金刚石类型分析深入到了红外光谱领域,包括Sutherland以及Blackwell等[15-16]在内的研究成果,成为了如今借助红外光谱确定金刚石类型的基础。而Dyar等[17]利用红外光谱区分开了含聚集态氮原子(Ia)和含孤氮(Ib)的金刚石;Custers也发现II型金刚石在实际中很罕见,并建议将其分为两类,IIa型和IIb型[18];进一步的研究表明硼是引发IIb型金刚石独特属性的杂质元素[19-20]。通过光谱呈现的这些金刚石类型的细分,如图2所示。
1.4 金刚石类型细分特征红外光谱图解释
由于金刚石分类中红外光谱的基础性作用,各个类型金刚石红外谱图特征已被认为得到了较为合理的解释,即IIa型金刚石氮、硼杂质元素含量均低于红外光谱检测限,其中红外光谱对氮杂质元素浓度的检测限低于0.001%(实际上UV-Vis谱对金刚石氮杂质的识别力远优于红外光谱);IIb型金刚石红外光谱呈现2 803 cm-1吸收峰,由不带电荷的替位硼原子(B0)引发,当B0浓度升高,原本外层为3个电子的硼原子成为半导体电荷受主(即B-)引发1 292 cm-1宽吸收带;自然界中碳放射性同位素的相对丰度最大的一种是碳14(14C),在金刚石形成过程中广泛存在于碳源特别是生物碳源中,这种碳同位素衰变结果是氮元素,由此引发自然界长期赋存的金刚石中,氮是最为常见的杂质元素,受温度(如地球内部1 700~2 100 ℃的环境)[21]压力条件的促使与地质年代的累积,氮元素在金刚石晶格中发生移动并聚集,形成多种形态的聚集体。因此地质年龄较年轻和/或氮原子浓度在较低范围时,氮原子以孤立形态替代金刚石晶格中的碳原子,即单原子替位氮(孤氮),形成的色心被称为C心,在红外光谱上的典型特征为1 131 cm-1或同时呈现1 344 cm-1吸收谱带;当两个相邻的氮原子取代金刚石中临近的两个碳原子而与其他氮原子不相邻时的氮杂质,被称为A类聚集态氮(或A心),红外光谱的具体表现为1 282 cm-1吸收谱带,以该吸收为典型红外光谱的金刚石被称为IaA型;当两个A类氮进一步聚集(大约2 400 ℃)受限于晶格空间以及电荷平衡,常常形成4个氮原子呈对称分布且围绕一个空位(4N+V)时,得到的氮聚集体被称为B聚集态氮(或B心),红外光谱的表现是1 175 cm-1吸收谱带,以该吸收为典型红外光谱的金刚石被称为IaB型[21];当金刚石中氮杂质进一步聚集形成亚显微包裹体(光学显微镜下无法识别而借助电子显微镜可识别的包裹体)氮晶体时,由于该类包裹体常沿特定面网[如(111)面]分布而呈二维延伸片状,被称为片晶氮,片晶氮的特征红外吸收最典型的谱带位于1 365~1 375 cm-1范围内,以此谱带为红外光谱重要特征的金刚石也被归为IaB型,为了与以1 175 cm-1红外吸收为典型的金刚石区分,含片晶氮(又叫B2心)的金刚石也被称呼为IaB2型;而对称4原子氮包围1个空位的构型被称为B1心,对应的金刚石被称为IaB1型。
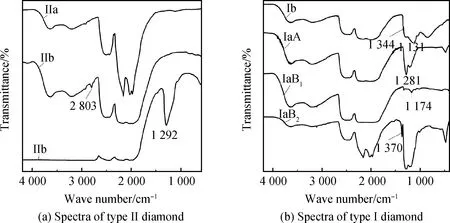
图2 红外光谱法对金刚石类型细分的关键特征
但是,还有一种聚集态氮的构型是不能遗漏的,因为在超过2/3的天然金刚石中,都会呈现出该构型引发的一些光学性质,即N3构型,由3个氮原子围绕一个空位(3N+V)构成。理论上来说,该晶格缺陷结构不会引发特征的红外光谱吸收,但是,无论金刚石是自然形成还是人工制造,不可能存在所有的氮全部以N3形态存在的情形,即:凡是含有N3结构的金刚石,总会伴有A心和/或B心的存在。
依据紫外可见近红外光谱及红外光谱(UV-Vis-MIR)特征对金刚石进行分类的方式如表1所示。
近几十年来,随着精细光谱技术的发展与成熟,成百上千个与氮元素相关的光谱学特征被测试识别到,众多学者也尝试解释这些光谱特征可能对应的结构构型(下文中将提到部分解释得到较为广泛认可的构型及谱学特征),但这些多种多样的氮原子在金刚石中的赋存方式,目前并没有纳入到金刚石类型划分体系中[22]。
综上所述,金刚石I、II型分级体系种类,是以紫外可见吸收光谱和红外光谱的表现而划分的。根据本文作者对诸多金刚石类型划分体系的阐述文献的理解,特别是对金刚石分类体系形成的历史进行梳理,认为单一的紫外可见光谱或红外光谱,均不能完成该分类体系的分类任务。无论天然还是人工合成的金刚石,有少部分样品,需要结合两种测试方法,才能将其准确归类。

表1 金刚石类型的分类
同时,综合上文氮、硼杂质元素形态特征,特别是电性特征(即最外层电子数为5的氮和最外层电子为3的硼常分别以N+和B-配对出现以达到电荷平衡),本文作者认为,传统文献中“IIa型金刚石不含氮、硼,II型金刚石不含氮,I型金刚石不含硼”的观点是基于紫外可见光谱和红外光谱的检测限做出的,而且是基于上述硼、氮元素结构构型的UV-Vis谱和IR谱的检测限而得到的限制性结论,换言之,IIa型金刚石的硼原子浓度、A心、B心、C心浓度均低于UV-Vis和IR检测限,但其他形态、构型的硼和/或氮杂质可能存在甚至有较高浓度;同样IIb型金刚石可能有较高浓度的氮杂质,而I型金刚石也可能有较高浓度的硼杂质,甚至有些I型金刚石硼杂质浓度可能高于部分IIb型金刚石的硼含量,或者有些IIb型金刚石的氮浓度可能高于部分Ia型金刚石的氮含量。
同样,一些传统文献中常常表达的“I型金刚石在1 400~1 000 cm-1之间有吸收,IIa型金刚石在1 400~1 000 cm-1之间无吸收”,可能会引起一定的误会,认为1 400~1 000 cm-1之间有吸收就是I型金刚石,通过系统梳理金刚石分类体系,可知前半句的逆命题并不是肯定的,即1 400~1 000 cm-1之间有吸收的金刚石不一定是I型的。
2 金刚石吸收光谱中其他常见的特征峰
2.1 393.6 nm(3.150 eV)吸收
被认为是由一个负价态电荷空位构成的结构缺陷(One negatively charged vacancy defect,V-),即ND1[23-24]。由辐照作用引发,常伴有420~450 nm间的吸收以及464.3 nm(TR13心,与TR12心相关的近距离振动模式色心)、469.9 nm(TR12心,一种固有辐照心)、594.2 nm、666.5 nm(见下文)、735.8 nm、741.2 nm辐照诱发的吸收。
空位是金刚石遭受足够能量的粒子辐照(轰击),使晶格中的某个碳原子永久性缺失而形成的。Ib型金刚石中空位主要呈负电态,引发零声子线(ZPL)位于3.150 eV的吸收带(ND1带)。
在“纯”(IIa型)的金刚石中空位主要呈电中性,引发零声子线在1.573 eV的GR1吸收带(见下文)。
2.2 415.3 nm(2.985 eV)吸收
如上文所述,由取代了碳原子的3个氮原子围绕一个空位(3N+V)构成的杂质缺陷,被称为N3心[24]。在自然产出的被称为“开普(Cape)”系列金刚石的谱图中常与N2心(477.2 nm,见下文)及几个其他相关谱带(465 nm、452 nm、435 nm及423 nm)同时出现。这些缺陷一般都是先天条件(金刚石被开采前经历的所有地质条件)形成的,氮浓度较高的人工生长晶体经后期改性可产生较低浓度的N3心。
2.3 478 nm(2.598 eV)吸收
被称为N2吸收,与N3相关的吸收,理论位于2.598 eV(477.2 nm)处,光谱仪检测实际常标至478 nm处。该N2与A心不同,A心的双原子替位氮与其他氮原子不相邻。而引发478 nm吸收的结构实际是属于(3N+V)构型中的两个氮原子[25-26],所以说是与N3心相关的杂质缺陷。
2.4 496.2 nm(2.498 eV) 吸收
由被两个空位分离的4个替位N原子构成(4N+2V,由4个替位氮原子围绕两个空位)的杂质缺陷[27-28]。当空位在金刚石晶格中迁移遇见一个B类N杂质聚集体(B1心)时与之合体而形成,常被称为H4缺陷(H4 defects),常温发光光谱中的H4心表现为512 nm峰,是自然环境中形成或由辐照后退火引起的。
2.5 503.3 nm(2.463 eV)吸收
由空位分离两个N原子[即(N-V-N)0]构成的一种不带电荷的杂质缺陷。与H2心(见下文)密切相关。被称为H3缺陷。自然环境中形成或辐照后退火或由高温高压处理引发[22,29]。
2.6 503.6 nm(2.462 eV)吸收
被认为是跟金刚石晶格中的独立填隙(interstitial)碳原子有关的缺陷,称为3H缺陷(3H defects),因辐照损伤而生[29],常伴GR1(见下文)出现。极少情况下,3H吸收很强,以至于可以改善由GR1吸收形成的绿色。
2.7 575 nm(2.156 eV)及相关谱带
由单个替位氮原子络合(挨着)一个空位构成的电态中性杂质缺陷,即NV0缺陷(NV0defects),与637 nm(见下文)缺陷相结合呈现[22,29]。可形成于自然环境,也可通过辐照后退火热处理诱发。可引发金刚石呈灰粉色;在绝大多数经人工改性呈粉色的金刚石中引发粉色,但少数天然致粉金刚石也是NV0心致色。
2.8 637 nm(1.945 eV)及相关谱带
由孤立的替位N原子络合(挨着)一个空位构成的带负电荷的杂质缺陷,即NV-缺陷(NV-defects),与NV0缺陷相结合呈现[22,29]。可在自然环境中形成,也可由辐照后退火热处理或经高温高压处理诱发。可促使金刚石呈现灰粉色~粉色,故在绝大多数人工改性呈粉色金刚石和少数天然致色金刚石中作为粉色致色因子。
2.9 666.5 nm(1.86 eV)吸收
为电中性的晶体自填隙缺陷,即I0缺陷(I0defect)。与该缺陷相关的吸收还与叠加在GR1吸收带上的735.8 nm(1.685 eV)吸收带相关[30]。与辐照有关,而666.5 nm(1.86 eV)经过420~540 ℃退火即可消除,故经HPHT处理也消除。对金刚石呈现绿色、绿蓝色有贡献。
2.10 737 nm(1.673 eV)吸收
由替位硅连结(两个)空位构成的带负电荷的杂质型缺陷,常用(Si-V)-或(V-Si-V)-表达,也叫Si-V心(Si-V centers)。高分辨光谱测试可分裂呈现736.6 nm、736.9 nm双峰。在天然形成或人工晶体生长(如化学气相沉淀法生长)过程中形成,与晶体生长过程及自然环境晶体生成后所处环境中的硅有关[25,31-32]。
2.11 741 nm(1.573 eV)吸收
该吸收由金刚石晶格中一种不带电荷的单独空位(V0)引发。该缺陷被称为GR1心(GR1 centers),也可引起744.6 nm (1.665 eV)处及相关谱带从而呈双线吸收。尽管它处的位置超出了可见光的频率范围(~400至700 nm),但GR1引起的相关强吸收谱带位于红光区的末端从而可产生绿色或蓝色。与3H缺陷一样常在一些经过天然或人工辐照呈现绿色的金刚石谱图中显现[29],是绿色金刚石的重要致色因素之一。GR1心是由辐照轰击产生的空位,在纯(IIa型)的金刚石中空位主要呈电中性,引发零声子线在1.573 eV的GR1吸收带。辐照轰击产生的空位,必然关联多余的碳原子形成自型填隙原子,从而形成自填隙缺陷,由此与上文中的735.8 nm吸收带关联起来。
2.12 883 nm(1.40 eV)吸收
被认为是与金刚石{111}生长相关[33]以及多个尚不确定机理的与镍相关的杂质缺陷引发[34]。其中相关研究的导出结果表明,1.40 eV心所指示的很可能是带一个正电荷的填隙镍原子,即Ni+。空间群模型计算也表明Ni+是解释对称性和相关电态的结论之一。同时推算出1.883 eV吸收系的单向应力测量值,认为这一吸收带的出现归因于一种镍-氮配位结构。
借助高分辨发射光谱可确定确切峰为883.0 nm/884.7 nm双峰。高分辨低温UV-Vis谱呈现在350~370 nm(357.0 nm、360.2 nm、363.5 nm、367.0 nm)和460~480 nm(468.0 nm、473.3 nm、477.4 nm)之间的吸收,以及516.1 nm和以1.40 eV心(接近884 nm处,尚未研究透彻是否为零声子双线)的强吸收并关联大约685 nm的吸收带,其中883 nm、685 nm吸收很可能由带正电荷的镍填隙原子(Ni+)引发;另外位于793 nm的吸收尖峰已确定是镍相关的缺陷;685 nm吸收带强而宽,从585 nm延续到大约735 nm处,极大地阻碍红光和橙色光的透过。大约555 nm开始向高能区(短波区)吸收增强(上述短波区的吸收),可见光范围两端吸收导致在555~585 nm之间形成透射窗,引发金刚石呈黄色、绿黄色。常在使用金属镍作为触媒(催化剂熔剂)的HPHT生长金刚石中出现,也可在天然变色龙金刚石(因光或热致可逆变色的一种金刚石)或天然绿黄色金刚石中见到,偶尔在天然无色近无色金刚石中检测到。
2.13 986 nm(1.256 eV)吸收
由空位分离两个氮原子构成的一种带负电荷的[即(N-V-N)-]杂质缺陷引起的吸收。该结构模型被称为H2心,与H3心密切相关,常被认为是Ia型金刚石经过HPHT处理的证据[29]。偶尔情况下,H2(及相关的宽大吸收带)可能非常强,会导致H3和H2心合并致色产生浓烈的绿色体色。在近红外光谱仪上表现为10 125 cm-1左右的吸收谱带。可在自然环境中产生,也可经辐照后低温退火或经高温高压处理诱发。
2.14 5 171 cm-1(0.640 8 eV)即1 934 nm吸收
被认为是与B心氮(集合体氮)有关的缺陷引起的吸收,被称为H1c心(H1c centers),但确切的结构模型尚需进一步研究[22,29]。可在自然环境中形成,也可由辐照后退火热处理产生。借助红外光谱仪较易识别到。
2.15 4 941 cm-1 (0.612 eV)即2 024 nm吸收
被认为与A心氮(双原子氮)有关的缺陷引起的吸收,被称为H1b心(H1b centers),但确切的结构模型尚需进一步研究[22,29]。可在自然环境中形成,也可由辐照后退火热处理产生。借助红外光谱仪较易识别到。
2.16 3 400~2 800 cm-1内多个吸收尖峰
与氢元素相关的多个缺陷模型引起的吸收,有的结构模型已得到较为合理的解释。如图3所示,该系列特征吸收以3 400~2 800 cm-1内多个吸收尖峰为典型[24-25,35],常见的组合有:(1)3 123 cm-1、3 031 cm-1、2 948 cm-1、2 937 cm-1、2 901 cm-1、2 870 cm-1、2 812 cm-1,被认为与低压高温(LPHT)改性有关,其中仅出现在CVD生长金刚石中的3 123 cm-1可能与NVH0结构(0.387 eV,3 202 nm)有关,且经HPHT处理后会消失。而1 600 ℃ 退火后尚保持的2 902 cm-1和2 871 cm-1峰经2 300 ℃退火后会位移到 2 907 cm-1和 2 873 cm-1[22,29]。2 901 cm-1、2 870 cm-1和2 812 cm-1的位移与退火过程的压力也有相关性,同样退火温度是1 600 ℃时,经历7 GPa的压力后这三个峰在2 902 cm-1、2 871 cm-1和2 819 cm-1处,而在常压条件下退火这三个峰出现的位置是2 900 cm-1、2 868 cm-1和2 813 cm-1。(2)以3 107 cm-1(0.385 eV,3 220 nm, 即N3VH结构)为典型的一组尖峰,包括3 309 cm-1、3 236 cm-1、3 188 cm-1、3 169 cm-1、3 153 cm-1、3 143 cm-1、3 121 cm-1、3 107 cm-1、3 092 cm-1、3 080 cm-1、3 049 cm-1、3 009 cm-1、2 978 cm-1、2 855 cm-1、2 812 cm-1、2 785 cm-1,甚至还包括4 495 cm-1、4 167 cm-1和1 405 cm-1尖峰,以最强的3 107 cm-1吸收为典型,且常伴有1 405 cm-1峰[25]。
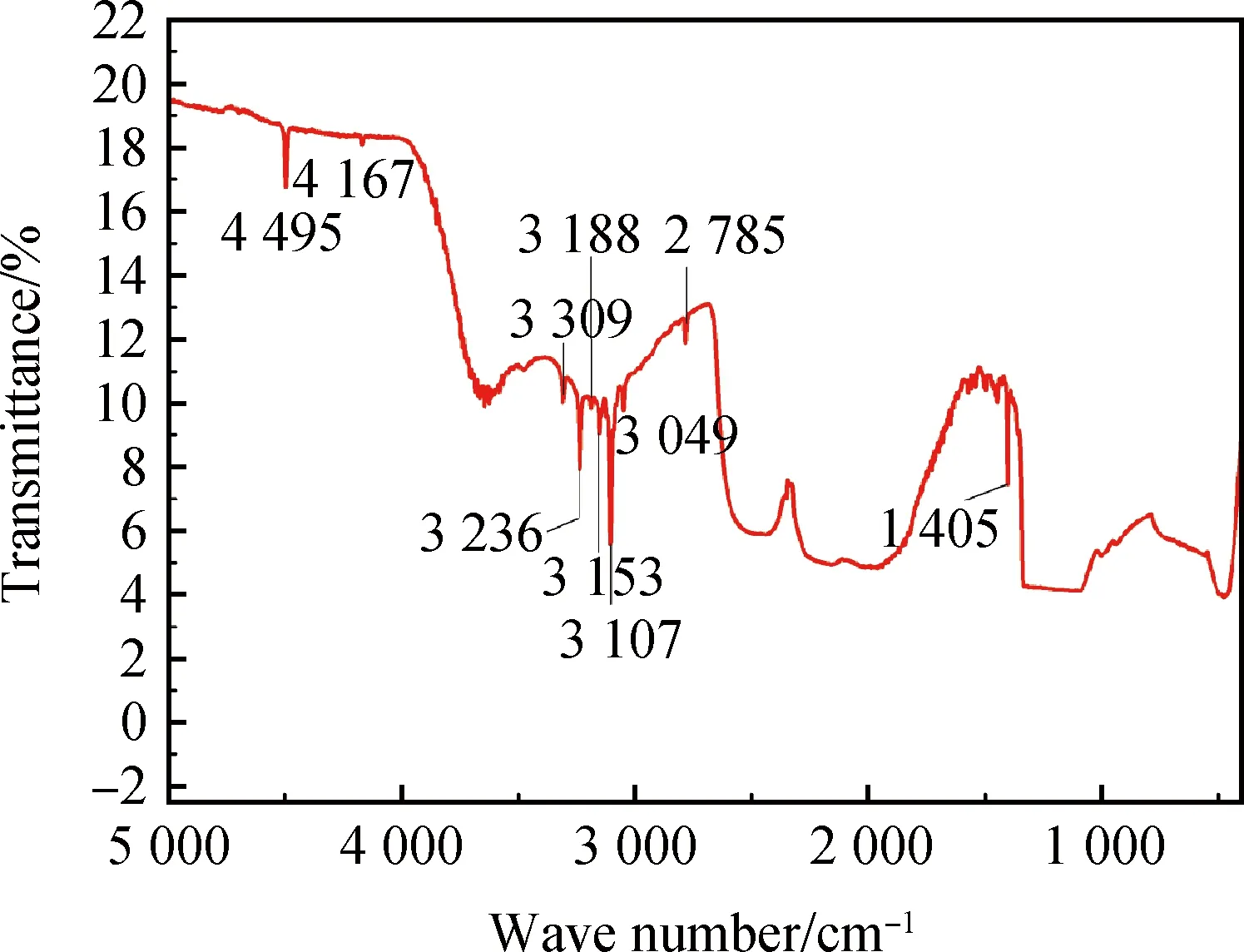
图3 富氢天然金刚石红外光谱示例
组合(1)常为化学气相沉淀法晶体生长过程形成,或晶体生成后再处理呈现;组合(2)常为天然成因金刚石含氢或天然金刚石在富氢环境下改性后的谱图呈现;呈现组合(1)吸收的样品经特殊环境下高温高压处理后可消除组合(1)吸收特征而呈现3 107 cm-1典型的吸收。
2.17 1 450 cm-1(0.180 eV) 即6 888 nm吸收
被认为是与填隙氮有关的缺陷引起的吸收,被称为H1a心(H1a centers),但确切的结构模型尚需进一步研究[22,29]。可在自然环境中形成,也可由辐照后退火热处理产生。
3 结语与展望
近百年来,科学家对天然和合成金刚石中的各种晶格缺陷所进行的大量实验和理论研究已经逐步得出了一些看似合理的模型来说明金刚石的谱学特征。就杂质元素而言,关于氢、硼、氮、氧(本文未涉及)、硅、镍在晶体中的赋存形式以及对晶格的影响有了较为深入的研究,并有了一些较为合理的学说,特别是对硼、氮元素的研究较为成熟,不但以其为基础构建了金刚石类型划分体系,对两类元素的去除与掺杂,已经较为成功地应用到了人工金刚石产品生长中,这是人类研究金刚石谱学特征、晶格缺陷、弄清金刚石微观结构模型的重要目的之一。本文虽然罗列了大量的谱学特征,并汇总了前人对这些特征相对合理的解释,但这不是研究的最终结果,随着研究的深入,可能会有颠覆性的观点出现,完全可能重新构建理论模型。比此更为艰巨的任务是,测试人员已经从各类金刚石中检测到了数千个谱学细节,今后研究的重点是更好地弄清楚每个谱学细节对应的结构模型,为金刚石开发新的应用领域提供理论基础。
