DMF体系中Cu2O球晶的制备及形貌分析
2021-02-23饶盛源邱志惠徐金燕阮青锋
饶盛源,邱志惠,徐金燕,徐 鑫,张 琦,隆 颖,阮青锋
(1.广西师范大学化学与药学学院,桂林 541004;2.桂林理工大学地球科学学院,桂林 541006)
0 引 言
晶体的形态大小对其物理和化学性质产生很大的影响,可控制备具有特定形貌的半导体纳米材料是现代纳米科学和纳米技术的一个重要研究方向[1]。人们探索发现了多种纳米材料的制备方法,并通过调整实验条件来控制微纳米材料的尺寸和形貌。晶体在热力学平衡条件下形成时,晶体显露的晶面由其自身的表面能所确定。因此,通过选择不同的表面活性剂来调控不同晶面的生长速率,有望获得形貌各异的晶体。
氧化亚铜(Cu2O)作为一种非化学计量缺陷的p型半导体[2-3](直接带隙约2.17 eV),具有独特的光学性能和磁性,被广泛应用于太阳能转换[4-5]、电池电极材料[6]、生物传感器[7]、磁存储器[8]和气体传感器[9]等领域,引起科研人员的广泛兴趣。不同形貌的Cu2O具有不同的物理化学性质,应用前景不同。因此,各种 形貌结构的Cu2O纳米材料的制备受到广泛关注。
前人通过大量研究,尝试用葡萄糖、盐酸羟胺、苹果酸等材料作为还原剂,以十二烷基硫酸钠(SDS)、聚乙烯吡咯烷酮(PVP)、十六烷基三甲基溴化铵(CTAB)、油酸等作为表面活性剂或形貌控制剂来调控Cu2O的形貌,已经合成了微纳米级的立方体[10-11]、八面体[12]、菱形十二面体、菱形十二面体和八面体的聚形[13]、多孔八面体[14]等多面角的晶体形态,甚至球形[15]和薄膜[16-17]等不同形态的Cu2O也被成功制备出来。不同的还原剂、表面活性剂或它们的组合不同,可以获得不同形貌和大小的Cu2O晶体或它们的集合体形态[14-15],甚至制备的方法不同,也可以获得形貌不同的Cu2O[16-18]。
前人的研究大多是在强碱性溶剂中使用不同的还原剂和形貌控制剂来获得不同形貌的Cu2O晶体,由于强碱与还原剂的配比难以把握,有时会出现氧化铜或铜单质[16]等杂质相。N,N-二甲基甲酰胺(DMF)是一种无色透明液体,能和水及大部分有机溶剂互溶,是化学反应的常用溶剂,在高温条件下水解产生二甲胺与甲酸,具有一定的还原性和形貌控制作用[19]。本次研究以DMF为溶剂和还原剂制备出了形貌新颖的三维十字形Cu2O球晶和空心Cu2O球晶,并通过调整DMF的用量、DMF与SDS、PVP、CTAB等形貌控制剂的配比,分析和探讨了工艺条件对Cu2O球晶形貌的影响。
1 实 验
1.1 实验试剂
实验所用的化学试剂均为市售产品,没有经过进一步的加工与提纯。主要化学试剂包括三水合硝酸铜(Cu(NO3)2·3H2O)、一水合醋酸铜(Cu(Ac)2·H2O)、N,N-二甲基甲酰胺(DMF)、十二烷基硫酸钠(SDS)、十六烷基三甲基溴化铵(CTAB)、聚乙烯吡咯烷酮(PVP),使用去离子水配制溶液,所有的洗涤亦是用去离子水。
1.2 氧化亚铜的合成及工艺参数
分别采用三水合硝酸铜和一水合醋酸铜作为铜源,DMF为溶剂和还原剂,制备Cu2O的典型过程如下:分别将2 mmol Cu(NO3)2·3H2O和12 mL DMF加入洁净的烧杯中,在超声波清洗器中超声振动10 min,使固体样品完全溶解于DMF溶剂中,将得到的混合液转移至容积为25 mL的聚四氟乙烯内胆中,盖好内胆并将其装入高压反应釜中,密封好高压反应釜并将其放入恒温箱,在140 ℃的恒温条件下反应一定时间后自然冷却至室温,取出高压反应釜中的聚四氟乙烯内胆,分别用去离子水和无水乙醇反复冲洗反应产物,直至溶液呈中性。将固体产物放置到60 ℃的干燥箱中,恒温8 h后收集干燥保存。不同形态Cu2O球晶的制备条件如表1所示。

表1 氧化亚铜的制备工艺条件
1.3 合成晶体的表征
产物的表征均在广西师范大学省部共建药用资源化学与药物分子工程国家重点实验室完成。其中,物相分析采用日本Rigaku公司生产的D/Max-3c型X射线粉末衍射仪,Cu靶,镍滤玻片,电压40 kV,电流40 mA,θ/2θ扫描,扫描范围为10°~80°。晶体形貌的观察、粒度大小和分散性测试分析采用FEI Quanta200型扫描电镜,为更好地观察样品的形貌特征,在样品表面喷镀了几十纳米厚的金膜。
2 结果与讨论
2.1 合成晶体的物相特征
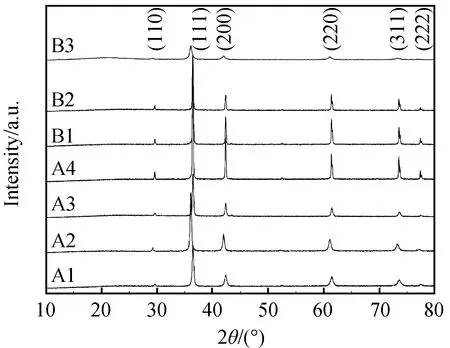
图1 合成晶体的XRD图谱

2.2 合成晶体的形貌特征
2.2.1 无表面活性剂时Cu2O球晶的形貌特征
以DMF为溶剂,140 ℃下恒温24 h,获得了4种不同形貌的Cu2O晶体聚集体(见图2)。Cu(NO3)2·3H2O为铜源时,随着DMF用量的增大,Cu2O晶体聚集体的形貌发生了三维十字形球晶→十字纹球晶→荔枝状球晶的变化。DMF的用量为6 mL时,产物主要是直径7~10 μm的三维十字形球晶,六个分支两两相互垂直,每个分支沿Cu2O晶体的[100]方向由球晶中心向外呈放射状,分支表面是一些类似八面体的晶粒(见图2(a))。DMF的用量增大到8 mL时,产物为直径8~12 μm的十字纹球晶(见图2(b)),球晶由八个分支相互接触而成,相邻四个分支间形成向内凹的十字纹,四个分支均匀分布在十字沟的周围,呈现出四次对称的特点,分支表面是粒径0.2~0.3 μm、晶面略呈曲面的八面体;在产物中发现一些尺寸较小的八足枝状晶体(见图2(c)),足的延伸方向与十字纹球晶的分支相对应,为Cu2O晶体的三次对称轴方向,推测为十字纹球晶的雏形。当DMF的用量增大至12 mL时,产物为直径10~12 μm的实心Cu2O球晶(荔枝状球晶),表面凸起的锥体为多种单形晶体的聚形(见图2(d))。更换铜源为Cu(Ac)2·H2O时,DMF的用量为12 mL,其他条件不变,所得产物为直径约14 μm的球体,表面晶粒为晶面平整的截角立方体,立方体的一个四次轴平行于球体的半径(见图2(e)),产物中破碎的球晶显示出该体系中形成的球晶为有较厚球壳的空心球体,且Cu2O晶粒沿球体半径呈放射状分布(见图2(f))。
2.2.2 添加表面活性剂时Cu2O球晶的形貌特征
在Cu(NO3)2·3H2O为铜源,12 mL DMF作溶剂的反应体系中分别添加不同量的SDS、CTAB以及PVP等表面活性剂,产物的形貌出现了明显的变化(见图3)。当体系中添加1 g的SDS时,产物为直径约17 μm的Cu2O球晶,球晶的表面随机分布着大小不一的菱形十二面体Cu2O晶体,从破损的球晶不难看出,添加SDS后形成的Cu2O球晶为球壁较薄的空心球晶(见图3(a))。当体系中添加1 g的CTAB时,所得Cu2O球晶的直径明显变小,多数球晶的直径只有5 μm左右,由立方体的Cu2O晶体相互穿插而成(见图3(b))。体系中添加1 g的PVP时,产物中除了Cu2O球晶还有铜的晶体,逐步减少PVP的用量,直到PVP的用量为0.2 g时,才获得直径约15 μm的单一相Cu2O球晶(见图3(c)),表面晶粒为立方体,晶粒的横截面大小不一,较小的只有0.3 μm,而较大的可达2.5 μm,且晶粒的一个四次轴平行于球晶的半径。
2.3 工艺条件对Cu2O球晶形貌的影响
Cu2O晶体属于立方晶系,不同单形晶面的表面自由能(γ)大小依次为:γ{111}<γ{100}<γ{110}<γ{hkl}[1]。根据Gibbs-Wulff原理,平衡时的晶体总是趋向于形成总表面能最小的晶体形貌,因此,平衡条件下形成的Cu2O晶体中比较容易出现的是八面体、立方体、菱形十二面体单形晶面,很多不同形貌的Cu2O多面体基本上都是这三种单形及它们的聚形[20]。而在非平衡条件下,晶体形态受环境因素的影响较大,溶液过饱和度低,体系中结晶质少,晶体的生长速率小,晶体形态主要受控于晶体的内部结构;溶液过饱和度高,体系中结晶质多,成核速率大,晶体生长处于非平衡状态,晶体及其集合体形态不易受晶体内部结构因素的控制。

图3 添加不同表面活性剂所得Cu2O球晶的SEM照片
2.3.1 DMF的用量对Cu2O球晶形貌的影响
DMF在高温条件下水解产生二甲胺和甲酸[19],在DMF与Cu(NO3)2·3H2O组成的反应体系中,随着DMF用量由6 mL逐渐增加到12 mL,溶液中的二甲胺和甲酸不断增加,体系的还原能力逐渐增强,Cu+的生成速率增大,溶液中结晶质增多,过饱和度增大,晶体成核的速率不断增大。Cu2O晶体聚集体的形态由三维十字球晶→十字纹球晶→荔枝状球晶的变化(见图2),显示Cu2O球晶形貌从具有各向异性与对称性的球晶→各向异性与对称性变弱的球晶→无各向异性的球晶的变化趋势。DMF为6 mL时,体系的还原能力相对较弱,被还原出来的Cu+少,体系中结晶质少,溶液的过饱和度低,晶体是在近平衡条件下生长形成的,其形态和集合形态容易受晶体内部结构因素控制,形成对称性与晶体点群m3m相一致的球晶。DMF的用量逐渐增大,体系中被还原出来的Cu+多,结晶质增多,溶液的过饱和度增大,晶体生长逐渐远离平衡状态,晶体形态及其集合形态不容易受晶体内部结构因素的控制,为了降低反应体系的表面能,晶体趋向于聚集形成各向同性的荔枝状球晶[21]。Cu2O实心球晶的形成及演变详细过程如图4所示。
2.3.2 铜源对与Cu2O球晶形貌的影响

在硝酸铜为铜源的体系中,主要是DMF的还原作用和对形貌的控制作用为主,形成球晶的Cu2O晶粒以八面体为主。而醋酸铜为铜源时,醋酸根水解形成弱醋酸溶液,在弱醋酸溶液中Cu2O晶体主要单形晶面的稳定性遵循{100}>> {111}> {110}的顺序[23],因此,在该体系中常呈现以立方体为主的Cu2O晶体(见图2(e))。
在溶液体系中,Cu(Ac)2·H2O水解生成的羧基与DMF中具有强吸电子能力的甲酰基在高温下发生脱羧反应产生CO2气体,CO2在溶液中形成气泡。体系中被还原出的Cu+被吸附到CO2气泡上成核和生长,聚集形成球形。为了降低球形聚集体的表面能,Cu2O晶粒的一个四次轴始终平行于球体的半径,小晶粒由内而外紧密叠合,最终形成表面被截角立方体晶粒覆盖的空心球晶(见图2(e),(f))。
2.3.3 表面活性剂对Cu2O球晶形貌的影响
在DMF和Cu(NO3)2·3H2O组成的反应体系中分别添加SDS、CTAB和PVP等不同的表面活性剂,组成球晶的小晶粒变大了,晶粒的形态也更规则,如球晶表面的菱形十二面体(见图3(a))、立方体(见图3(b),3(c))晶形,说明表面活性剂具有降低溶液过饱和度、增加结晶质表面扩散的能力。因此,Cu2O晶粒的形态更多的受其晶体结构的控制,形成具有规则的形态。
由于不同表面活性剂的性质不同,对Cu2O晶体及其集合体形态的控制能力不同。SDS离解后带负电,对Cu2O不同面网的吸附能力不同[24],因此,常用于Cu2O的制备与形貌调控。Cu2O{111}和{110}面网中均存在带悬空键的Cu+,且{110}面网中Cu+的密度大约是{111}面网的1.5倍[25],将有更多的SDS吸附在{110}面网上,减缓Cu2O晶粒沿[110]方向的生长,有助于{110}晶面的显露,形成菱形十二面体晶形(见图3(a))。同时,在温度和压力的作用下,具有较强发泡作用的SDS在高压反应釜内溶液对流的作用下不断产生气泡[26],被还原出的Cu+被吸附到气泡表面成核并不断生长聚集,最终形成空心球体(见图5)。
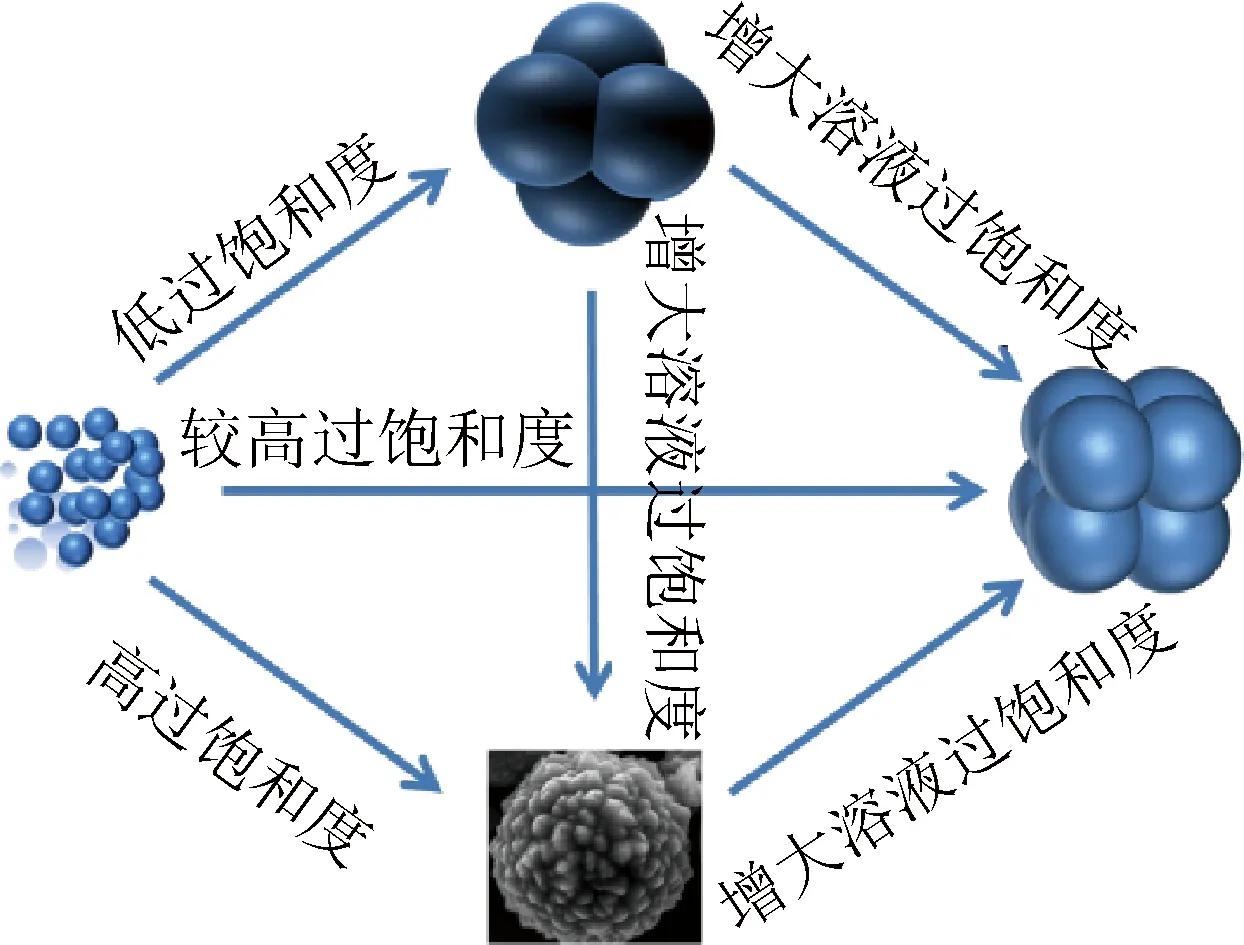
图4 Cu2O实心球晶形成及演变过程示意图
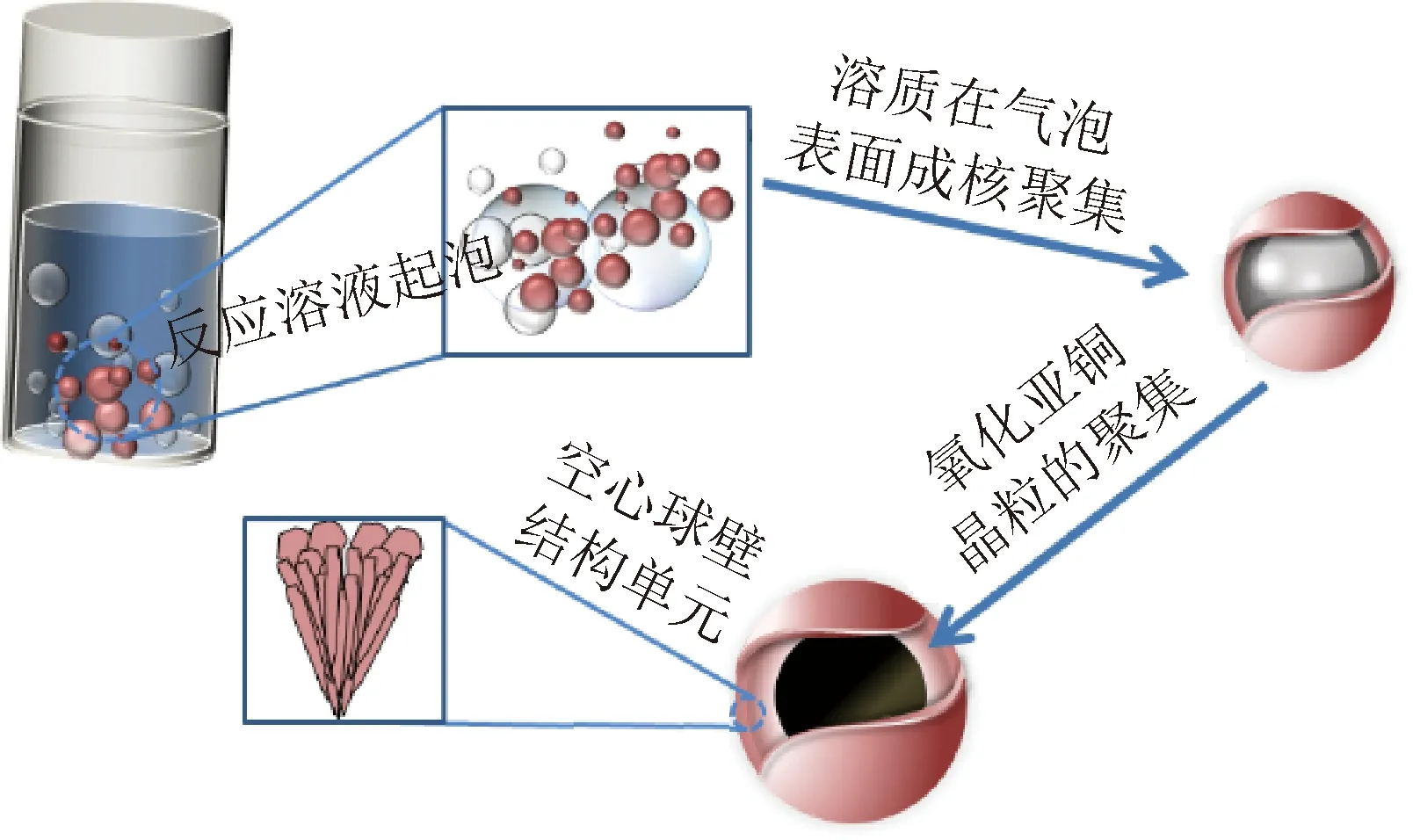
图5 Cu2O空心球晶形成过程示意图
CTAB作为阳离子表面活性剂,对Cu2O晶体中带正电的{111}面网和{110}面网有排斥作用[1],CTAB优先吸附在{100}面网上,减缓了Cu2O沿[100]方向的生长速率,有助于形成立方体晶形。因此,在球状晶体集合体的表面多为立方体晶粒(见图3(b))。
作为一种封端聚合物,PVP的氧原子与Cu2O{100}面之间存在较强的相互作用,从而稳定{100}面,诱导单晶微纳米立方体Cu2O的形成[27],尤其在低浓度PVP的溶液体系中更有利于{100}面的显露[28],本次实验所添加的PVP只有0.2 g,浓度不足0.1 mmol,这可能是球晶表面为立方体Cu2O晶粒的主要原因。
综上所述,表面活性剂的性质不同,与Cu2O不同面网的作用方式不同,对Cu2O晶粒的形貌及其聚集体形貌产生的影响也不同。选择合适的表面活性剂不仅能够降低Cu2O特定晶面的表面能,获得形貌可控的单晶体,而且可以调控Cu2O聚集体的形貌,从而获得特定形貌、尺寸均一且分散性好的Cu2O晶体聚集体。
3 结 论
(1)在DMF溶剂热体系中还原Cu2+得到微纳米级具有各向异性与对称性的三维十字形Cu2O球晶、各向异性减弱了的十字纹球晶、各向同性的荔枝状球晶及其他不同形貌的空心球晶。随着DMF用量的增加,体系的还原能力增强,Cu+的数量增多,溶液的过饱和度增大,Cu2O晶体集合体形态逐步由晶体内部结构因素控制的各向异性形貌逐渐过渡到不易受结构控制的各向同性形貌为主。
(2)表面活性剂的添加有效降低了溶液的过饱和度,增加了结晶质的表面扩散能力,促使Cu2O形成与其晶体对称性相一致的规则形态,但SDS、CTAB、PVP等表面活性剂与Cu2O不同面网的作用方式和强度不同,从而形成菱形十二面体、立方体等不同的形态。
(3)反应体系中,Cu(Ac)2·H2O水解生成的羧基与DMF中的甲酰基在高温下发生脱羧反应产生CO2气体,SDS发泡作用产生的气体有利于形成空心球晶。
