彩色多普勒超声在非哺乳期乳腺炎及DCIS、IDC 的鉴别诊断要点分析
2021-02-23于伟伟
于伟伟
(河南省安阳市妇幼保健院乳腺科,河南 安阳 455000)
相较于有明显发病时间段的哺乳期乳腺炎而言,人们对于非哺乳期乳腺炎(NLM)的认知较少,同时NLM 作为乳腺良性病变临床表现仍以乳腺肿块、乳腺疼痛、红肿、溢液等症状为主,缺乏疾病相应的典型症状,因大部分NLM 患者可自行触及乳腺肿块,因此常与乳腺肿瘤相混淆;浸润性导管癌(IDC)是常见的乳腺癌类型,肿瘤细胞侵袭能力强、患者预后差[1];临床将乳腺导管原位癌(DCIS)作为乳腺癌的早期阶段,此时癌细胞尚未突破基底膜,乳腺间质未被侵犯,患者预后良好[2],因此有效鉴别诊断NLM、DCIS、IDC 利于疾病的确诊及后续治疗方案的拟定。彩色多普勒超声是乳腺疾病最为主要的影像学检查方法之一,本文以回顾性研究方式分析超声检查在NLM、DCIS、IDC 诊断中的差别与相似点,现报告如下。
1 资料与方法
1.1 一般资料:收集2018 年3 月至2020 年4 月于本院诊断并接受治疗的40 例NLM 患者、30 例DCIS 患者、20 例IDC 患者为研究对象,对其相关诊治资料进行回顾性分析。所有患者年龄18~78 岁,平均(48.72±6.16)岁,其中NLM 组病灶65 处,年龄18~45(33.52±5.23)岁;DCIS 组病灶34 个,年龄28~67(46.36±4.15)岁;DCIS 组病灶28 个,年龄37~78(48.33±5.24)岁。
1.2 方法:采用彩色多普勒超声诊断仪,选择7~14MHz 线阵探头,患者取仰卧位,上臂外展,以乳头为中心进行双乳扫查。
1.3 观察指标:比较一般情况,包括年龄、病灶最大直径及病灶分布位置;超声指标选择边界情况、纵横比、回声情况、内部回声区、钙化灶、边缘、肿块形态、腋窝淋巴结情况、血流分级。其中参照Adler分级法进行血流分级[3],包括血流不丰富(0~Ⅰ级)、血流丰富(Ⅱ~Ⅲ级),0 级(检测位置未见血流信号)、Ⅰ级(有1 至2 个短棒状、点状血流)、Ⅱ级(有1 个较长血管或3 至4 个点状血管,最长血管长度与肿块半径相接近或超过)、Ⅲ级(点状血管出现5个以上或较长血管2 个以上)。
1.4 统计学分析:运用SPSS 22.0 软件处理数据,计量资料采用t 检验,计数资料采用卡方检验,P<0.05 为差异有统计学意义。
2 结果
2.1 三组患者基本情况比较:NLM 患者均龄明显小于乳腺癌患者,且最大病灶直径大于DCIS 及IDC 患者,差异均统计学差异(P<0.05);所纳入的NLM 患者及乳腺癌(类型包括DCIS、IDC)患者的病灶多位于乳腺外周位置(P<0.05),IDC 组患者乳腺外周病灶分布例数明显多于NLM 组(P<0.05),详见表1。
表1 三组基本情况比较 (±s)
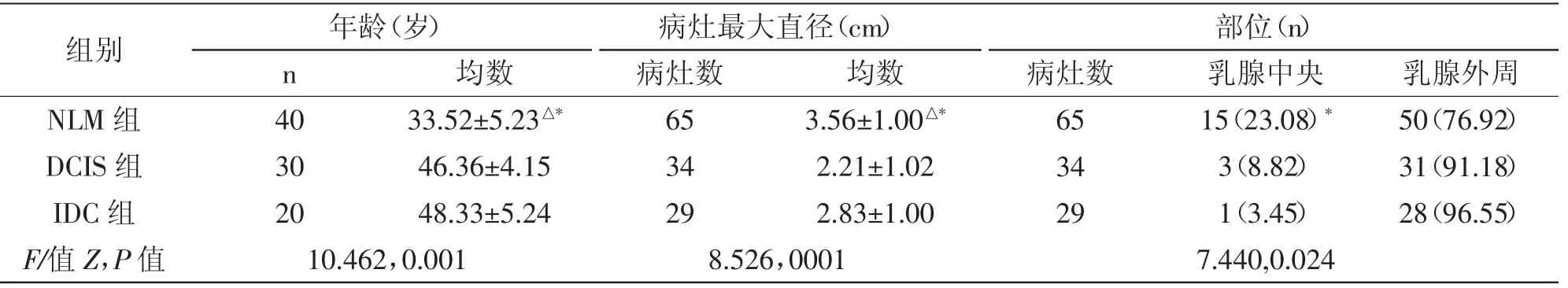
表1 三组基本情况比较 (±s)
注:同DCIS 比较,△P<0.05;同IDC 组比较,*P<0.05
组别 年龄(岁) 病灶最大直径(cm) 部位(n)n 均数 病灶数 均数 病灶数 乳腺中央 乳腺外周NLM 组 40 33.52±5.23△* 65 3.56±1.00△*DCIS 组 30 46.36±4.15 34 2.21±1.02 IDC 组 20 48.33±5.24 29 2.83±1.00 F/值Z,P 值 10.462,0.001 8.526,0001 65 34 29 15(23.08)*3(8.82)1(3.45)7.440,0.024 50(76.92)31(91.18)28(96.55)
2.2 各组超声声像图结果比较:NLM 超声声像图中的肿块形态、边界情况、肿块边缘状态、纵横比、钙化灶存在与否、肿块内部是否伴有无回声区及血流分级情况与乳腺癌声像图有较大区别,差异均具有统计学意义(P<0.05)。IDC 患者肿块形态不规则、边界不清、边缘毛刺样病例较NLM 多见(P<0.05);NLM 组检出钙化灶病例明显少于DCIS 组、IDC 组,而检出内部伴无回声区病例则显著多于DCIS 组、IDC 组,差异有统计学意义(P<0.05);IDC 组患者血流分级以Ⅱ~Ⅲ级为主,与NLM 组比较有统计学差异(P<0.05)。三组腋窝淋巴结情况及肿块内部回声均匀与否方面比较无统计学差异(P>0.05),详见表2。
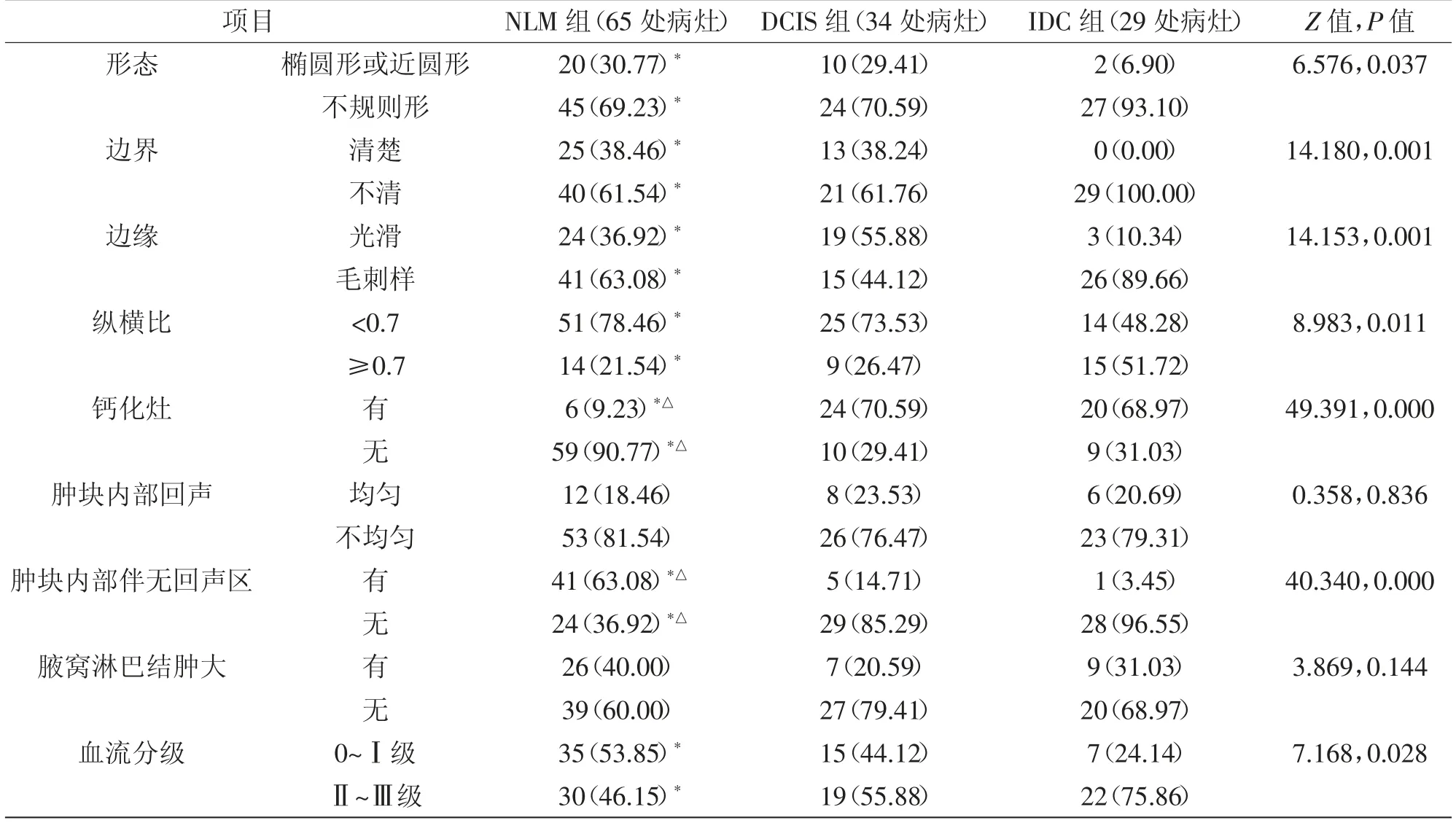
表2 各组声像图指标比较 [n(%)]
3 讨论
NLM 好发于育龄期妇女,而DCIS、IDC 乳腺癌患者均龄在46 岁左右,偏向于中老年人群。超声是各科室常用的辅助检查手段,乳腺疾病导致相应组织病理学改变决定了超声声像图特点,NLM 病灶呈局限性,声像图中显示为边界不清、内部回声不均匀的结节状低回声,肿块形态不规则且血流信号丰富,钙化灶少见可伴有无回声区,本研究中63.08%的NLM 患者超声检查显示存在无回声区,可能与乳腺炎症病灶内的乳腺导管发生扩张或者坏死组织、粒细胞在病灶内形成微脓腔有关[4]。乳腺肿瘤病例检出无回声区情况相对较少,但DCIS 组亦有5 例,发现此类病例的无回声区检出位置大部分为肿块周边,分析原因可能为乳腺肿块对乳腺导管形成压迫后致使导管周围出现局限性积液;IDC 组仅有1 例检出无回声区,笔者分析与肿瘤细胞快速生长繁殖后导致乳腺局部血流供应不足致使病灶内部组织液化有关[5]。此外有学者验证伴有脓肿形成的NLM病例中[6],相应的无回声区内可探及点状高回声,且密集分布、加压可推动,认为该类点状高回声与局部炎症进展至黏稠液化有直接关联,乳腺肿瘤病变者可无此类病例,本研究因样本量限制未采集到此类病例。高度分化的肿瘤病灶局部坏死后发生溶解,钙盐沉积后超声显示为集中的砂粒样强回声,一半以上的乳腺肿瘤病灶可检出钙化灶[7],而本研究6 例NLM 检出斑点状、条索状强回声,与钙化灶声像图基本一致,但形成原因有巨大差异:NLM 钙化灶由脓液浓缩后、已扩张导管腔内炎性分泌物聚集及胆固醇结晶析出所形成;70.59%的DCIS 患者、68.97%的IDC 患者存在钙化灶,其中IDC 钙化灶呈集中的簇状分布。
本文78.46%NLM 纵横比<0.7,炎症病灶生长特点为膨胀性,加之患者在出现自觉症状后就诊时肿块较大,因此大部分纵横比小于0.7;少数纵横比≥0.7 病例可能为病灶辐射至周围组织间隙(甚至脂肪层)后增大了前后径。IDC 特征性声像表现为边缘毛刺(或者蟹足),肿瘤细胞浸润性生长后,因局部渗出、组织水肿、结缔组织增生共同导致齿状致密影(根部粗、尖端细、基底窄)[8];NLM 组有41例肿块边缘呈毛刺样,但该组毛刺粗短、走形规则且基底部宽;44.12%的DCIS 出现毛刺,但因毛刺形成原因(导管增粗、扩张后延伸至腺体)中未涉及肿瘤细胞浸润,因此能清晰的显示导管。
综上所述,NLM、DCIS、IDC 的超声检查中可依据纵横比、边缘毛刺、形态、内部伴回声区、钙化灶、血流分级等项目进行鉴别诊断,再参考患者年龄、病灶大小及部位等信息,最大程度上提高超声对于乳腺疾病的诊断价值。
