小球藻与硝化细菌对食品厂污水中氨氮和总氮的去除研究
2021-02-23孙珮铭邱萌萌吴玉斌陆洪省
孙珮铭,邱萌萌,吴玉斌,陆洪省
(山东科技大学 化学与环境工程学院 山东 青岛 266590)
随着对环境保护要求的提高,我国对排放污水中氮污染物限值的要求也越来越严格。其中,传统的脱氮方法包括化学脱氮法、物理脱氮法和生物脱氮法[1]。近年来,生物脱氮法因其操作简便、低成本效益高的优点而被广泛应用于污水的脱氮处理[2]。最常见的生物过程包括硝化作用和反硝化作用,硝化作用是在好氧条件下,自养生物通过亚硝酸盐将铵盐氧化成硝酸与亚硝酸盐;反硝化作用是在厌氧条件下,反硝化细菌将亚硝酸盐与硝酸盐转化成氮气,从而达到去除水体中氮的目的[3]。具体的生物法污水脱氮处理工艺包括厌氧-缺氧-好氧(A/A/O)、氧化沟工艺、CAST工艺、3A-MBR工艺、A2O-MBR工艺、A2O/A-MBR工艺、A2O/A-MBR工艺、SBR工艺、BAF工艺等[1-3],其原理均为好氧条件下进行硝化反应,厌氧条件下进行反硝化脱氮反应,最终将污水中含氮化合物以氮气的形式从水中逸出,达到污水脱氮目的。在污水生物脱氮处理过程中,污水中生化需氧量(biochemical oxygen demand,BOD)、N、P的比例(质量比100∶5∶1)达到平衡是制约脱氮效果的关键因素,而在很多工业污水中,BOD/N/P均偏小,即污水中碳源不足,此种情况下,需补充额外碳源到污水中,才能获得理想的脱氮效果。常见的碳源有葡萄糖、醋酸钠、甲醇等,其中醋酸钠具有价格低、易溶解、易储存以及容易被细菌吸收的特点而被广泛应用,但污水中投加额外碳源又会导致污水处理成本的提高,因此寻找一种无需投加额外碳源的生物脱氮技术显得非常必要。
小球藻(chlorella)为绿藻门小球藻属普生性单细胞绿藻[4],可以生长在高氮的生活污水中[5],通过光合作用合成氮的有机物[6],对污水有很好的脱氮效果[7]。国内外在氮对小球藻生长的影响[8]、小球藻对不同氮源的吸收等方面均已有大量研究,包括对氨氮的吸收[9]、总氮的吸收[10]、硝态氮吸收和亚硝态氮吸收等[11]。研究[12]发现,提高无机氮浓度有利于蛋白核小球藻的生长,其中铵态氮更利于蛋白核小球藻的生长。而碳酸酐酶胞外酶对蛋白核小球藻在无机氮的补偿方面具有重要作用[13]。硝化细菌是一类好氧细菌,包括亚硝酸菌和硝酸菌,在污水氨氮转化为硝态氮中发挥重要的作用[14]。硝化细菌的硝化能力受污泥负荷、污泥龄、pH、温度、溶解氧、盐分、碱度、污水中有毒物质等的影响。但有关小球藻与硝化细菌共处条件下对不同氮源的吸收和利用,特别是小球藻与硝化细菌共处条件下对工业废水处理的应用,如屠宰废水中氨氮和总氮去除的应用研究非常少。
本研究利用小球藻和硝化细菌对沂南县同德食品有限公司废水中氨氮和总氮进行去除,包括小球藻和硝化细菌的分离与鉴定,小球藻和硝化细菌对废水中氨氮、总氮的去除等,以期为高浓度氨氮、总氮废水的治理提供一定的参考。
1 实验部分
1.1 实验材料
实验所用硝化细菌和小球藻均分离于沂南县同德食品有限公司废水,所用培养基分别为硝化细菌富集液体培养基和BG11培养基。水样为沂南县同德食品有限公司废水,水样性质:化学需氧量(chemical oxygen demand,COD)26 mg/L,氨氮43.67 mg/L,总氮86.88 mg/L。
1.2 培养基
小球藻扩大培养基均为BG11培养基,其组成:NaNO31.5 g/L, K2HPO40.04 g/L,MgSO4·7H2O 0.75 g/L,CaCl2·7H2O 0.036 g/L,Na2CO30.02 g/L,柠檬酸0.006 g/L,微量元素溶液(A5)1 mL/L。微量元素溶液(A5)组成:H3BO42.86 g/L,MnCl2·4H2O 1.81 g/L,ZnSO40.222 g/L,Na2MoO40.39 g/L,CuSO4·5H2O 0.079 g/L,Co(NO3)2·6H2O 49.4 g/L。
硝化细菌富集培养基组成:NH4Cl 0.382 g/L,CH3COONa 2 g/L,MgSO4·7H2O 0.05 g/L,K2HPO40.2 g/L,NaCl 0.12 g/L,FeSO4·7H2O 0.01 g/L,MnSO4·4H2O 0.01 g/L。
两种培养基在使用前需用Na2HPO4-NaH2PO4缓冲液将液体培养基pH调整至7.2左右,再经121 ℃ 20 min高压蒸汽灭菌后使用。分离小球藻时采用平板固体培养基,平板培养基配制时需加入15 g/L琼脂粉,其他过程同液体培养基制作。
1.3 硝化细菌的分离
将10 mL沂南同德食品有限公司曝气池活性污泥加入到盛有200 mL灭菌后的硝化细菌培养基三角瓶中,该过程为无菌操作,混匀后置于30 ℃恒温振荡培养箱中进行振荡培养,转速为150 r/min,培养4 d后,取少量培养液划线到硝化细菌固体平板培养基上进行培养,28 ℃培养5 d,待菌落出现后,挑选单菌落再重复划线到硝化细菌固体平板培养基上,培养条件不变,重复上述操作直至固体平板培养中菌落形态一致,共分离纯化到两株硝化细菌,暂分别命名为XHL1和XHL2,将此纯菌单独保存在硝化细菌半固体培养基中,待用。
1.4 硝化细菌系统分类位置分析
硝化细菌DNA的提取:对分离到的硝化细菌进行富集培养基,采用柱式基因组抽提试剂盒(UNIQ-10)(生工生物工程公司(上海)股份有限公司)对富集菌液进行DNA提取,提取方法按试剂盒说明书。
聚合酶链式反应(polymerase chain reaction,PCR)采用引物27F(5′-AGAGTTTGATCCTGGCTCAG-3′)和1492R(5′-TACGGCTACCTTGTTACGACTT-3′)。扩增体系设计:在0.2 mL离心管中加入2 μL上清液,再加入由27F 2μL(10 μM)、1492R 2 μL(10 μM)和MIX酶25μL组成的反应混合液,再加重蒸水使反应体系调至50 μL。PCR扩增反应条件为:94 ℃ 5 min,94 ℃ 30 s,55 ℃30 s,30个循环,再72 ℃延伸10 min,委托上海生工生物工程公司对PCR扩增序列进行测序。
系统树的创建:将测得的16S rDNA序列发送到DDBJ(DNA Data Bank of Japan, http:∥www.ddbj.nig.ac.jp/)数据库中的Blast中进行比对,利用CustalX 2.1和Mega 5.1软件创建系统树,采用的方法为邻接法[15-16]。
1.5 小球藻的分离和培养
将5 mL沂南同德食品有限公司二沉池上清液加入含有100 mL灭菌的BG11培养基的三角瓶中,置于光照培养箱中进行恒温培养,培养温度28 ℃,12 d后培养液明显变绿,得到藻培养液。藻的分离采用平板法,具体过程为:将上述藻培养液装入消毒过的小型喷雾器中,喷射到BG11固体平板培养基上,盖好盖,培养温度为28 ℃,光照4.8±0.2 Klx(日光灯源)条件下培养,待长出藻菌落后,借助镜检用消毒过的接种环挑选实验藻,最后将分离到的小球藻穿刺培养于BG11半固体培养基中,待用。
1.6 小球藻生物学特性
1.6.1 小球藻的外部形态观察
将小球藻在BG11液体培养基中培养7 d,取培养液,8 000 r/min离心10 min,倾出上层液体,用无菌水漂洗沉淀两次,再加入1 mL 1%戊二醛固定(4 ℃过夜),然后1 000 r/min离心10 min,最后用0.1 mol/L磷酸缓冲液漂洗3次,干燥,APREO扫描电镜(美国FEI,2018)观察其细胞形态。
1.6.2 小球藻的生长曲线测定
通过测定小球藻细胞数目制作小球藻生长曲线。小球藻细胞计数方法:将藻培养液用力振荡混匀,然后于无菌操作台取1 mL加入到2.5 mL EP管中,再加入1滴KI-I2溶液,染色15 min。培养条件为28 ℃,光照4.8±0.2 Klx(日光灯源),每隔24 h取藻菌培养液,对细胞进行计数,每个样品设三个平行,将染色后液体滴入藻细胞计数板,于光学显微镜(10×10)观察并计数,每样计数10次,计算藻细胞平均数,以培养时间为横坐标,藻细胞平均数目为纵坐标制作生长曲线。
1.7 小球藻对废水中氨氮、总氮的去除
用BG11液体培养基对分离到的小球藻进行扩大培养4 d,取藻培养液10 mL加入200 mL废水样品中,28 ℃条件下光照培养(4.8±0.2 Klx日光灯源),每隔24 h取培养液,采用过滤方法去除培养液中的藻细胞后,测定三次滤液中的氨氮和总氮含量,取平均值作为氨氮和总氮最终含量。以培养时间为横轴,氨氮、总氮含量为纵轴制作曲线,并计算氨氮和总氮去除率,计算公式分别为:
CNH4-N去除率=(C初期NH4-N-C末期NH4-N)/C初期NH4-N,
(1)
CT-N去除率=(C初期T-N-C末期T-N)/C初期T-N。
(2)
测定方法:总氮(T-N)、氨氮(NH4-N)测定分别采用过硫酸钾消解-紫外分光光度计方法和纳氏试剂比色法(GB11894—89),所用紫外可见分光光度仪型号为 UV-1200S(AOE,2018),总氮测定用过硫酸钾为分析纯。
1.8 小球藻-硝化细菌共处对氨氮、总氮的去除测定
结合硝化细菌在分离过程中菌落生长情况,选定硝化细菌XHL1去除废水中氨氮、总氮。将对数增长期的小球藻培养液、硝化细菌XHL1培养液以及沂南同德食品有限公司二沉池上清液按体积比1∶1∶20混匀,振荡(转速为150 r/min)、光照(4.8±0.2 Klx 日光灯源)、28 ℃恒温条件下培养,每隔24 h取培养液,过滤去除藻细胞后进行氨氮、总氮测定,并计算氨氮、总氮去除率。
2 结果与讨论
2.1 小球藻的生物学特性
2.1.1 小球藻电镜扫描图
将培养7 d时的小球藻用戊二醛固定、磷酸缓冲液冲洗、干燥后用电子显微镜进行观察(放大倍数80 000),如图1。从图1可以看出,小球藻的直径为4.5 μm,表面多褶皱,这与该小球藻进行扫描电镜处理时的生长时期有关,小球藻在其生长衰减期时,由于细胞内代谢趋于衰落,内含物排泄出细胞而导致细胞表面出现褶皱。

图1 小球藻扫描电镜图
小球藻表面的褶皱增大了小球藻的表面积,增大了与氨氮和总氮的接触面积,从而提高了小球藻对氨氮和总氮的吸收能力。另外,不同的营养条件以及温度条件也会影响小球藻的大小,合适的营养环境,如在BOD、N和P的质量比为100∶5∶1的污水营养条件下,小球藻的直径可达5.7 μm,而环境中过高的盐分以及有毒物质也会导致小球藻脱水、直径变小甚至死亡。本研究中,沂南县同德食品有限公司废水中BOD、N和P的质量比为100∶6∶1,总氮稍高,无其他有毒物质,对小球藻的生长无明显抑制作用。
2.1.2 小球藻生长曲线
从图2可以看出,随着培养时间的延长,小球藻数目持续增加,经过6 d的培养,小球藻从最初的1.58×106Cells/mL上升到8.75×106Cells/mL。从第4 d开始,小球藻增值速度最快,为小球藻对数增长期,从5.6×106Cells/mL 上升至8.1×106Cells/mL,而从第5 d开始,藻细胞数目增值速度变慢,基本维持平稳状态,而该小球藻的停滞期非常短,可能与小球藻接种量较多有关。
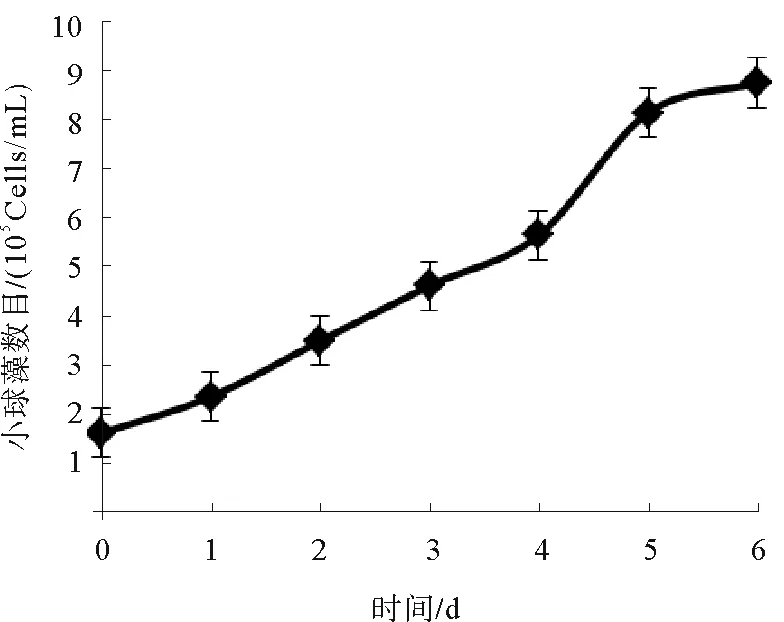
图2 小球藻生长曲线
小球藻的生长曲线包括停滞期、对数增长期、平衡期和衰减期。停滞期是小球藻进行细胞分裂的准备阶段,对数增长期是小球藻数目剧烈增多的阶段,是小球藻代谢最旺盛的时期。本研究中小球藻对数增长期较长,表明所用培养基组成以及培养光照条件适合该小球藻的生长。
2.2 硝化细菌分类学位置分析
利用硝化细菌的分离培养基,经过多次分离纯化,从沂南县同德食品有限公司废水中分离到两株硝化细菌,菌株菌落形态如图3所示。从图3可以看出,两菌株菌落均为光滑型,形态基本一致,但菌株XHL1菌落为淡黄色,菌落直径较大,表面有凸起,菌落数目较少;而菌株XHL2菌落为乳白色,表面光滑,且菌落数目较多,细胞表面分泌黏性物质,为多糖类物质。为进一步对两菌株进行鉴定,对两菌株进行DNA提取、PCR扩增并测序,将测序得到的序列在DDBJ数据库中用BLAST进行同源性比对,发现菌株XHL1和XHL2分别与Acinetobacterbaumanniistrain SO20(HQ631961)和Acinetobactersp.2C56(JN228308)的同源性最高,分别高达100%和99%。利用MEGA5.1软件对同源性较高的序列进行序列分析并构建系统发育树(图4)。从图4可以看出,分离到的菌株XHL1和XHL2在同一分支上,两菌株亲缘关系非常近,证明为同一属细菌,因此,该系统发育树结果从基因水平上也为两菌株菌落形态基本一致的结果提供了支撑。

图3 菌株XHL1(a)和菌株XHL2(b)平板菌落
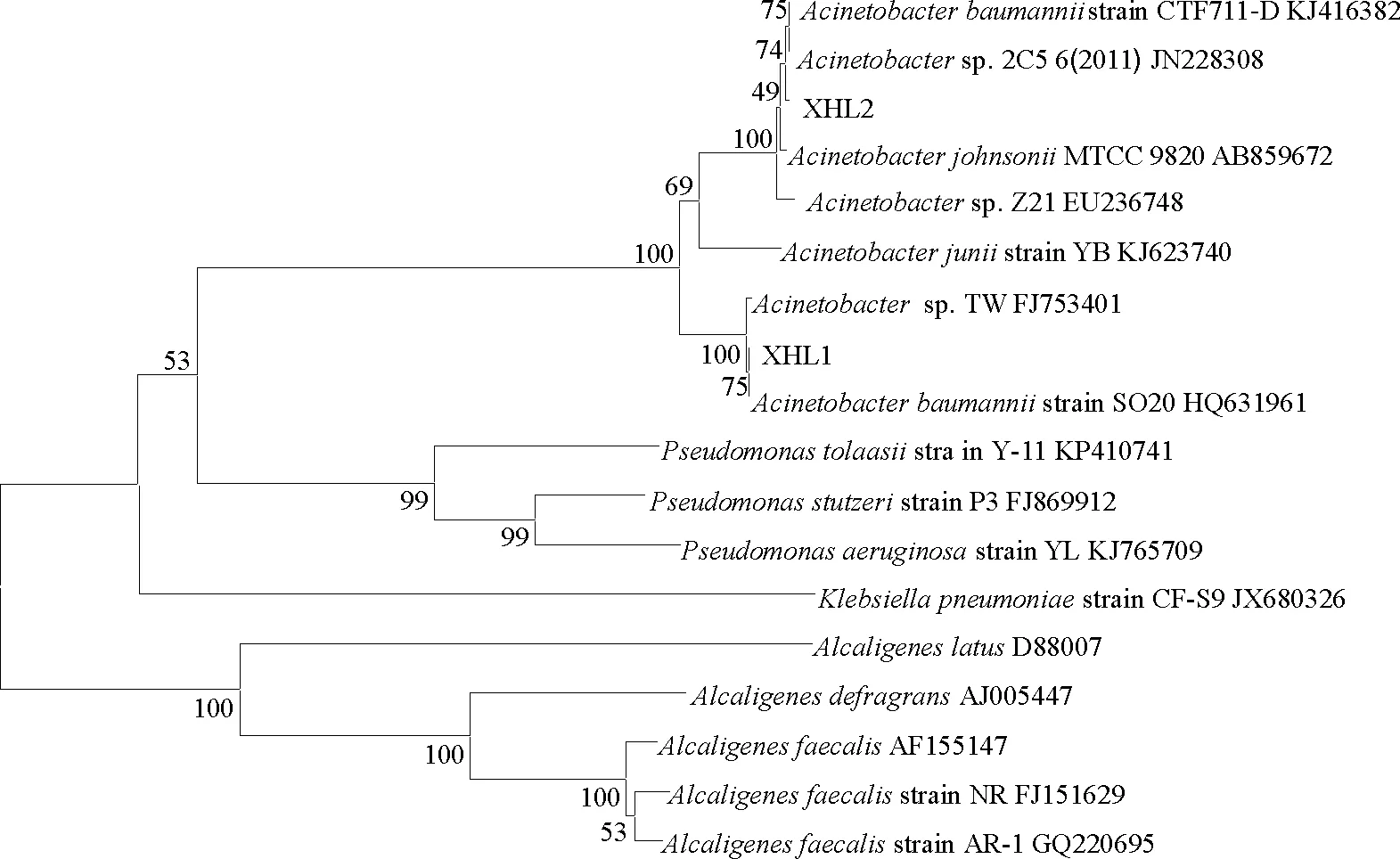
图4 菌株的系统发育树
通过对两菌株的外部形态进行比较,结合基因序列以及系统发育树进行分析,从不同角度得出的结论是一致的。本实验中,两菌株从食品厂废水中分离而来,这与废水中高浓度铵态氮密切相关。
2.3 小球藻对氨氮和总氮的去除效果
小球藻单独处理废水中的氨氮和总氮,结果如表1所示。由表1可见,经过4 d的培养,沂南同德食品有限公司二沉池上清液中氨氮含量从未处理前的43.67 mg/L降至2.54 mg/L,去除率为94.18%;同时总氮从未处理前的86.88 mg/L降低到13.52 mg/L,去除率为84%。
小球藻对水体中不同形态氮的吸收能力不同,其吸收的顺序为:氨氮>简单有机氮>硝态氮和亚硝态氮,其中小球藻将吸收的氨氮完全转化为蛋白质、叶绿素等细胞含氮物质。从表1也可以看出,小球藻对氨氮的去除率高于对总氮的去除率。这是因为沂南县同德食品有限公司的污水经过氨化反应后,污水中的氮基本为铵态氮和硝态氮,即污水中总氮包括铵态氮和硝态氮两种,这与小球藻对氨氮的吸收能力高于对硝态氮的吸收结论相一致。

表1 小球藻单独培养对氨氮和总氮的去除
2.4 小球藻与硝化细菌共培养去除氨氮、总氮
硝化细菌XHL1与小球藻按相同的体积比接种到沂南县同德食品有限公司二沉池上清液中进行培养,并测定培养液中氨氮和总氮的含量,结果如表2所示。从表2可以看出,在硝化细菌-小球藻共处条件下,氨氮含量从未处理前的43.67 mg/L降至0.32 mg/L,去除率为99.3%。废水中总氮从未处理前的86.88 mg/L降到18.9 mg/L,去除率为78%。

表2 小球藻与硝化细菌XHL1共处对氨氮和总氮的去除
A-A-O是污水处理厂去除氨氮和总氮的最为常见的工艺,机理是污水中的铵态氮在硝化细菌的作用下转化为硝态氮,从而呈现铵态氮降低的现象。而总氮的减少是在污水中反硝化细菌的脱氮作用下,将硝态氮转化为氮气从水体中溢出而减小。废水中总氮包括氨氮、硝态氮、亚硝态氮和其他有机态氮。表1、表2结果表明,小球藻单独存在时对废水中氨氮去除率为94.18%,低于小球藻和硝化细菌XHL1共处条件下对氨氮的去除率(99.3%),这可能是小球藻和硝化细菌XHL1共同对氨氮的吸收所致;而小球藻单独存在时总氮的去除率为84%,远高于小球藻-硝化细菌共处条件下对总氮的去除率(78%),这可能是小球藻-硝化细菌共处时硝化细菌XHL1将氨氮转化为硝态氮又释放到水体中的缘故。
3 结论
从山东省沂南县同德食品有限公司废水中分离得到两株硝化菌(XHL1和 XHL12)及小球藻。对两株硝化细菌进行16S rDNA 提取、测序和同源性分析,鉴定该两菌株属于Acinetobactersp.菌属。对从该废水中分离到的小球藻用扫描电镜进行了外部形态观察,发现其细胞直径为4.5 μm,对数增长期出现在第4 d。
小球藻单独存在条件下对废水中氨氮的去除效率为94.18%,总氮的去除率为84%。小球藻-硝化细菌共处条件下对废水中氨氮的去除效率为99.3%,总氮的去除率为78%,而未对小球藻对COD、总磷的去除效果进行研究。陆洪省等[17]对从养猪废水中分离到的蛋白核小球藻进行了研究,分析了该蛋白核小球藻对养猪废水中COD、总磷的去除率分别为70.9%和34.7%。本研究在小球藻-硝化细菌共处条件下对食品厂废水中的氨氮、总氮的去除进行了分析,证明了两者共处条件下促进了对污水中氨氮的去除,为两者在污水实际处理过程中的应用提供了新的途径。本研究中分离到的小球藻来源于屠宰废水,这与陆洪省等[17]在养猪废水中分离到的蛋白核小球藻有可能不属于同一种小球藻,因此,对目前分离到的小球藻在废水处理中的其他方面的应用需要进一步研究,为小球藻在污水处理中的实际应用打下基础。
