基于医疗机构中药制剂的中药新药研发刍议
2021-02-22王嵩郤庆罗发珍李国文
王嵩 郤庆 罗发珍 李国文
摘 要 医疗机构中药制剂是我国特有的医院药学组成部分,在临床上发挥着重要作用。医疗机构中药制剂是中药新药研发的重要来源之一。本文分析医疗机构中药制剂向中药新药转化的现状及存在问题,并提出建议,希望加快中药新药研发,促进中医药发展。
关键词 医疗机构中药制剂 中药新药 研发
中图分类号:R283.6; R288 文献标志码:C 文章编号:1006-1533(2021)01-0006-04
*基金项目:①上海市“医苑新星”青年医学人才培养计划项目;②上海市卫生和计划生育委员会科研课题青年项目(20174Y0160)
Discussion on the research and development of new drug based on hospital preparation of traditional Chinese medicine*
WANG Song, XI Qing, LUO Fazhen, LI Guowen**
(Department of Pharmacy, Shanghai TCM-Integrated Hospital, Shanghai University of TCM, Shanghai 200082, China)
ABSTRACT Hospital preparation of traditional Chinese medicine (TCM) is a unique part of hospital pharmacy in China and an important resource for the research and development of new drug of TCM, and plays an important role in clinical application. This paper analyzed the current situation and problems of new drug transformed from hospital preparation of TCM and proposed some suggestions, hoping to accelerate the research of new drug of TCM and promote the development of TCM.
KEy WORDS hospital preparation of TCM; new drug of TCM; research and development
在新药研发领域,中药及天然药物已成为创新药物发展的源泉,也是我国创新药物研发的重要发展方向之一。医疗机构中药制剂是我国特有的一种中药制剂形式,是在中医药理论指导下,医疗机构依据长期临床使用的安全、有效的固定处方配制的中药制剂。医疗机构中药制剂用药安全、疗效确切、方式灵活、费用低廉,体现了中医药简、便、验、廉的特点。医疗机构中药制剂的使用能够弥补市售中成药的不足,有利于满足人民的中医药服务需求;能够服务于临床需求,有利于提高中医治疗效果;能够带动特色专科和医院特色的建设与发展,有利于保持并发挥中医药特色及优势;能够有效继承名、老中医专家的临床经验,有利于推动中医药的传承和创新[1]。医疗机构中药制剂是各医疗机构的品牌和核心竞争力。目前临床上常用的一些中成药都源自于医疗机构中药制剂,医疗机构中药制剂是我国中药新药研发的主要源泉之一。本文分析医疗机构中药制剂向创新中药转化的现状及存在问题,并提出相关建议。
1 法律、法规和政策支撑
中医药是中华民族在与疾病的长期斗争中积累下来的宝贵财富,其科学性已得到历史的证明。2017年7月施行的《中华人民共和国中医药法》在中医药发展史上具有里程碑的意义,其要求继承和弘扬中医药、保障和促进中医药事业发展,表明国家对中医药事业的高度重视与支持。中医药法鼓励医疗机构根据本医疗机构临床用药需要配制和使用中药制剂,支持应用传统工艺配制中药制剂,支持以中药制剂为基础研发中药新药,支持提高中药新药的质量和临床疗效,以促进中药新药研发的良性循环[1]。2019年12月施行的新版《中华人民共和国药品管理法》[2]中也明确,鼓励运用现代科学技术和传统中药研究方法开展中药科学技术研究及其新药研发,建立和完善符合中药特点的技术评价体系,促进中药的传承与创新。
医疗机构中药制剂多为中药复方制剂,其作为新药注册申请可参考2020年7月施行的新版《药品注册管理办法》[3]中规定的中药创新药、中药改良型新药、经典名方中药复方制剂、同名同方药等进行分类。鉴于中药的复杂性和特殊性,《中药注册管理补充规定》[4]遵循中药研究规律,体现其特殊性,注重传承与创新,要求坚持以中医药理论为指导,突出中医药特色,强调临床应用为基础,严格把控中药质量,保证用药安全。同时,在中药注册政策上也作了调整:“具有充分的临床应用资料支持,且生产工艺、用法用量與既往临床应用基本一致的,可仅提供非临床应用安全性试验资料;需要进行药效学研究的,一般应采用中医证候的动物模型或疾病模型”[4]。
新型冠状病毒肺炎疫情的暴发让人们感受到了中医药的重要性,国家有关部门也在加紧制定相关的政策法规,包括国家药品监督管理局组织起草的《中药注册管理专门规定(征求意见稿)》《中药注册分类及申报资料要求(征求意见稿)》《已上市中药变更事项及申报资料要求(征求意见稿)》《已上市中药药学变更研究技术指导原则(征求意见稿)》《中药注册受理审查指南(征求意见稿)》和《中药变更受理审查指南(征求意见稿)》等文件,表明国家对中药新药研发高度重视,希望发挥中医药在防病、治病上的独特优势和作用,推进中药产业的发展。随着国家对医疗机构制剂的重视程度加大,监管措施亦趋严格,《医疗机构制剂注册管理办法》《医疗机构制剂配制质量管理规范》和《医疗机构制剂配制监督管理办法》等一系列政策法规的实施对医疗机构制剂发展既是挑战,又是机遇。目前,各省、市、自治区都根据本地实际情况配套制定了相关的实施细则,促进上述政策法规的落实。通过出台政策法规加强医疗机构中药制剂的监管,有利于其规范、健康地发展。
2 医疗机构中药制剂的特点及现状
长期以来,医疗机构中药制剂在保障临床用药、弥补市场不足等方面发挥了重要作用。医疗机构中药制剂多源自于本医疗机构内专家多年积累下来的中药处方,经过长期的临床检验,因疗效确切、价格相对低廉等而被患者所接受,是中医药的宝贵财富。医疗机构中药制剂是我国特有的一种制剂形式,从20世纪五六十年代开始应用于医疗机构,七八十年代快速发展,成为医疗机构用药的重要组成部分,可满足本医疗机构内的临床用药需求。不过,随着国家对医疗机构制剂的监管日趋严格,医疗机构中药制剂的生存和发展面临严重的挑战。从医疗机构整体情况来看,医疗机构制剂品种数严重萎缩。有调查显示,经2007年初的医疗机构制剂再注册,上海市医疗机构制剂的批准文号数已减少到1 655个,其中764个为中药制剂,品种数较化学制剂多1倍[5]。2006年北京市医疗机构制剂的批准文号数减至3 448个,新制剂注册数也减少[6]。一些疗效不确切、质量标准不完善、使用量偏低的医疗机构制剂品种被陆续淘汰。
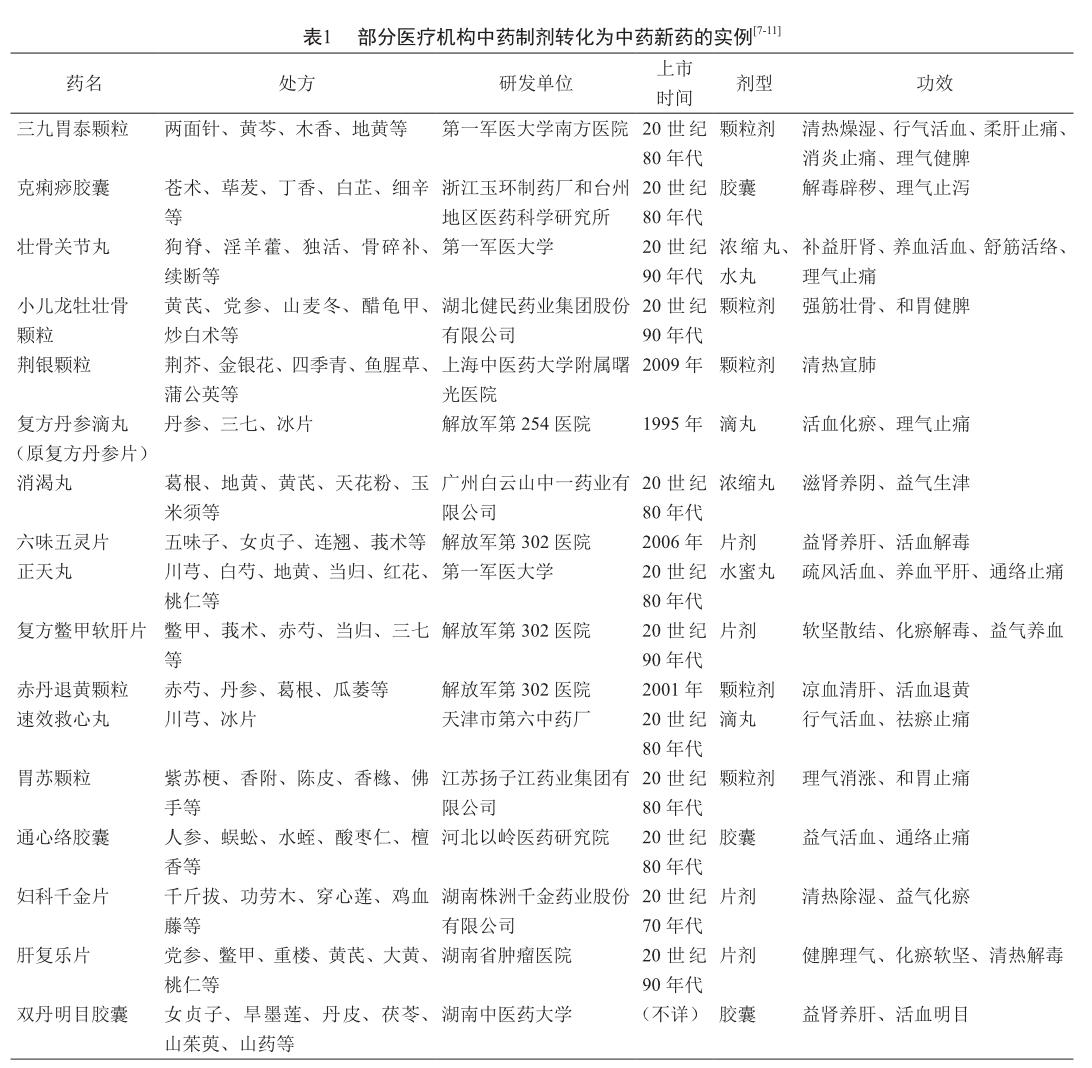
3 醫疗机构中药制剂转化为中药新药的实例
医疗机构中药制剂的发展推动了其向中药新药的转化,是中药新药研发的重要来源之一。目前临床上使用的部分疗效确切的中成药即由医疗机构中药制剂研发和改良而来,如著名的三九胃泰颗粒、复方丹参滴丸、荆银颗粒等(表1)。以医疗机构中药制剂为基础进行中药新药研发,这是我国特有的、重要的新药研发路径。
4 相关建议
4.1 加强知识产权保护
中医药知识产权是我国知识产权的重要组成部分。我国中医药法强调,要保护中医药知识产权,提高中医药的科学技术水平;鼓励中药新药研发与生产,支持具有自主知识产权且安全、有效的中药新药研发。国家《中医药发展战略规划纲要(2016—2030年)》中提出,要加快形成中医药自主知识产权,促进创新成果的知识产权化、商品化和产业化;要提高中药工业知识产权的运用能力,加强中医药知识产权的国际保护[12]。医疗机构中药制剂一般以复方制剂为主,可申请知识产权保护。但实际上,将处方、工艺等核心内容申请知识产权保护的医疗机构中药制剂品种数并不多。医疗机构公开发表医疗机构中药制剂相关的基础研究和临床应用数据可能会影响医疗机构的利益。医疗机构中药制剂在成功转化为中药新药之前有漫长的研发过程,事先申请保护中药制剂处方的知识产权十分重要,而后才可在学术期刊上发表或学术会议中公开中药新药的临床研究等成果,同时客观上帮助制药企业了解相关信息,决定是否选择与医疗机构合作,共同研发中药新药。国际上中药相关的知识产权竞争非常激烈。有统计显示,作为中药起源国,我国制药企业在国际中药市场上所占份额只有10%左右,远不及邻国日本、韩国等国。日本在六神丸基础上研发出救心丸,其年出口额达约1亿美元。日本颁布的《一般用汉方制剂承认基准》中包括263个汉方,这些汉方主要源自于我国《伤寒论》《金匮要略》等医典[13]。
4.2 重视毒性药味安全性的研究
已经长期临床应用是医疗机构中药制剂的特点之一。在医疗机构中药制剂向中药新药转化前,除要有明确的疗效和适应证外,了解其处方中是否含有毒性药味也至关重要,涉及到未来的药品安全性问题。医疗机构中药制剂多源自于名老中医的经验方、医疗机构的协定方,有些则来源于民间的秘方、验方。在中药新药研发过程中,如果因为药品的安全性导致研发失败,将浪费大量的人力、物力、财力和时间,且会影响参与研究的患者的健康。早在《神农本草经》中就根据毒性将药材分为大毒、中毒和小毒。中国药典中收载了30余种毒性药材,这些药材在一些顽疾治疗中有重要作用,特别是对风湿和外科等疾病,但由此引起的不良反应也时有报道,如雷公藤[14]、马兜铃[15]等,长期使用或使用不当都存在安全性隐患。《中药新药质量标准研究技术指导原则(试行)》[16]中提及,应着重研究并建立包括毒性成分在内的主要指标的检验方法和质量标准,涉及安全性的指标应尽可能全面。不过,无论是中国药典还是各省级中药饮片炮制规范,在毒性成分的检测标准及方法上,目前都存在一定的局限性。《关于对医疗机构应用传统工艺配制中药制剂实施备案管理的公告》[17]中要求,若中药处方中含有法定标准的“剧毒”“大毒”和现代毒理学研究证明有明确毒性的药味,需提交单次和重复给药的毒性试验资料与文献资料。炮制技术是中药特有的工艺,能降低一些毒性药材的毒性,也用于提高一些药材的效用。如中医临床上常用的毒性药材附子,从古至今都要经过严格的炮制加工,目的是将有毒的双酯型生物碱水解为毒性较低的单酯型生物碱,且其炮制方法多样,而不同炮制方法降低的毒性程度亦不相同[18]。通过提高毒性药材的质量标准、建立适宜的炮制加工规范、合理调整用量,可保证其安全、有效、质量可控,有效地推进含有毒性药味的医疗机构中药制剂向中药新药的转化。
4.3 提高质量标准
2004年日本颁布了药用植物生产质量管理规范,要求采用先进工艺保证不同制药企业生产的汉方药的成分、药效相对稳定。其中,对汉方药制剂,推荐采用高效液相色谱、指纹图谱作为主要的质量控制标准。韩国致力于中药古方、验方的研究,目的在于运用现代科学技术阐明中药方剂的传统功效,揭示药效的作用机制,建立中药质量控制标准,最终提高所研发中药的现代化水平。而在我国,医疗机构中药制剂的质量标准多数还停留在薄层色谱检测层面上,技术落后,可控性也差,已无法达到新版中国药典的要求。实际上,自从国家开展医疗机构制剂再注册工作以来,每次再注册的重点也都是完善质量标准。质量标准对保证医疗机构制剂的质量至关重要,同时亦是其向中药新药成功转化的关键因素。由于医疗机构中药制剂的成分较为复杂,故目前常常采用以专属的测定方法测定的制剂处方中起主要治疗作用的药味(君药)的主要有效成分含量来作为中药制剂质量的主要指标,并在此基础上制定中药制剂的质量标准。中药制剂的成分复杂,其质量控制体系的确立往往都有一个系统、复杂、不断完善的过程[19]。完善的医疗机构中药制剂质量标准对建立由其转化而来的中药新药的质量标准具有重要作用。
4.4 运用区块链技术
国内开展的医疗机构制剂再注册工作有利于药品的安全监管。不过,由于缺乏系统管理体系、没有进行科学的临床试验等原因,医疗机构很难根据要求完成再注册所需的临床再评价[20]。此外,由于缺乏严格、可控的质量标准,实际生产与工艺不符,制剂质量检验标准不统一等,使得医疗机构中药制剂的安全性、有效性不能得到保障,更难以为转化为中药新药提供准确、完整的数据。区块链技术作为一种分布式数据库系统,目前已在金融、物流等领域有较好的应用。新药研发是多方合作的过程,可运用区块链技术创建一种技术平台,方便研发各方的信息共享,包括从药材的获取到中药制剂的生产、存储、使用、临床评价等各类数据,再借助物联网形成线下采集与线上流转的可信封闭环,切实提高研发效率[21]。区块链数据具有不可篡改性、加密设计、分布式存储等特征,能同时解决新药研发中数据的真实性、隐私保护等问题。
4.5 建立合作研发平台
医疗机构和制药企业在医疗机构中药制剂转化为中药新药的研发过程中都起着重要、但不同的作用。相当一部分成功转化为中药新药的品种是医疗机构和制药企业合作研发的结果。建立合作研发平臺、明确产权属性、发挥各自优势、加强资源整合将事半功倍。目前,一些高等院校、包括大型附属医疗机构都已设立成果转化中心,为创新药的研发甚至市场化、产业化提供服务。湖北国家中医临床研究基地创建了一个中药新药研发平台,该平台包括中药物质基础研究技术平台、中药制剂工艺研究技术平台、中药及其制剂质量控制研究技术平台等[22],几年来已帮助研发一批特色中药制剂,且从中筛选出的一个中药制剂正在按中药新药研究的技术要求开展临床前研究。
5 结语
新药研发可能需要10 ~ 15年才能完成所有研究项目,成本高昂,风险大。相比之下,由于医疗机构中药制剂已经过长期的临床应用,安全性和有效性都有所保障,是中药新药研发的重要来源之一,也是我国新药研发的特有途径之一。由医疗机构中药制剂转化为中药新药可缩短新药研发周期,降低研发成本及其风险,发展空间较大,前景良好。
参考文献
[1] 中医药法释义(31)[EB/OL]. (2017-07-01) [2020-12-02].http://fjs.satcm.gov.cn/zhengcewenjian/2018-03-24/2441. html.
[2] 中国人民共和国药品管理法[EB/OL]. (2019-08-26)[2020-12-02]. http://www.gov.cn/xinwen/2019-08/26/ content_5424780.htm.
[3] 药品注册管理办法[EB/OL]. (2020-03-30) [2020-12-02]. http://www.gov.cn/zhengce/zhengceku/2020-04/01/ content_5498012.htm.
[4] 中药注册管理补充规定[EB/OL]. (2008-01-09)[2020-12-02]. http://www.satcm.gov.cn/fajiansi/ gongzuodongtai/2018-03-24/2286.html.
[5] 孙轶康, 叶桦. 上海市医疗机构制剂现状及发展趋势分析[J]. 上海医药, 2010, 31(8): 357-359.
[6] 陈旭, 张雪, 申琳, 等. 医疗机构中药制剂研发现状与展望[J]. 中华中医药杂志, 2015, 30(7): 2281-2286.
[7] 陈佩毅, 吴生齐, 唐年忠, 等. 医疗机构中药制剂向中药新药转化的探讨[J]. 中国医药导报, 2012, 9(20): 5-6; 9.
[8] 李灿, 丁建华, 刘春, 等. 关于医疗机构中药制剂向中药新药转化的思考[J]. 中药新药杂志, 2016, 25(9): 973-975.
[9] 梅全喜, 范文昌. 医院中药制剂开发的意义研发方向及应注重的几个问题[J]. 中医药管理杂志, 2011, 19(4): 357-361.
[10] 田元祥, 雷燕, 曹洪欣, 等. 基于中医医院制剂处方的中药创新药处方优化模式的探讨[J]. 世界科学技术——中医药现代化, 2012, 14(4): 1831-1834.
[11] 秦裕辉. 关于我省医院中药制剂研发的思考与建议[J]. 湖南中医杂志, 2018, 34(1): 2-4; 8.
[12] 中医药法释义(8)[EB/OL]. (2017-07-01) [2020-12-02]. http://fjs.satcm.gov.cn/zhengcewenjian/2018-03-24/2418. html.
[13] 胡彦君, 钟良才, 李柏群. 医院中药制剂发展模式、合理用药及研究方向探讨[J]. 药物评价研究, 2019, 42(5): 1020-1026.
[14] 冯雪, 方赛男, 高雨鑫, 等. 雷公藤制剂安全性的循证评价研究[J]. 中国中药杂志, 2018, 43(3): 425-439.
[15] 王震宇. 马兜铃配伍山豆根配伍导致不良反应的病例报告[J]. 当代医药论丛, 2014, 12(21): 74.
[16] 中药新药质量标准研究技术指导原则(试行)[EB/ OL]. (2020-11-30) [2020-12-02]. http://www.cde.org.cn/ attachmentout.do?mothed=list&id=2ef12fa5e52e9a3d.
[17] 国家食品药品监督管理总局发布《关于对医疗机构应用传统工艺配制中药制剂实施备案管理的公告》. [EB/OL].(2018-02-13) [2020-12-02]. http://www.ccpie.org/cn/yjxx/ yphzp/webinfo/2018/02/1515088436657995.htm.
[18] 凡若楠, 张依欣, 于武华, 等. 附子炮制的研究进展[J].江西中医药, 2019, 50(10): 66-70.
[19] 郭静, 玄振玉, 谢燕. 中药复方新药药学研究中的问题与思考[J]. 中草药, 2020, 51(8): 2267-2272.
[20] 孙轶康, 卫敏, 叶桦. 上海市医疗机构制剂临床再评价现状分析[J]. 中国新药与临床杂志, 2010, 29(9): 700-703.
[21] 黄柳. 区块链助力构建完美医疗信息化[J]. 中国医院院长, 2019(8): 81-83.
[22] 胡晓雪, 陈树和, 朱田密, 等. 国家中医临床研究基地(湖北)中药新药研发平台建设[J]. 世界科学技术——中医药现代化, 2013, 15(5): 1124-1127.
