响应面法优化黑曲霉SH312-26-19产果胶酶发酵条件
2021-02-22武佳文郭佳垚李倩倩赵廉谦
武佳文,郝 林*,郭佳垚,李倩倩,赵廉谦
(山西农业大学 食品科学与工程学院,山西 晋中 030801)
果胶酶是指降解果胶质的一类酶的总称,根据其作用机理可分为3大类:聚半乳糖醛酸酶(polygalacturonase,PG)、果胶酯酶(pectinestease,PE)、果胶裂解酶(pectinlyases,PL)[1-2]不同来源的果胶酶与果胶多糖的作用方式不同,其分解产物比例不同[3-6]。PG专一性地分解果胶质中两个非酯化半乳糖醛酸间的糖苷键,使果胶很快从大分子降解为分子质量较小的低聚糖类,能很快降低果胶溶液的黏度;PL通过反式消去作用生成半乳糖醛酸;PE具有脱脂作用可水解甲酯化果胶半乳糖醛酸骨架C-6位的甲氧基,该过程通常沿果胶多糖链线性进行,称为“单链机制”,生成果胶酸和甲醇[7-8]。
果胶酶主要用于提高果蔬汁出汁率和果酒澄清处理,增加产品风味[9],但在以果胶含量高的水果作为原料时,果酒在酿造过程中果胶由于果胶酶中甲酯酶的分解反应,会使甲氧基基团增加而导致甲醇过量。甲醇可在人体内被乙醇脱氢酶代谢成甲醛或者甲酸,从而造成代谢性酸中毒[10-13]。
本试验优化黑曲霉生产果胶酶的发酵条件,旨在降低酶解液中甲醇生成量,并对比果胶酶粗酶液与市售果胶酶的甲醇生成量,以期为果胶酶的工业化应用提供支持。
1 材料与方法
1.1 材料与试剂
1.1.1 菌种与培养基
黑曲霉(Aspergillus niger)SH312-26-19:本课题组前期分离筛选并经紫外线诱变得到产生较高活力的聚半乳糖醛酸酶的黑曲霉菌株[14]。
固体发酵培养基[15]:麸皮10 g,H2O 15 mL,初始pH自然。121 ℃、0.1MPa灭菌20min。
1.1.2 主要试剂
麸皮、豆粕粉、陈皮粉、马铃薯:市售;果胶酶1(60 000 U/g):浙江一诺生物科技有限公司;果胶酶2(40 U/mg),D-半乳糖醛酸:北京索莱宝科技有限公司;其他药品均为国产分析纯。
1.2 仪器与设备
V-1300型可见分光光度计:上海美析仪器有限公司;YQX-LS-75SⅡ型立式压力蒸汽灭菌器:上海博讯实业有限公司医疗设备厂;DHP-9032型电热恒温培养箱:上海一恒科学仪器有限公司;BJ-CD型超净工作台:上海博讯实业有限公司医疗设备厂。
1.3 方法
1.3.1 菌种的培养
无菌水洗下斜面上的孢子,在装有玻璃珠的三角瓶振荡制成孢子悬液。通过血球计数板将孢子悬液的孢子数调整至106个/mL。定量的孢子悬液接种至固体发酵培养基中,30 ℃静置培养3 d。
1.3.2 粗酶液的制备
称取1 g麸曲加入100 mL蒸馏水中,30 ℃、200 r/min摇床振荡10 min,3 000×g条件下离心10 min即得粗酶液。
1.3.3 单因素试验
分别对碳源比例(麸皮∶玉米粉=0∶5、1∶4、2∶3、3∶2、4∶1、5∶0),麸皮添加量(6 g、8 g、10 g、12 g、14 g),氮源种类((NH4)2HPO4、(NH4)2SO4、豆粕粉、NH4Cl、(NH4)2C2O4),(NH4)2SO4添加量(0.6 g、0.8 g、1.0 g、1.2 g、1.4 g),接种量(6%、8%、10%、12%),发酵温度(25 ℃、30 ℃、35 ℃、40 ℃),发酵时间(2 d、3 d、4 d、5 d),诱导物(陈皮粉)添加量(0.5 g、1.0 g、1.5 g、2.0 g、2.5 g)和初始pH值(2.0、3.0、4.0、5.0、6.0)进行单因素试验。
1.3.4 Plackett-Burman(PB)试验设计
分别选取以上7个因素的高低2个水平,通过Minitab18软件选用Factors=7,Runs=12的PB设计,以果胶酶活力(Y)作为响应值。通过比较各因素的显著性水平,筛选出对酶活力影响较为显著的因素。
1.3.5 最陡爬坡试验
根据PB试验及其分析结果设计最陡爬坡试验,对显著因素进行梯度设计,其余不显著的因素在PB分析结果中是正效应的取高水平,是负效应的选低水平。
1.3.6 Box-Behnken试验设计[16]
用Box-Behnken试验设计进行响应面试验,通过试验数据拟合响应面模型,得到二次多项式,并最终确定最佳发酵条件。
1.3.7 测定方法
果胶酶活力测定:采用3,5-二硝基水杨酸(3,5-dinitrosalicylic acid,DNS)法[17]。果胶酶酶活定义为1 mL粗酶液,每分钟分解果胶生成1 μmoLD-半乳糖醛酸,所需酶量为1个酶活单位(U/mL)。
甲醇含量的测定:分别将粗酶液与市售果胶酶酶活调整为50 U/mL,并与5%果胶溶液在50 ℃酶解3 h、4 h、5 h后,参照GB 5009.266—2016《食品安全国家标准食品中甲醇的测定》[18]中的方法测定反应体系中甲醇含量。
1.3.8 统计分析
所有试验做3个平行,2个重复,使用Excel 2016统计试验数据。采用Minitab18、Design-Expert 8.0.6和Sigmaplot 10.0软件进行数据分析和作图。
2 结果与分析
2.1 单因素试验筛选结果

图1 各发酵因素对果胶酶活的影响Fig.1 Effect of each fermentation factors on the activities of pectinase
由图1a、1b可知,麸皮与玉米粉的比例为5∶0时,果胶酶活最高(P<0.05),为1 277.82 U/mL,且黑曲霉产果胶酶的活力随着麸皮的比例的增加呈先降低后升高的趋势,麸皮添加量为10 g时果胶酶活力最高。麸皮疏松多孔,有利于黑曲霉充分利用氧气,在麸皮与玉米粉的体系中,玉米粉占有这部分空隙,导致能被黑曲霉利用的氧气减少,黑曲霉呼吸作用减弱,酶活降低。发酵期间无机氮源可以控制发酵过程中菌体生长时期和代谢产物形成时期的协调[19-20]。由图1c、1d可知,在氮源为(NH4)2SO4的培养基中,黑曲霉产果胶酶的活力最高,且(NH4)2SO4添加量为1.0 g时,果胶酶活力达到1 360.67 U/mL。由图1e可知,随着黑曲霉接种量的提高,果胶酶活先升高,后降低,接种量为10%时,酶活最大,为1 426.85 U/mL。接种量增加,黑曲霉充分利用培养基中营养成分,生长繁殖,酶的合成和分泌量增加;但接种量过高时,营养消耗过快,在有限的营养成分中,菌种老化速度也将加快,最终酶的合成和分泌量也会减少。陈皮粉中的果胶在培养基中可作为诱导物诱导果胶酶的合成,果胶降解的中间产物或代谢产物是有效的诱导物。菌体在发酵过程中会产生一定量的PG,释放到细胞外,将陈皮粉中的果胶分解成具有一定分子量的降解物而被细胞吸收,并在不导致降解物阻遏条件下,直接或间接地诱导菌体,大量合成果胶。由图1f可知,陈皮粉添加量为0.5~2.0 g时,酶活逐渐升高,添加量为2.0 g时,达到最高,为2 086.37 U/mL,当添加量>2.0 g时,酶活下降。这可能是因为在陈皮粉添加达到一定量时,陈皮粉中含有的陈皮甙对菌体产酶的抑制作用越加明显,从而使产酶量下降[21]。由图1g可知,发酵温度为30 ℃,酶活最高,为2 286.13 U/mL,显著高于其他温度时的酶活(P<0.05)。由图1h可知,发酵前期,果胶酶随着发酵时间的延长逐渐积累,到第4天达到最高值,为2 341.62 U/mL,在发酵后期,发酵体系中营养物质消耗,有害代谢产物积累,体系中酶的生成速度变慢,部分酶可能失活,酶活呈下降趋势。由图1i可知,随着初始pH值的增大,酶活呈先增加后降低的趋势,初始pH值为3时,酶活达到最高,为3 010.65 U/mL。
2.2 PB试验设计及优化
Plackett-Burman试验设计及结果见表1,其统计分析结果见表2。由表1和表2可知,发酵温度(P=0.002)、麸皮添加量(P=0.013)、发酵时间(P=0.037)对果胶酶活呈正效应均呈显著正效应,作为主要影响因素进行最陡爬坡试验和响应面设计。其他因素正效应取高水平,负效应取低水平。
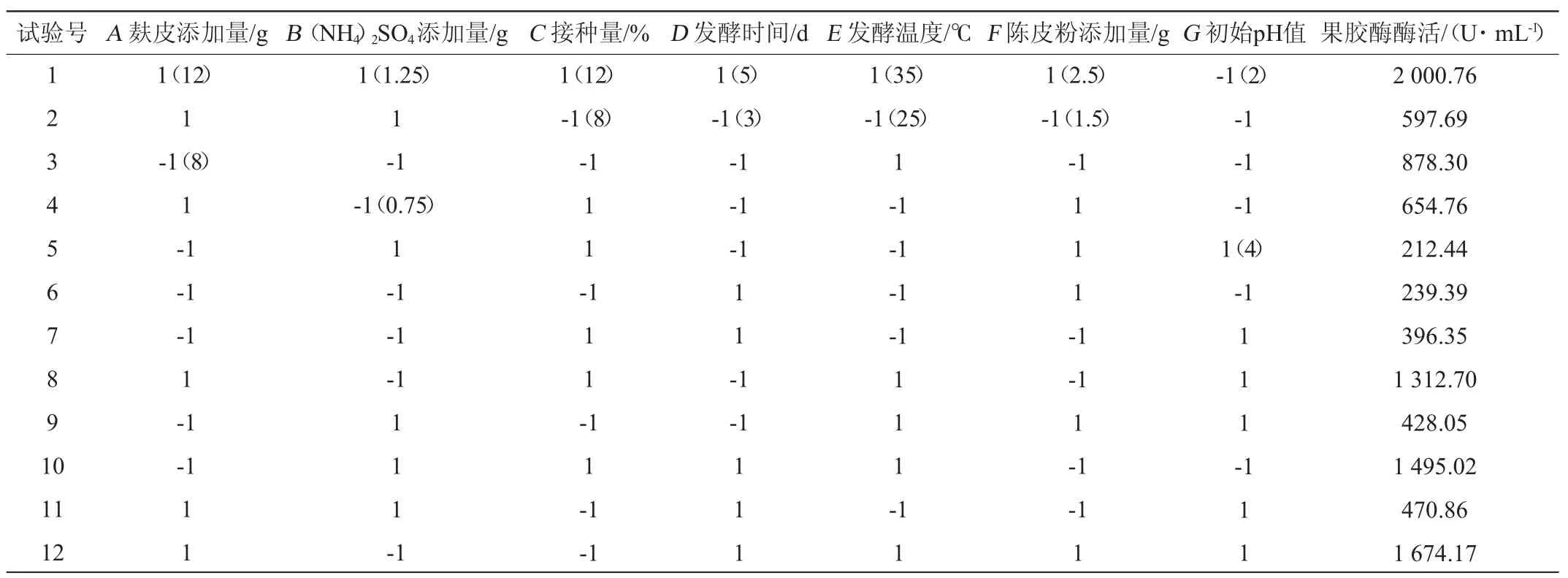
表1 Plackett-Burman试验设计与结果Table 1 Design and results of Plackett-Burman tests
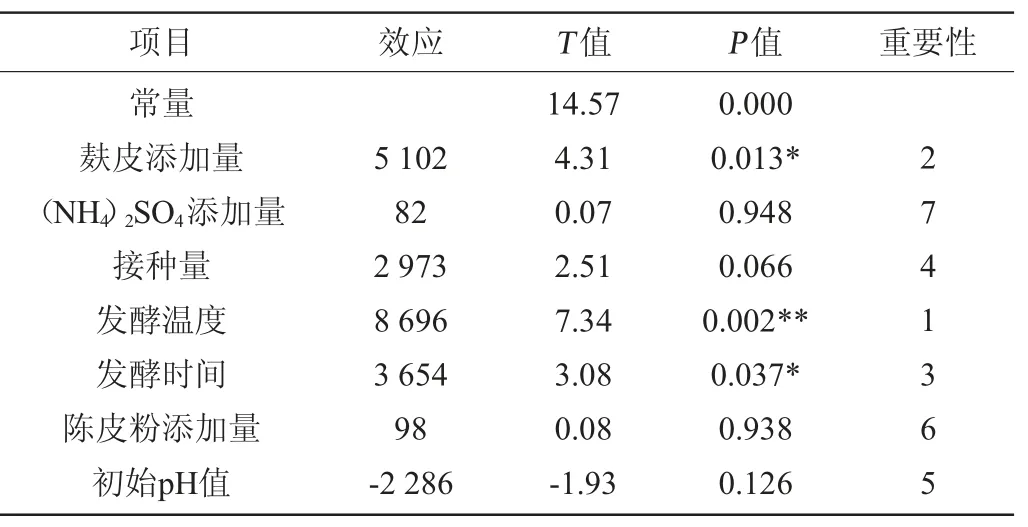
表2 Plackett-Burman试验结果对果胶酶活影响的统计分析Table 2 Statistical analysis of effect of Plackett-Burman tests results on the activity of pectinase
2.3 最陡爬坡试验
麸皮添加量、发酵时间、发酵温度均呈显著正效应,应增加,最陡爬坡试验结果见表3。由表3可知,果胶酶活在第二组达到最大值(2 388.25 U/mL)。因此,以第二组作为响应面试验的中心点。
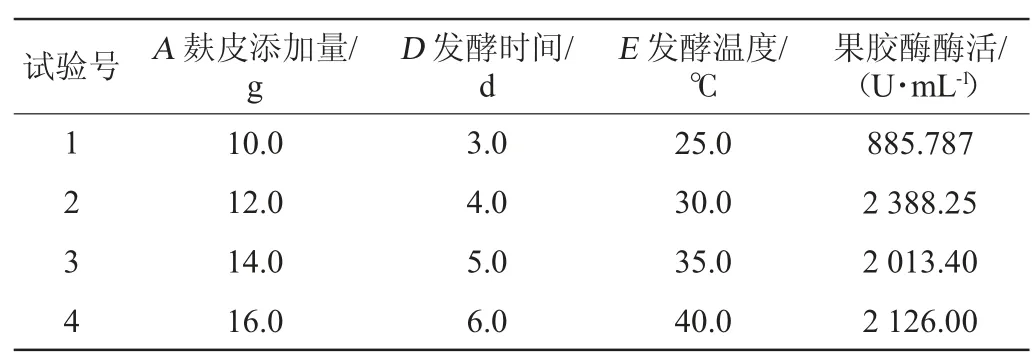
表3 最陡爬坡试验设计及结果Table 3 Design and results of the steepest ascent tests
2.4 Box-Behnken设计及结果
2.4.1 构建数学模型及模型检验
根据Plackett-Burman试验及最陡爬坡试验结果,以麸皮添加量(X1)、发酵时间(X2)、发酵温度(X3)为3个自变量,每个因素设置3个水平,果胶酶酶活(Y)为响应值,设计Box-Behnken响应面试验,Box-Behnken响应面试验因素编码、水平及结果见表4。

表4 Box-Behnken试验设计的因素、水平及结果Table 4 Factors,levels and results of Box-Behnken tests design
采用Design-Expert 8.0.6软件对表4分析,构建数学模型。通过对该模型进行方差分析,可得回归模型方差分析见表5。得到3个因素多元线性回归方程为:Y=2 468.76+264.91X1+166.93X2+192.08X3-180.98X1X2-106.22X1X3+196.82X2X3-217.04X12-571.64X22-640.97X32。对该模型进行显著性检验,二次回归模型显著(P=0.000 2<0.05),失拟项不显著(P=0.971 5>0.05),说明模型与试验拟合良好。能较好地反映发酵过程中三种因素与果胶酶活(Y)之间的准确关系,利用回归方程得出最佳的发酵条件。模型的决定系数R2=96.85%,调整决定系数R2Adj=92.80%,表明模型与试验值拟合性良好,试验误差较小,各因素与果胶酶活性之间有高度相关性,可对果胶酶的活性进行准确预测和分析。各因素对黑曲霉果胶酶活的影响次序为X1>X3>X2。除交互项X1X3外,其余的变量对Y都有显著影响。
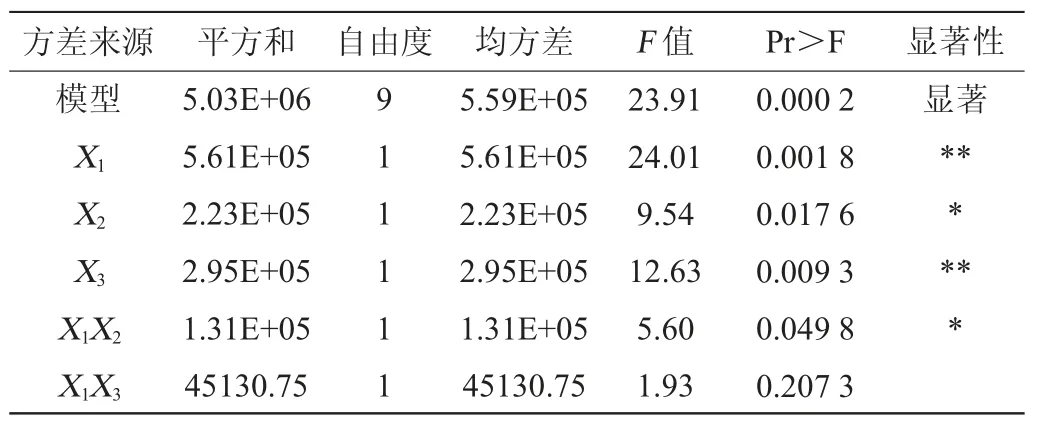
表5 回归模型方差分析Table 5 Variance analysis of regression model

续表
2.4.2 响应面曲面图
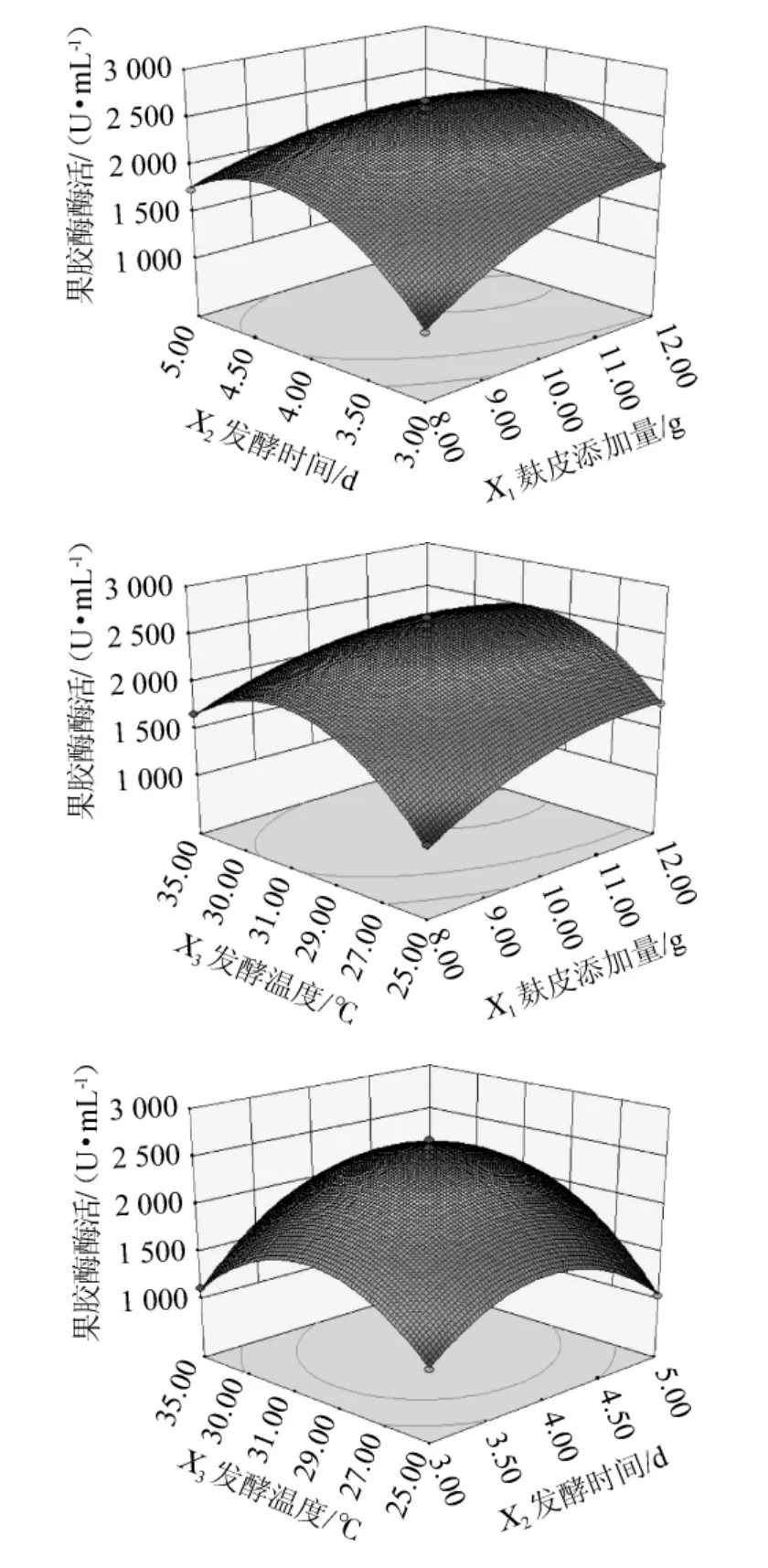
图2 麸皮添加量、发酵时间、发酵温度交互作用对果胶酶活影响的响应面曲面及等高线Fig.2 Response surface plots and contour lines of effect of interaction between bran addition,fermentation time and temperature on the activity of pectinase
由图2可知,X1X2,X2X3有明显的交互作用,特别是X2X3交互作用较显著,响应面曲线走势较陡,有明显的最高点。
2.4.3 模型验证
利用Design-Expert 8.0.6分析得出该菌株产果胶酶的最佳发酵条件:培养基添加麸皮添加量11.1 g,发酵时间为4.08 d,发酵温度为30.58 ℃,此方程预测的最大酶活可达到2 559.25 U/mL。为了操作方便,修正发酵参数为:麸皮添加量11.0 g,发酵时间为4 d,发酵温度为30 ℃。在最佳培养条件下进行了3 次重复实验,所测酶活实际值为(2 518.69±19.34)U/mL,实际值与预测值拟合度为98.41%,证实该模型有效可靠。
2.5 发酵粗酶液与市售果胶酶酶解产物中甲醇生成量的对比试验
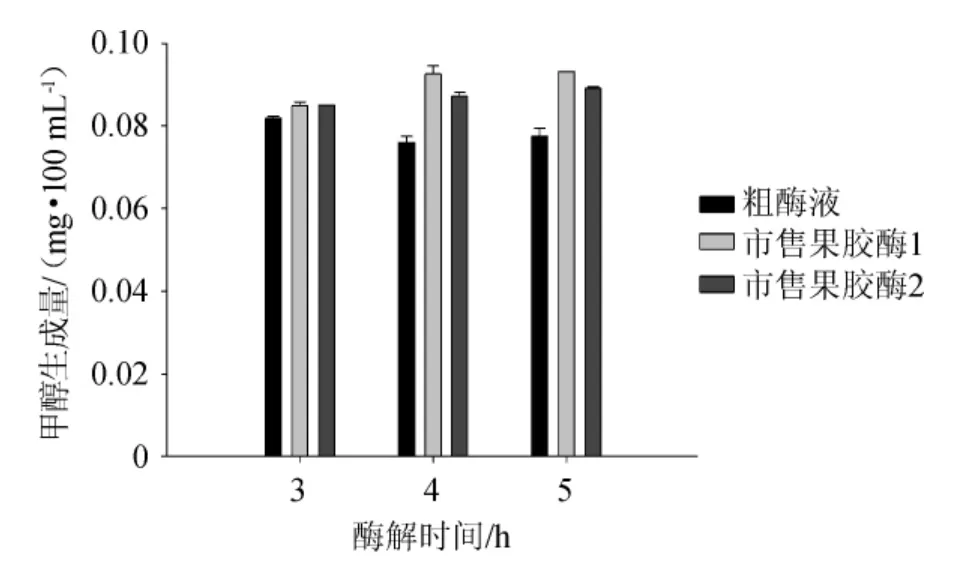
图3 粗酶液与市售果胶酶甲醇生成量的比较Fig.3 Comparison of methanol production between crude enzyme solution and commercial pectinase
由图3可知,在相同条件下进行酶促反应的第3、4、5小时时两种市售果胶酶甲醇的生成量均高于粗酶液,在酶解第4 h时,粗酶液的酶解体系中甲醇的生成量分别比市售果胶酶1和市售果胶酶2体系中低17.9%和12.8%,说明该菌株发酵生产的果胶酶在酶促反应过程中甲醇生成量较低,可应用于果胶含量较高的水果为原料的果酒生产。
3 结论
对黑曲霉SH312-26-19产果胶酶的发酵条件进行了优化。结果表明,产果胶酶的最佳发酵条件:培养基组成为11 g麸皮,H2O 15 mL,(NH4)2SO41.0 g,陈皮粉2.0 g,初始pH值为3;发酵时间为4 d,发酵温度为30℃。在此优化发酵条件下,所得的果胶酶活力为(2 518.69±19.34)U/mL,与预测值几乎吻合。粗酶液在酶促反应体系中甲醇生成量分别比市售果胶酶1和果胶酶2低17.9%和12.8%。
以上研究为黑曲霉SH312-26-19产果胶酶的机理、酶学性质研究及在果汁、果酒中的应用奠定了基础。
