清香型白酒酒醅发酵菌株分离鉴定及细菌群落结构分析
2021-02-22刘雪婷王子媛刘继明刘忠军侯强川
刘雪婷,王子媛,刘继明,刘忠军,郭 壮,侯强川*
(1.湖北文理学院 食品科学技术学院 鄂西北传统发酵食品研究所,湖北 襄阳 441053;2.湖北省石花酿酒股份有限公司,湖北 襄阳 441705)
中国白酒历史悠久,根据香型的不同可以分为浓香型白酒、清香型白酒、酱香型白酒等[1],由于酿造工艺不同,不同香型白酒的口感和风味也存在较大差异[2]。长期以来,清香型白酒因其具有的独特果香和花香风味而受到消费者喜爱。清香型白酒以高粱等谷物为主要原料,以大曲为糖化发酵剂,采用清蒸清糟酿造工艺、固态地缸发酵、蒸馏、二渣发酵和勾兑而成。清香型白酒大曲微生物组成十分复杂,除含有产淀粉酶的霉菌、合成酒精的酵母菌外,还含有丰富的细菌,如芽孢杆菌和乳酸菌等,这些微生物对于产品最终的品质起着至关重要的作用。目前,国内的学者以酒醅为研究对象,对其中的微生物群系开展了一些研究,如李欣等[3]通过高通量测序技术对酱香型白酒酒醅进行分析发现,酒醅中的优势微生物是乳杆菌属、醋酸杆菌属、青霉菌属等。杨磊等[4]通过对沉香型白酒的上下层酒醅进行分析发现上层酒醅中细菌的多样性较下层酒醅更为丰富,而乳酸杆菌属是上下层酒醅的优势细菌属,然而目前针对清香型白酒酒醅中细菌群落结构的研究尚少。
目前,研究者对环境中微生物菌株的分离主要基于传统的培养方法,而对于样品中微生物群落结构的解析则多采用基于测序技术的非培养方法[5]。传统分离培养技术对于获取样本中的细菌菌株必不可少,这是后续进一步筛选优良发酵菌株的基础。以测序技术为代表的非培养方法可以解析更多不可培养微生物,极大的提高了人们对样本中微生物群落结构的认识。在众多测序技术中,Illumina MiSeq高通量测序具有通量大、准确度高等优点[6],是目前使用最为广泛的测序技术之一,现在已经被广泛的运用于白酒[7]和腐乳[8]等发酵食品领域。
本研究从湖北省襄阳市石花酒厂中采集了5份清香型白酒酒醅样品,采用纯培养技术,对酒醅中的乳酸菌和芽孢杆菌进行了分离鉴定,同时通过Illumina MiSeq高通量测序技术解析清香型白酒酒醅细菌群落结构,为适用于清香型白酒发酵的优良菌株筛选奠定了基础。
1 材料与方法
1.1 材料与试剂
1.1.1 材料
酒醅:采集自湖北省石花酿酒股份有限公司的5份清香型白酒的酒醅样品,分别命名为SH1、SH2、SH3、SH4以及SH5;样品采集后装入采样袋并迅速置于含有冰袋的采样箱,冷链运送回实验室于24 h内完成所有样品宏基因组脱氧核糖核酸(deoxyribonucleic acid,DNA)提取。
1.1.2 试剂
QIAGEN DNeasy mericon Food Kit DNA基因组提取试剂盒:德国QIAGEN公司;MRS培养基、R2A琼脂培养基、石蕊牛乳培养基:青岛海博生物技术有限公司;引物27F/1495R和M13F(-47)/M13R(-48):武汉天一辉远生物科技有限公司。
1.2 仪器与设备
CT15RE台式冷冻离心机:日本HITACHI公司;Veriti梯度聚合酶链式反应(polymerase chain reaction,PCR)仪:美国Life公司;ND-2000C微量紫外分光光度计:美国Thermo公司;UVPCDS8000凝胶成像分析系统:美国Protein Simple公司;Illumina MiSeq高通量测序平台:美国Illumina公司;R930机架式服务器:美国Dell公司;DG250厌氧工作站:英国Don Whitley公司。
1.3 试验方法
1.3.1 乳酸菌和芽孢杆菌的分离鉴定
取10 g酒醅样品于90 mL石蕊牛乳培养基中,摇匀后置于37 ℃培养箱中培养24 h,采用倍比稀释法将富集培养后的酒醅样品用生理盐水稀释至10-3~10-6梯度,其中一份稀释样品涂布于含1%碳酸钙的MRS琼脂培养基用于乳酸菌的分离。另一份稀释液在75 ℃条件下水浴15 min,然后涂布于R2A琼脂培养基中用于芽孢杆菌的分离。将用于乳酸菌分离的固体培养基倒置于37 ℃的厌氧工作站中培养48 h(厌氧条件为85%N2,10%H2以及5%CO2),而将用于芽孢杆菌分离的固体培养基倒置于30 ℃培养箱中培养48 h。随后将固体培养基中菌落总数在30~300个的平板用于菌落挑选,尽量挑选颜色、形态和大小均不相同的单菌落,同时乳酸菌菌落需要有溶钙圈。根据三区划线法将乳酸菌和芽孢杆菌单菌落分别在MRS固体平板和R2A固体平板中连续划线3次后,将过氧化氢酶阴性及革兰氏阳性的疑似乳酸菌菌株和经过芽孢染色镜检后的疑似芽孢菌株用30%的甘油进行保存处理。分别参照李娜等[9-10]的方法,提取疑似乳酸菌和芽孢杆菌菌株DNA,并进行PCR扩增。将经过琼脂糖凝胶电泳合格的PCR样品进行纯化后寄往武汉天一辉远有限公司进行测序,将返回的测序序列通过美国国家生物技术信息中心(national center of biotechnology information,NCBI)网站进行基本局部比对搜索工具(basic localalignment search tool,BLAST)同源比对分析,并根据MEGA7.0邻接法构建系统发育树,判定目的菌株的系统发育地位。
1.3.2 宏基因组DNA的提取及Illumina MiSeq测序
参照沈馨等[11]的方法,采用QIAGEN DNeasy PowerSoil Pro Kit 基因组提取试剂盒对酒醅样品进行宏基因组DNA的提取,以其为模板,使用引物338F(5'-ACTCCTACGGGAGGCAGCAG-3')和806R(5'-GGACTACHVGGGTWTCTAAT-3')对样品16S rRNA V3-V4区域进行PCR扩增。扩增结束后,将检测合格的PCR产物寄往上海美吉生物医药科技有限公司进行Illumina MiSeq高通量测序。
1.3.3 序列质控和生物信息学分析
将返回的序列根据核苷酸标签(barcode)信息分配到各个样品中,同时去除barcode和引物。参照王玉荣等[12]的方法进行质控,去除嵌合体序列以及碱基错配序列。测序数据经过质控后,使用QIIME(V1.9.1)平台进行后续生物信息学分析。具体步骤如下:将高质量的序列进行标准比对和对齐[13],根据97%的相似度进行操作分类单元(operational taxonomic unit,OUT)聚类,去除属于嵌合体的OTU序列。使用核糖体数据库项目(ribosomal database project,RDP)classifier结合目前最常用的RDP Release 11.5[14]、Greengene(Version 13.8)[15]和Sliva(Version 132)[16]数据库进行同源性比对确定各OTU的分类学地位,使用内部脚本整合三个数据库的注释结果,确定各OTU的最终分类学地位。
1.3.4 统计分析
使用R绘制Upset图和瀑布图,使用BioEdit和MEGA7.0(http://www.megasoftware.net/)软件构建系统发育树,使用Origin(V8.6)软件完成柱形图的绘制。
2 结果与分析
2.1 乳酸菌的分离与鉴定
本研究共从5份酒醅样品中分离得到13株疑似乳酸菌菌株。所有菌株均可形成溶钙圈,经革兰氏染色呈阳性,过氧化氢酶试验为阴性。在提取菌株DNA的基础上,利用16S rRNA序列分析方法对其进行鉴定,分离株和标准菌株的系统发育树如图1所示。
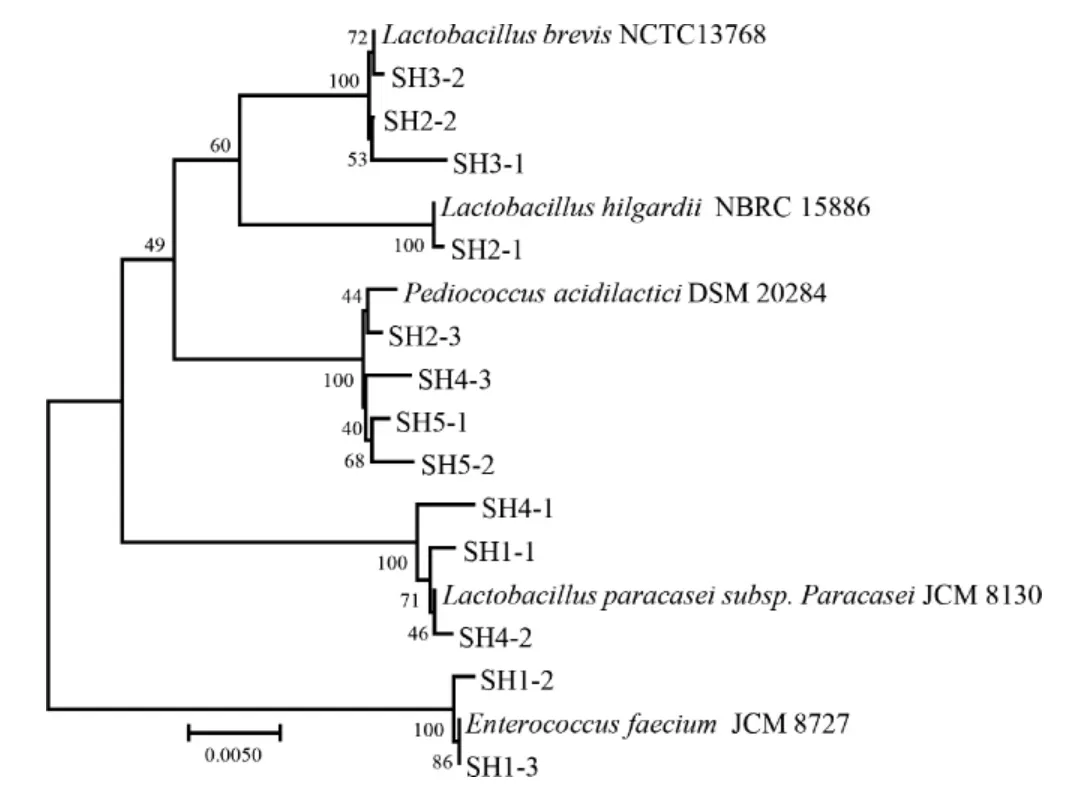
图1 基于16S rRNA基因序列13株乳酸菌与标准菌株的系统发育树Fig.1 Phylogenetic tree of 13 strains of lactic acid bacteria and standard strains based on 16S rRNA gene sequences
由图1可知,13株乳酸菌分离株分别鉴定为乳酸片球菌(Pediococcus acidilactici)4 株、副干酪乳杆菌(Lactobacillus paracasei)3 株、短乳杆菌(Lactobacillus brevis)3 株、粪肠球菌(Enterococcus faecium)2 株、希尔氏乳杆菌(Lactobacillus hilgardii)1 株,所有菌株与标准菌株的同源性均在99%以上。
2.2 芽孢杆菌的分离与鉴定
本研究共分离得到17株疑似芽孢杆菌(Bacillus)菌株,将各菌株提取DNA后,利用16S rRNA序列分析方法对其进行鉴定,分离菌株和标准菌株的系统发育树如图2所示。

图2 基于16S rRNA基因序列17株芽孢杆菌与标准菌株的系统发育树Fig.2 Phylogenetic tree of 17 strains of Bacillus and standard strains based on 16S rRNA gene sequences
由图2可知,分离得到的17株菌株分别鉴定为地衣芽孢杆菌(Bacillus licheniformis)9 株、枯草芽孢杆菌(Bacillus subtilis)2 株、短小芽孢杆菌(Bacillus pumilus)2 株、澳洲芽孢杆菌(Bacillus australimaris)2 株、解淀粉芽孢杆菌(Bacillus amyloliquefaciens)1株以及蜡样芽孢杆菌(Bacillus cereus)1株,其同源性均达到99%以上。
2.3 基于门和属水平的清香型白酒酒醅细菌群落结构分析
本研究采用Illumina MiSeq高通量测序技术对酒醅样品进行细菌群落结构评价,共产生180 749条高质量序列,平均每个酒醅样品产生36 150条序列。在细菌门水平,平均相对含量大于0.5%的细菌门在各样品中的分布如图3所示。
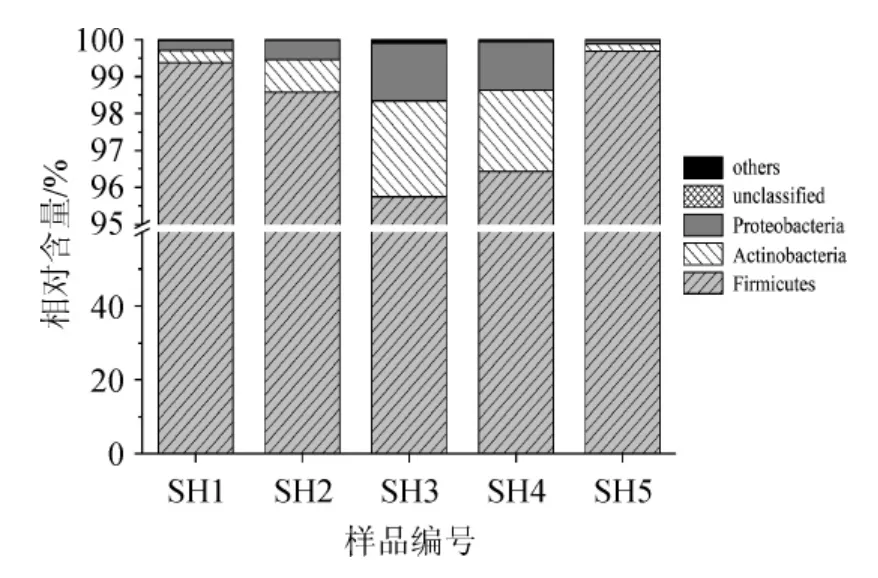
图3 优势细菌门相对含量分析Fig.3 Analysis of relative abundance of dominant bacteria phylum
由图3可知,酒醅样品中最为丰富的细菌门是厚壁菌门(Firmicutes),其相对含量为97.96%,其次分别为放线菌门(Actinobacteria)(1.24%)和变形菌门(Proteobacteria)(0.76%)。由此可见,酒醅中的厚壁菌门占绝对优势地位。进一步对优势细菌属的分布进行分析,各优势细菌属相对含量的柱形图如图4所示。

图4 优势细菌属相对含量分析Fig.4 Analysis of relative abundance of dominant bacteria genus
由图4可知,酒醅样品中的优势细菌属为乳杆菌属(Lactobacillus)、嗜热菌属(Thermoleophilum)和假单胞菌属(Pseudomonas),上述菌属的平均相对含量分别为97.42%、1.22%和0.72%。
2.4 酒醅中细菌在OTU水平的特征
在97%的条件下划分OTU并去除嵌合体后,共得到3 761个OTU。本研究将仅在某一样品中出现的OTU定义为该样品的特有OTU,将在所有样品中均出现的OTU定义为酒醅的核心OTU。OTU水平的UpSet分析如图5所示。

图5 基于OTU的UpSet分析Fig.5 UpSet analysis based on OTU
由图5可知,SH3中总的OTU数量和特有OTU数量最为丰富,其特有OTU数量为798个,其次为SH5、SH4、SH1和SH2,其数量分别为588个、557个、505个和418个。值得注意的是,酒醅中的核心OTU有280个,其中的257个核心OTU主要注释结果为乳杆菌属(Lactobacillus),另有少数OTU注释为假单胞菌属(Pseudomonas)、芽孢杆菌属(Bacillus)和嗜热菌属(Thermoleophilum),核心OTU中包含的序列占总测序序列数的96.60%。由此可见,虽然不同酒醅样品中微生物的丰度存在一定的差异,但是核心OTU组成相似,且在样品中占有较高的比例。本研究将平均相对含量大于0.5%的核心OTU定义为核心优势OTU,结果发现共有8个OTU满足该阈值条件,这些OTU在样品中的平均相对含量分析如图6所示。
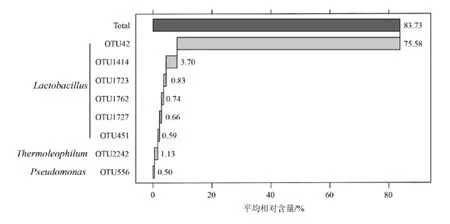
图6 基于核心优势OTU的瀑布图Fig.6 Waterfall chart based on core advantage OTU
由图6可知,酒醅样品中的核心优势OTU中的6个可以注释为乳杆菌属(Lactobacillus),另有两个OTU分别注释为嗜热菌属(Thermoleophilum)和假单胞菌属(Pseudomonas),该结果表明乳酸杆菌在清香型白酒酒醅中占据核心地位,预示着其在酒醅的发酵过程中可能起着非常重要的作用。
3 讨论
酒醅是正在发酵或已发酵好的固体物料,酒醅的质量直接决定了清香型白酒的质量。酒醅在堆积的过程中,除了利用大曲中的微生物外,还能够吸附空气以及生产环境中的微生物,这些微生物共同决定了成品酒醅中微生物群落结构。因此,全面解析清香型白酒酒醅中微生物群落结构对于后期改善清香型白酒风味和品质有重要作用。
本研究采用Illumina MiSeq高通量测序技术对清香型白酒酒醅中的微生物群落结构进行解析发现,酒醅样品中的优势细菌属为乳杆菌属(Lactobacillus)、嗜热菌属(Thermoleophilum)和假单胞菌属(Pseudomonas),上述菌属累计相对含量占细菌总数99%以上,表明乳酸菌是清香型白酒的发酵过程中的主要优势细菌。王雪山等[17]研究发现,乳杆菌属(Lactobacillus)、魏斯氏菌属(Weissella)、Kroppenstedtia和单胞菌属(Pseudomonas)是清香型白酒酒醅中的优势菌属,其中乳杆菌属(Lactobacillus)是发酵后期酒醅中的主要菌属;贾丽艳等[18]研究发现,乳杆菌属(Lactobacillus)、假单胞菌属(Pseudomonas)在山西省杏花村某酒企清香型白酒酒醅中占据优势地位,上述研究结果与本研究接近。乳酸菌是一类能利用可发酵碳水化合物产生乳酸的细菌的统称[19],不仅在人体中发挥着重要的生理功能,在白酒的发酵过程中也是不可缺少的。乳酸菌在白酒发酵过程中对杂菌生长有一定的抑制作用,此外乳酸能够和乙醇生成乳酸乙酯等风味物质,这是清香型白酒的主体风味之一[20]。酒醅中含有丰富的嗜热菌,这可能与酿酒发酵过程产生的高温环境有关,有研究发现,嗜热芽孢杆菌能够产生蛋白水解酶,为美拉德反应提供所需的氨基酸,生成香味以及香味的前体物质[21],从而在一定程度上影响发酵白酒的风味。值得注意的是,假单胞菌属(Pseudomonas)是很多清香型白酒酒醅样品中的优势菌属,该菌属多数情况是条件致病菌,但其在清香型白酒酿造中的作用尚不清楚。
本研究通过传统的分离技术从清香型酒醅样品中分离鉴定出17株芽孢杆菌。然而Illumina MiSeq高通量测序技术的结果显示,芽孢杆菌在酒醅样品中的相对含量较低,这与王雪山等[17-18]的研究结果一致。这种情况的出现可能与本研究芽孢杆菌分离过程中的水浴处理有很大关系,由于芽孢杆菌较为耐热,水浴处理后大部分芽孢杆菌可以存活,而其他细菌被杀灭,提高了芽孢杆菌分离效率。芽孢杆菌是一类广泛存在于环境中的微生物,由于其所具有的各种生理功能,已经广泛的运用于食品加工[22]和农药降解[23]等领域。现在,越来越多的研究显示,芽孢杆菌在白酒的酿造过程中占有重要的作用。芽孢杆菌的代谢产物中含有十几种风味物质以及许多重要的酯类物质[24],杨帆等[25]通过对茅台大曲中的3种芽孢杆菌进行研究发现,芽孢杆菌发酵后生成了乙偶姻、三甲基吡嗪等风味成分,具有促进大曲风味物质形成的作用。此外,芽孢杆菌能够产生蛋白酶和淀粉酶,在固态白酒的发酵过程中,能够有效的降解蛋白和纤维等物质,从而提高原料的利用率[26]。
4 结论
本研究采用Illumina MiSeq高通量测序技术以及传统纯培养的方法对清香型白酒酒醅的细菌群落进行全面解析,发现其优势细菌属为乳杆菌属(Lactobacillus)、嗜热菌属(Thermoleophilum)和单胞菌属(Pseudomonas),丰富了人们对清香型白酒酒醅细菌群落结构的认识。所有酒醅样品共分离得到13株乳酸菌以及17株芽孢杆菌,这为后续筛选适用于清香型白酒发酵的优良菌株奠定了一定基础。
