冬凌草甲素对人宫颈癌HeLa细胞线粒体凋亡途径的影响*
2021-02-22张亚男张子旸刘海英王书惠
张亚男,张子旸,刘海英,王书惠
(牡丹江医学院附属红旗医院,黑龙江 牡丹江157011)
宫颈癌是最常见的危害妇女健康及生命的主要恶性肿瘤之一,因极高的病死率而备受国内外研究者的关注。据国际癌症研究中心统计,2013年全球宫颈癌新发病例约48.5 万,死亡病例约23.6 万,其中发展中国家约占85%[1]。有研究数据表明,我国宫颈癌发病率为12.96/10 万,病死率为3.28/10 万,且发病率和病死率均随年龄的增长而增加[2]。宫颈癌的主要病因可能与人乳头瘤病毒感染有关,其他如机体免疫功能低下、吸烟与被动吸烟、口服避孕药、人工流产次数过多、性伴侣过多、丈夫包皮过长、早婚、结婚次数过多、多产及初产年龄过早均可成为诱发宫颈癌危险因素[3-5]。近年来,中药以其有效低毒的优势作为治疗肿瘤的替代疗法日益得到人们的重视。冬凌草甲素是冬凌草的主要有效成分,为二萜类化合物。除冬凌草外,同属植物蓝萼香茶菜、毛叶香茶菜等亦可分离出冬凌草甲素。现代药理研究表明,冬凌草甲素具有较强的抗肿瘤活性[6],可以治疗胰腺癌[7]、卵巢癌[8]、食管癌[9]、肝癌[10]、肺癌[11]、乳腺癌[12]、前列腺癌[13]、直肠癌等[14]。研究表明,冬凌草甲素亦可诱导人宫颈癌HeLa 细胞凋亡[15]。但是冬凌草甲素诱导HeLa 细胞凋亡的机制研究较少。本研究采用体外培养HeLa 细胞,探讨线粒体凋亡途径在冬凌草甲素诱导HeLa 细胞中的作用。
1 材料与方法
1.1 主要试剂与仪器
冬凌草甲素(中国科学院昆明植物研究所),二甲基亚砜(DMSO,终浓度≤0.01%)(上海浩然生物技术有限公司),RPMI 1640 培养基(美国Gibco公司),胎牛血清(FBS)和胰蛋白酶(北京元亨圣马生物技术研究所),CCK-8 试剂盒(美国Abbkine公司),TUNEL 检测试剂盒和Annexin V-FITC/PI 试剂盒(南京凯基生物有限公司),碘化丙锭(PI)(美国Axygen 公司),JC-1 检测试剂盒(上海容创生物技术有限公司),兔抗人细胞色素c(Cyt c)抗体、兔抗人B 细胞淋巴瘤-2 因子(Bcl-2)抗体和兔抗人Bcl-2 相关X 蛋白(Bax)抗体(美国Cell Signal 公司),半胱氨酸蛋白酶-3(Caspase-3)和半胱氨酸蛋白酶-9(Caspase-9)活性测定试剂盒(北京纽朴生物技术有限公司)。Model 311 型二氧化碳培养箱(美国Thermo Scientific 公司),FC-500 流式细胞仪(美国Beckman 公司),BX43 荧光显微镜(日本Olympus 公司),Bio-Tek ELX800 型多功能酶标仪(美国BIO-RAD 公司),Tanon 5200 Multi 图像分析系统(上海天能科技公司)。
1.2 细胞培养
人宫颈癌HeLa 细胞(美国ATCC)接种于含10%热灭活FBS、2%谷氨酰胺、100 u/ml 青霉素和100 μg/ml 链霉素的RPMI 1640 培养液中,在37℃、5%二氧化碳培养箱中培养。每48 h 更换新鲜培养液,待细胞融合度达80%时,用0.25%胰蛋白酶消化传代。
1.3 方法
1.3.1 CCK-8 检测HeLa 细胞活力检测方法参照CCK-8 试剂盒操作说明书进行。将处于对数生长期的HeLa 细胞按4×106个/ml 接种于96 孔培养板,100 μl/孔,设6 个复孔,培养箱中培养。待细胞贴壁后向各培养孔中加不同浓度的冬凌草甲素100 μl,浓度分别为5 μmol/L、10 μmol/L、25 μmol/L、50 μmol/L、100 μmol/L。空白对照孔加入等体积不含冬凌草甲素的RPMI 1640 培养液。分别培养12 h、24 h、36 h、48 h后终止培养。向各培养孔中加入10 μl CCK-8,继续培养4 h。于酶标仪450 nm 波长处测定光密度(OD)值,计算细胞活力,并应用Bliss 法计算IC50值。
1.3.2 Annexin V-FITC/PI 双染法检测HeLa 细胞凋亡参照Annexin V-FITC/PI 试剂盒操作说明书进行操作。待HeLa 细胞贴壁后向各培养孔中加入5 μmol/L、10 μmol/L、25 μmol/L 冬凌草甲素,空白对照孔加入等体积不含冬凌草甲素的RPMI 1640培养液,培养24 h。胰蛋白酶消化,1 200 r/min 离心5 min,收集细胞,PBS 洗涤2 次,250 μl 结合缓冲液重悬细胞,各培养孔依次加入Annexin V-FITC 和PI 液各5 μl 混匀,室温避光反应15 min。采用流式细胞仪检测细胞凋亡,计算凋亡率。
1.3.3 TUNEL 染色检测HeLa 细胞凋亡参照TUNEL 试剂盒操作说明书进行检测。分组及给药同1.3.2。弃培养基,PBS 洗涤2 次,4%多聚甲醛固定后,PBS 洗涤3 次,各培养孔加入50 μl TUNEL反应液,避光37℃培养1 h,PBS 洗涤3次,Hoechst 33258 染料37℃避光染色10 min,中性树胶封片,BX43 荧光显微镜观察细胞核形态,计算凋亡指数。
1.3.4 JC-1 染色检测HeLa 细胞Δψm参照JC-1试剂盒操作说明书进行检测。吸取500 μl RPMI 1640 培养液,加入1 μl JC-1,涡旋混匀,37℃孵育,配成JC-1 工作液。分组及给药同1.3.2。弃去培养基,PBS 洗涤2 次,各培养孔加入1 ml JC-1,培养20 min。弃去培养基,PBS 洗涤2 次,各培养孔加入RPMI 1640 培养液。采用荧光显微镜观察绿色和红色荧光。如Δψm 较低,JC-1 为单体,不能聚集在线粒体基质中,则发出绿色荧光;如Δψm 较高,JC-1 以聚合物形式聚集在线粒体基质中,则发出红色荧光。计算绿色/红色荧光,以绿色/红色荧光代表Δψm;绿色/红色荧光升高表示Δψm 下降;绿色/红色荧光降低表示Δψm 升高。
1.3.5 Western blotting 检测HeLa 细胞Cyt c、Bcl-2和Bax的表达分组及给药同1.3.2。1 200 r/min离心5 min,收集细胞,充分裂解后提取总蛋白,用BCA法测定蛋白相对表达量。以10%十二烷基硫酸钠-聚丙烯酰胺预制凝胶,各培养孔加入50 μg蛋白样品进行电泳。常规转膜后5%脱脂奶粉封闭2 h。分别与Ⅰ抗兔抗人Cyt c 多克隆抗体(1∶500)、兔抗人Bcl-2 多克隆抗体(1∶500)和兔抗人Bax 多克隆抗体(1∶500)4℃孵育过夜,PBST 洗脱10 min/次,共3 次,洗膜后加辣根过氧化酶标记山羊抗兔Ⅱ抗孵育2 h,TBST 洗脱,5 min/次,共3 次,加入电化学发光试剂显影,Tanon 5200 Multi图像分析系统进行图像采集,以GAPDH作为内参。
1.3.6 Caspase-3 和Caspase-9 活性检测参照Caspase-3 和Caspase-9 活性测定试剂盒操作说明书进行检测。分组及给药同1.3.2,细胞裂解同1.3.5。吸取50 μl 细胞裂解上清液,加入50 μl 2×反应缓冲液,分别加入5 μl Caspase-3 和Caspase-9 底物,37℃避光孵育4 h。于酶标仪405 nm 波长处测定OD值,计算Caspase-3 和Caspase-9 活性。
1.4 统计学方法
数据分析采用SPSS 21.0 统计软件。计量资料以均数±标准差(±s)表示,比较用单因素方差分析或重复测量设计的方差分析,进一步两两比较用LDS-t检验,P<0.05 为差异有统计学意义。
2 结果
2.1 冬凌草甲素对HeLa细胞活力的影响
各实验组与空白对照组12 h、24 h、36 h、48 h的HeLa 细胞活力比较,采用重复测量设计的方差分析,结果:①不同时间点HeLa细胞活力有差异(F=31.457,P=0.000);②各组HeLa 细胞活力有差异(F=273.936,P=0.000),随着冬凌草甲素浓度增加,HeLa细胞活力降低;③各组HeLa细胞活力变化趋势有差异(F=27.837,P=0.000)(见表1)。冬凌草甲素处理12 h、24 h、36 h、48 h 的IC50为95.63 μmol/L、32.24 μmol/L、19.58 μmol/L和4.13 μmol/L。因24 h IC50>25 μmol/L,故以≤25 μmol/L(即5 μmol/L、10 μmol/L、20 μmol/L)为冬凌草甲素处理浓度,处理24 h用于后续实验。
表1 各组不同时间点HeLa细胞活力的比较 (n=6,%,±s)
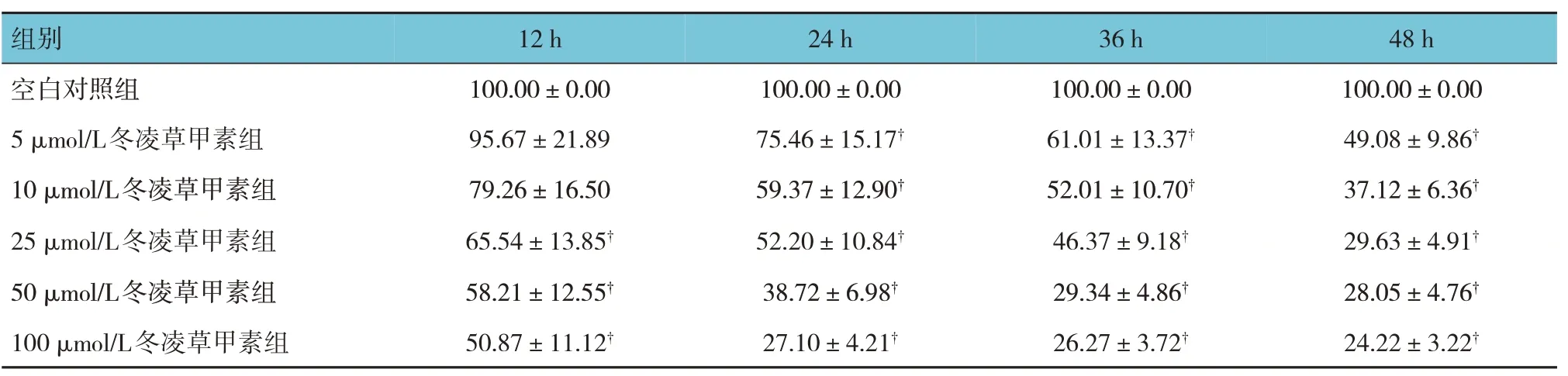
表1 各组不同时间点HeLa细胞活力的比较 (n=6,%,±s)
注:†与空白对照组比较,P <0.05。
组别48 h 12 h 24 h 36 h空白对照组5 μmol/L冬凌草甲素组10 μmol/L冬凌草甲素组25 μmol/L冬凌草甲素组50 μmol/L冬凌草甲素组100 μmol/L冬凌草甲素组100.00±0.00 49.08±9.86†37.12±6.36†29.63±4.91†28.05±4.76†24.22±3.22†100.00±0.00 95.67±21.89 79.26±16.50 65.54±13.85†58.21±12.55†50.87±11.12†100.00±0.00 75.46±15.17†59.37±12.90†52.20±10.84†38.72±6.98†27.10±4.21†100.00±0.00 61.01±13.37†52.01±10.70†46.37±9.18†29.34±4.86†26.27±3.72†
2.2 冬凌草甲素对HeLa细胞凋亡的影响
2.2.1 各组HeLa 细胞凋亡率比较各组HeLa 细胞凋亡率比较,经方差分析,差异有统计学意义(F=14.018,P=0.002);与空白对照组比较,5 μmol/L、10 μmol/L、25 μmol/L 冬凌草甲素组HeLa 细胞凋亡率升高(P<0.05)。见图1和表2。
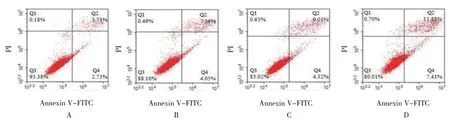
图1 冬凌草甲素诱导HeLa细胞凋亡的流式细胞图
2.2.2 TUNEL染色结果各组HeLa细胞凋亡指数比较,经方差分析,差异有统计学意义(F=16.061,P=0.000);与空白对照组比较,5 μmol/L、10 μmol/L、25 μmol/L冬凌草甲素组HeLa细胞凋亡指数升高(P<0.05)。见表2和图2。
2.3 冬凌草甲素对HeLa细胞Δψm的影响
各组HeLa细胞绿色/红色荧光比较,差异有统计学意义(P<0.05);与空白对照组比较,5 μmol/L、10 μmol/L、25 μmol/L 冬凌草甲素组HeLa 细胞绿色/红色荧光升高(P<0.05)。提示冬凌草甲素可降低HeLa细胞Δψm。见表3和图3。
表2 各组HeLa细胞凋亡率和凋亡指数比较(n=6,±s)
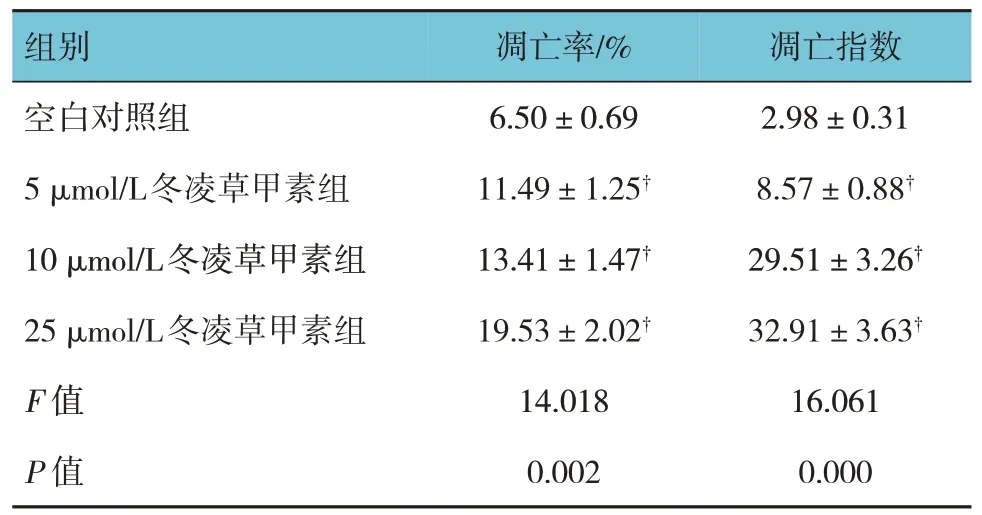
表2 各组HeLa细胞凋亡率和凋亡指数比较(n=6,±s)
注:†与空白对照组比较,P <0.05。
组别凋亡指数凋亡率/%空白对照组5 μmol/L冬凌草甲素组10 μmol/L冬凌草甲素组25 μmol/L冬凌草甲素组F 值P 值2.98±0.31 8.57±0.88†29.51±3.26†32.91±3.63†16.061 0.000 6.50±0.69 11.49±1.25†13.41±1.47†19.53±2.02†14.018 0.002
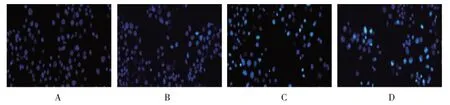
图2 冬凌草甲素诱导HeLa细胞凋亡 (TUNEL染色×200)
表3 各组HeLa细胞Δψm的比较(n=6,±s)
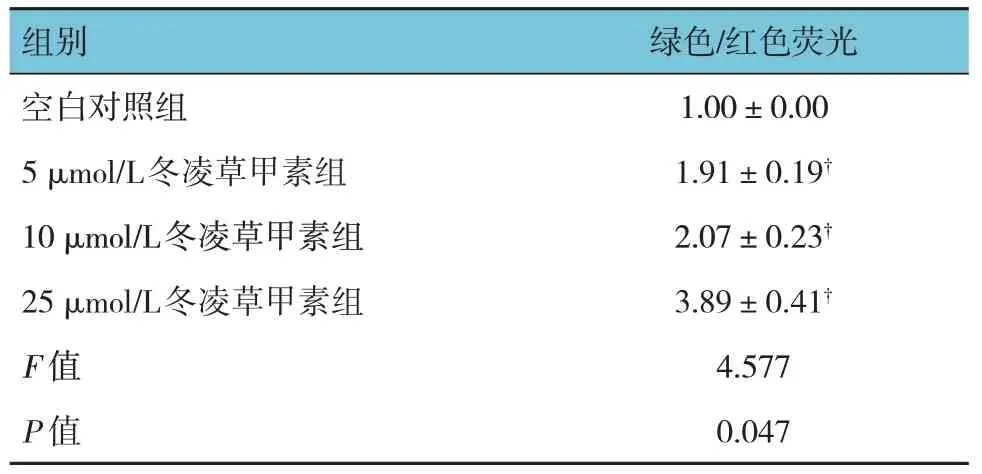
表3 各组HeLa细胞Δψm的比较(n=6,±s)
注:†与空白对照组比较,P <0.05。
组别绿色/红色荧光空白对照组5 μmol/L冬凌草甲素组10 μmol/L冬凌草甲素组25 μmol/L冬凌草甲素组F 值P 值1.00±0.00 1.91±0.19†2.07±0.23†3.89±0.41†4.577 0.047
2.4 冬凌草甲素对HeLa细胞凋亡相关因子Cyt c、Bcl-2、Bax表达的影响
各组HeLa 细胞Cyt c、Bcl-2、Bax 相对表达量比较,差异有统计学意义(P<0.05);与空白对照组比较,5 μmol/L、10 μmol/L、25 μmol/L 冬凌草甲素组HeLa 细胞Cyt c、Bax 表达升高(P<0.05),Bcl-2、Bcl-2/Bax 降低(P<0.05)。见表4和图4。
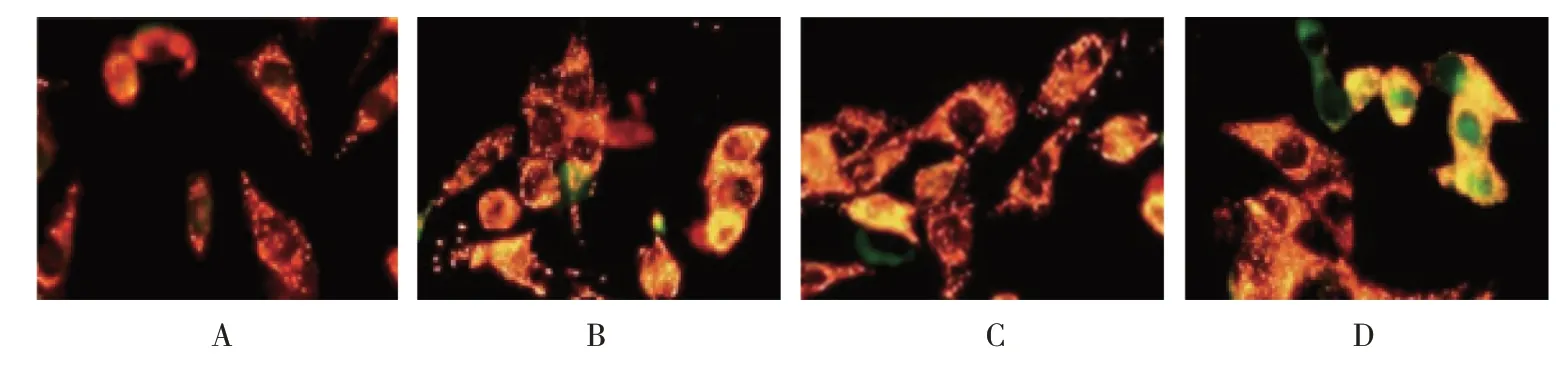
图3 冬凌草甲素对HeLa细胞Δψm的影响 (JC-1染色×400)
表4 各组HeLa细胞Cyt c、Bcl-2、Bax、Bcl-2/Bax相对表达量比较 (n=6,±s)
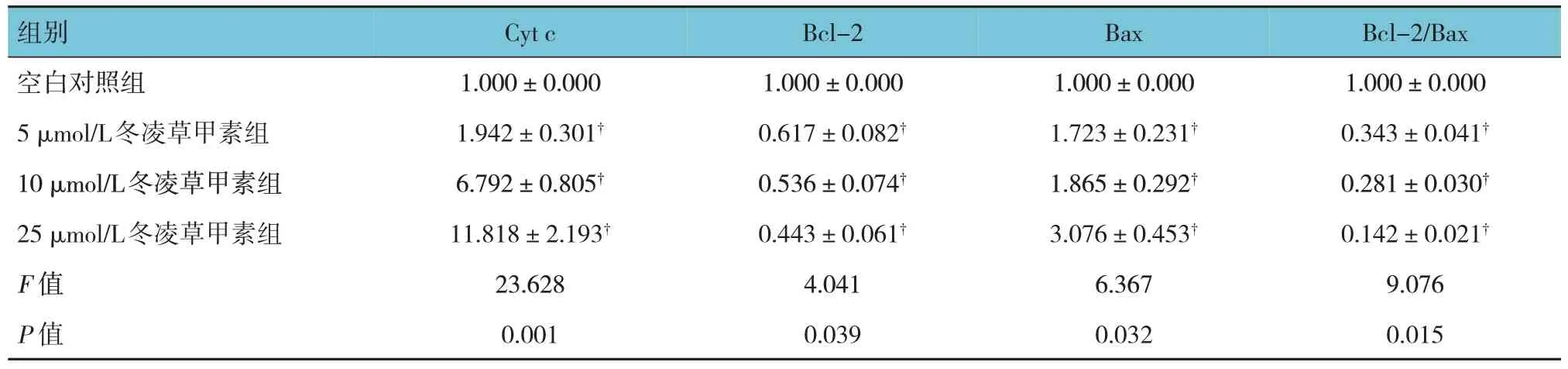
表4 各组HeLa细胞Cyt c、Bcl-2、Bax、Bcl-2/Bax相对表达量比较 (n=6,±s)
注:†与空白对照组比较,P <0.05。
组别Bcl-2/Bax Cyt c Bcl-2 Bax空白对照组5 μmol/L冬凌草甲素组10 μmol/L冬凌草甲素组25 μmol/L冬凌草甲素组F 值P 值1.000±0.000 0.343±0.041†0.281±0.030†0.142±0.021†9.076 0.015 1.000±0.000 1.942±0.301†6.792±0.805†11.818±2.193†23.628 0.001 1.000±0.000 0.617±0.082†0.536±0.074†0.443±0.061†4.041 0.039 1.000±0.000 1.723±0.231†1.865±0.292†3.076±0.453†6.367 0.032
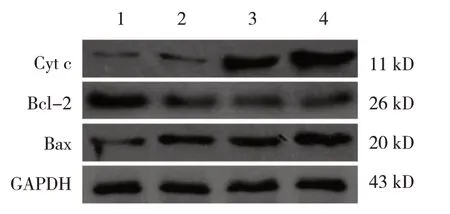
图4 冬凌草甲素对HeLa细胞Cyt c、Bcl-2、Bax蛋白表达的影响
2.5 冬凌草甲素对HeLa 细胞Caspase-3、Cas‐pase-9活性的影响
各组HeLa 细胞Caspase-3、Caspase-9 活性比较,差异有统计学意义(P<0.05);与空白对照组比较,5 μmol/L、10 μmol/L、25 μmol/L 冬凌草甲素组Caspase-3、 Caspase-9 活性升高(P<0.05)。见表5。
表5 各组HeLa细胞Caspase-3、Caspase-9活性比较(n=6,%,±s)
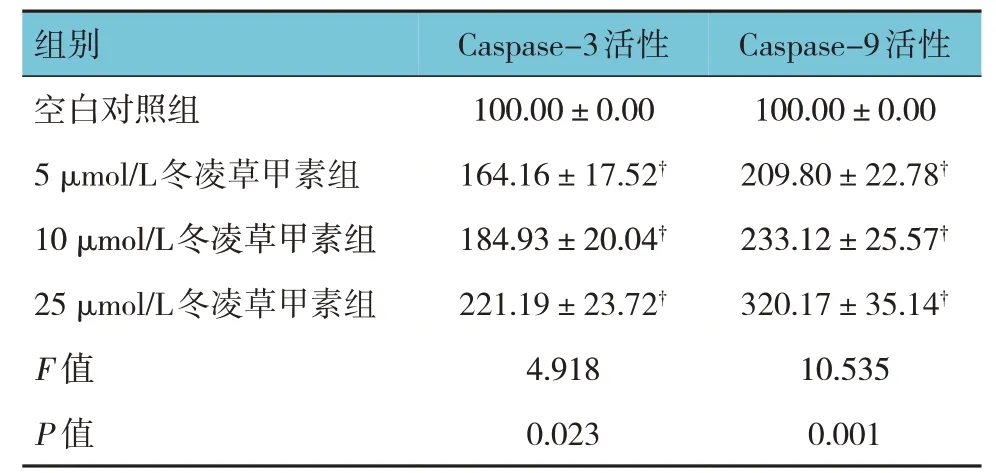
表5 各组HeLa细胞Caspase-3、Caspase-9活性比较(n=6,%,±s)
注:†与空白对照组比较,P <0.05。
?
3 讨论
细胞凋亡在维持体内细胞或组织平衡中发挥着关键作用,凋亡缺陷是肿瘤发病的重要病因学基础[16-17]。本研究结果显示,冬凌草甲素具有明显的诱导HeLa 细胞凋亡的作用。另外,本研究结果亦显示,冬凌草甲素呈剂量-时间依赖效应抑制HeLa 细胞活力。以上结果与以往研究结果相类似[15,18]。
肿瘤细胞的生长速度一般难以控制,这可能与细胞的增殖能力较强和凋亡能力的减弱有关。细胞凋亡途径根据启动过程包括线粒体凋亡途径、死亡受体凋亡途径及内质网凋亡途径,特别是线粒体凋亡途径在介导细胞凋亡中承担重要角色[19]。线粒体是凋亡信号转导途径中起关键调节作用的细胞器,在凋亡过程中具有重要的调控作用,而线粒体损伤造成Δψm 下降是细胞启动凋亡的一个特征性标志,为细胞凋亡级联反应过程中最早发生的事件之一[20-21]。本研究结果显示,冬凌草甲素可显著降低HeLa 细胞Δψm。以上结果初步提示,凌草甲素诱导HeLa 细胞凋亡的机制可能与线粒体凋亡途径有关。
Cyt c是位于线粒体中的一种水溶性小分子物质,具有调节能量代谢和调节细胞凋亡的功能,为线粒体凋亡途径的关键调控蛋白之一[22]。Caspase 蛋白家族是细胞凋亡中发挥关键作用的一组半胱氨酸蛋白酶,一旦被凋亡触发因素激活,就能降解细胞内蛋白而引起细胞凋亡[23]。Caspase-3 活化是诱导细胞凋亡的关键核心步骤,Caspase-3 活化离不开其上游因子Caspase-8 或Caspase-9 的激活[24]。Cyt c无法穿过线粒体外膜,因此细胞质中无法检测到。如果Δψm降低,线粒体膜通透性则会增强,Cyt c 可穿过外膜释放到胞质中,催化Caspase-9 前体形成有活性的Caspase-9,进而激活执行细胞凋亡的Caspase-3的活性导致细胞凋亡。Bcl-2 是公认的细胞凋亡调控靶点,大多定位于线粒体外膜上,可以通过与Bax 拮抗,抑制Bax 游离的数量。降低Bcl-2 蛋白表达,会促使Bax 转位到线粒体膜,进而增强线粒体通透性,释放Cyt c,激活Caspase-3的级联反应,从而促进细胞凋亡[25-26]。Bcl-2/Bax 比值决定Caspase-3 的激活程度,比值越低,激活程度越高。本研究结果显示,冬凌草甲素可显著升高HeLa 细胞Cyt c 和Bax 表达,降低Bcl-2、Bcl-2/Bax。本研究结果亦显示,冬凌草甲素可显著升高HeLa 细胞Caspase-3 和Caspase-9 活性。综上所述,冬凌草甲素诱导HeLa 细胞凋亡的机制可能与线粒体凋亡途径激活有关。
