金雀异黄素联合顺铂对SK-OV-3人卵巢腺癌细胞生物学行为影响的研究
2021-02-22张艺檬张丽雅
张艺檬,张丽雅
(1.锦州医科大学研究生学院,辽宁 锦州121000 ;2.锦州医科大学附属第一医院妇产科,辽宁 锦州121000)
卵巢癌是最常见的女性生殖系统恶性肿瘤之一,其发病隐匿且早期缺乏典型症状,晚期又无有效的根治性手段,因此卵巢癌死亡率为妇科恶性肿瘤之首[1]。目前,传统的根治性手术加放化疗仍是卵巢癌治疗的主要手段。顺铂是临床常见的化疗药物之一,其耐药性及毒副作用导致卵巢癌的治愈率低,复发率高[2]。因此,提高现有化疗药物的敏感性或开发新的强效化疗药物显得尤为重要。研究显示,金雀异黄素具有广泛的抗肿瘤药理活性,能通过多种途径抑制肿瘤的生长和转移,并使细胞核中的药物浓度大幅增加,DNA 链断裂增多,药效提高[3],已应用于宫颈癌[4]、肺癌[5]、前列腺癌[6]、卵巢癌[7]的治疗。有研究证实黄连素[8]、复方大七气汤[9]、莪术油[10]等联合顺铂对卵巢癌细胞具有促凋亡作用,但尚未见金雀异黄素联合顺铂治疗卵巢癌的相关研究。本研究通过观察金雀异黄素联合顺铂对卵巢癌细胞SKOV3 生物学行为的影响,探讨其可能的抗肿瘤作用机制,为卵巢癌的预防及探讨新的、高效的临床治疗药物和手段提供实验依据。
1 材料与方法
1.1 试剂与仪器
SK-OV-3 人卵巢腺癌细胞(广州吉妮欧生物科技有限公司),金雀异黄素、顺铂(质量分数>99%,美国APE x BIO公司),低内毒素胎牛血清(杭州四季青生物工程材料有限公司),0.25%胰蛋白酶(美国Thermo Fisher Scientific公司),二甲基亚砜、三乙醇胺、TBST缓冲液、Hoechst33342荧光染色试剂盒(北京索莱宝科技有限公司),McCoy's 5A培养基(武汉博士德生物工程有限公司),AnnexinV-FITC/PI细胞凋亡检测试剂盒、磷脂酰肌醇-3-激酶(PI3K)、苏氨酸蛋白激酶(Akt)、p-Akt、Bax、Bcl-2、Caspase-3、β-actin一抗抗体(沈阳万类生物科技有限公司)。全自动酶联免疫分析仪(瑞士TECAN公司),恒温恒湿培养箱(上海一恒Blue pard公司),离心机(湖南Cence湘仪公司),流式细胞仪(美国BD公司),电泳仪(美国BIO-RAD公司),-80℃冰箱(美国Thermo Fisher Scientific公司),倒置荧光显微镜(日本Olympus公司)。
1.2 方法
1.2.1 细胞培养将SK-OV-3 人卵巢腺癌细胞用含有10%胎牛血清的McCoy's 5A 培养液(链霉素100 mg/L,青霉素100 u/ml)培养于37℃、5% 二氧化碳培养箱内,待贴壁细胞浓度达80%~90%时,用胰蛋白酶消化并传代,维持细胞处于对数生长期备用。
1.2.2 偶氮唑蓝(MTT)法测定金雀异黄素及顺铂的最佳给药剂量取对数生长期的SK-OV-3 人卵巢腺癌细胞制成单细胞悬液,按每孔细胞密度5×104个/ml接种到96孔培养板中,边缘孔加入PBS缓冲液,设置空白调零为对照组。将96孔板放于37℃、5%二氧化碳培养箱中培养24 h,实验组分别单独加入不同浓度的金雀异黄素(20 μmol/L、40 μmol/L、80 μmol/L、160 μmol/L、200 μmol/L)和顺铂(1 μg/ml、2 μg/ml、4 μg/ml、8 μg/ml、16 μg/ml)。放置培养箱中继续培养24 h、48 h、72 h后收集细胞进行MTT检测。在酶联免疫检测仪490 nm波长处测定各孔的光密度(OD)值。计算SK-OV-3 人卵巢腺癌细胞生长抑制率(IR)。IR=(1-实验组平均OD值/对照组平均OD值)×100%,每组设置3个重复孔,实验重复3次。
1.2.3 实验分组将SK-OV-3 人卵巢腺癌细胞分为空白组、金雀异黄素组、顺铂组和联合用药组。空白组:McCoy's 5A 培养液培养细胞48 h;金雀异黄素组:用含终浓度为160 μmol/L 金雀异黄素的培养液培养细胞48 h;顺铂组:用含终浓度为4 μg/ml顺铂的培养液培养细胞48 h;联合用药组:用含终浓度160 μmol/L 金雀异黄素和4 μg/ml 顺铂的培养液培养细胞48 h。
1.2.4 细胞划痕实验取对数生长期的SK-OV-3人卵巢腺癌细胞制成单细胞悬液,细胞计数以1×106个/孔接种到6孔板内。置于培养箱内培养24 h,待细胞融合度达80%~90%后,用100 μl枪头垂直于均匀移液器吸嘴,对准6 孔板下端中央部位向上轻推形成划痕,PBS冲洗2、3次,充分洗去刮擦下来的细胞。按空白组、金雀异黄素组、顺铂组和联合用药组加入培养液和不同浓度的药物继续培养,各设3 个复孔,48 h后对细胞进行观察并拍照。划痕愈合率=(1-处理后划痕宽度/处理前划痕宽度)×100%。
1.2.5 Hoechest33342荧光染色法检测细胞凋亡取对数生长期的SK-OV-3 人卵巢腺癌细胞制成单细胞悬液,细胞计数以2×104个/孔接种于24孔板中,每孔1 ml,置于37℃、5%二氧化碳培养箱中培养24 h,待细胞融合度达80%~90%后处理各组细胞48 h,根据Hoechest33342 荧光染色试剂盒说明书操作,用荧光显微镜检测SK-OV-3 细胞形态。活细胞染色后呈现均匀弥散的淡蓝色荧光,凋亡细胞的细胞核或细胞质内呈现浓染致密的颗粒块状亮蓝色荧光。随机选取6个视野拍照,实验重复3次。
1.2.6 流式细胞术检测细胞凋亡率将处于对数生长期且生长良好的SK-OV-3 人卵巢腺癌细胞收集接种于6 孔板中,大约含细胞5×105个/孔。待细胞完全贴壁且状态良好后处理各组细胞,48 h 后收集细胞制成单细胞悬液,按Annexin V-FITC/PI 细胞凋亡检测试剂盒说明书步骤操作,用流式细胞仪检测,散点图的Q1象限代表非活细胞,Q2象限代表晚期凋亡细胞,Q3象限代表活细胞,Q4象限代表早期凋亡细胞。总凋亡率=早期凋亡率+晚期凋亡率,实验重复3次。
1.2.7 Western blotting 检测SK-OV-3人卵巢腺癌细胞凋亡相关蛋白的表达收集处理后的各组细胞,用预冷的PBS缓冲液洗细胞2次,加入预冷的裂解液100 μl处理细胞,并低温放置30 min后置于离心机中,4℃12 000 r/min 高速离心20 min,收集上清液后采用BCA蛋白定量检测法检测上清液中的蛋白含量。采用湿转膜法将目标蛋白转移至PVDF膜上,再用5%脱脂奶粉封闭2 h,按1∶1 000 比例稀释加入一抗Akt、p-Akt、PI3K、Caspase-3、Bax、Bcl-2 置于4℃摇床上孵育过夜,β-actin 为对照。TBST缓冲液洗涤3次后加入稀释后的二抗,室温孵育2 h,经TBST缓冲液洗涤3次后,将显影液均匀滴在PVDF膜上,放入凝胶成像系统显影并用Image J软件分析条带灰度值。
1.3 统计学方法
数据分析采用SPSS 22.0 统计软件,计量资料以均数±标准差(±s)表示,比较用单因素方差分析,两两比较采用LSD-t检验,P<0.05 为差异有统计学意义。
2 结果
2.1 金雀异黄素、顺铂单独用药对SK-OV-3人卵巢腺癌细胞凋亡的影响
与对照组比较,随着金雀异黄素浓度增加,作用时间延长,细胞生长抑制率提高(P<0.05)。160 μmol/L 金雀异黄素作用SK-OV-3 细胞48 h,细胞生长抑制率为(51.0±1.7)%(见图1)。与对照组比较,随着顺铂质量浓度的增加,作用时间的延长,细胞生长抑制率提高(P<0.05),但在72 h质量浓度为16 μg/ml 时生长抑制率降低,4 μg/ml顺铂作用SK-OV-3 细胞48 h 的细胞生长抑制率为(48.5±3.5)%(见图2)。本实验选择160 μmol/L 金雀异黄素、4 μg/ml顺铂,进行后续实验。
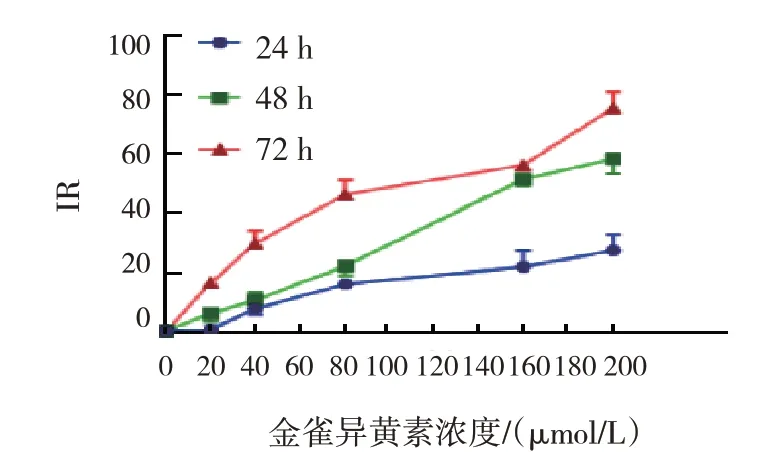
图1 不同浓度金雀异黄素作用于SK-OV-3细胞的抑制率比较
2.2 各组SK-OV-3细胞迁移能力的比较
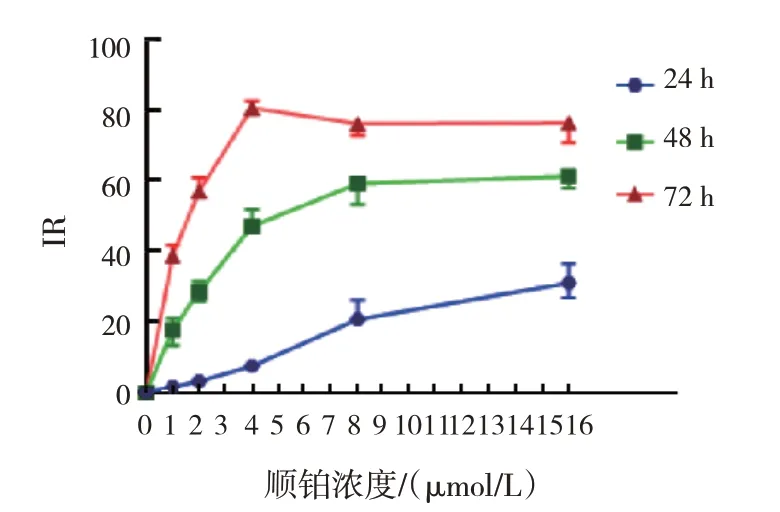
图2 不同质量浓度顺铂作用于SK-OV-3细胞的抑制率比较
空白组划痕愈合率为(60.98±0.04)%,金雀异黄素组、顺铂组与联合用药组48 h划痕愈合率分别为(38.07±0.01)%、(35.85±0.62)%和(18.65±0.06)%,4组比较,经方差分析,差异有统计学意义(F=5 338.46,P=0.000);金雀异黄素组、顺铂组、联合用药组划痕愈合率均低于空白组(P<0.05),联合用药组划痕愈合率低于金雀异黄素组和顺铂组(P<0.05)。联合用药组抑制细胞迁移的能力增强。见图3、4。

图3 各组SK-OV-3细胞迁移能力的比较
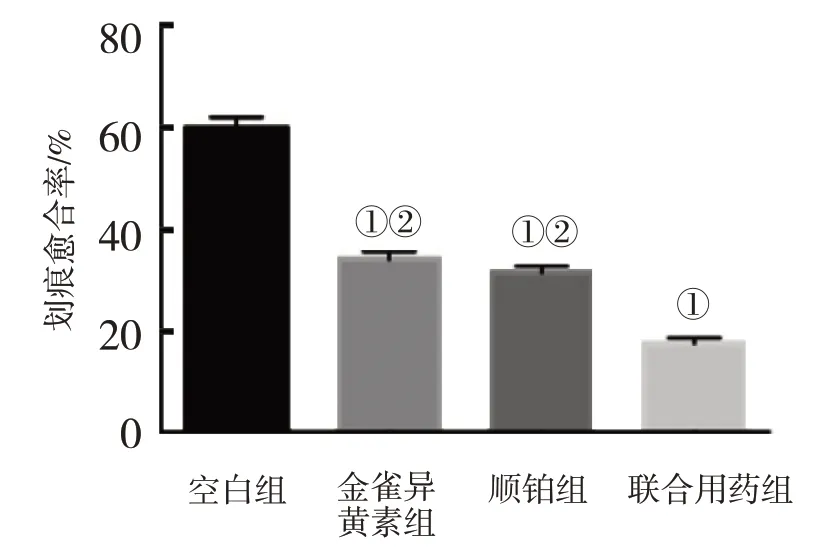
图4 各组SK-OV-3划痕愈合率的比较
2.3 各组凋亡细胞核形态变化
Hoechest33342 荧光染色结果可见,与空白组比较,金雀异黄素组、顺铂组与联合用药组均可见浓染致密的颗粒块状荧光,其中联合用药组呈现凋亡状态的细胞数目多于金雀异黄素组和顺铂组。见图5。
2.4 各组细胞凋亡率比较
空白组48 h 总凋亡率为(5.87%±0.03)%,金雀异黄素组与顺铂组总凋亡率分别为(25.49±0.13)%和(27.73±0.08)%,联合用药组总凋亡率为(56.69±0.11)%,4 组比较,经方差分析,差异有统计学意义(F=6 171.19,P=0.000);与空白组比较,金雀异黄素组、顺铂组与联合用药组总凋亡率均增加(P<0.05);与金雀异黄素组和顺铂组比较,联合用药组的总凋亡率增加(P<0.05)(见图6和表1)。提示与单独应用金雀异黄素或顺铂比较,两者联合应用对诱导SK-OV-3细胞凋亡具有协同作用。
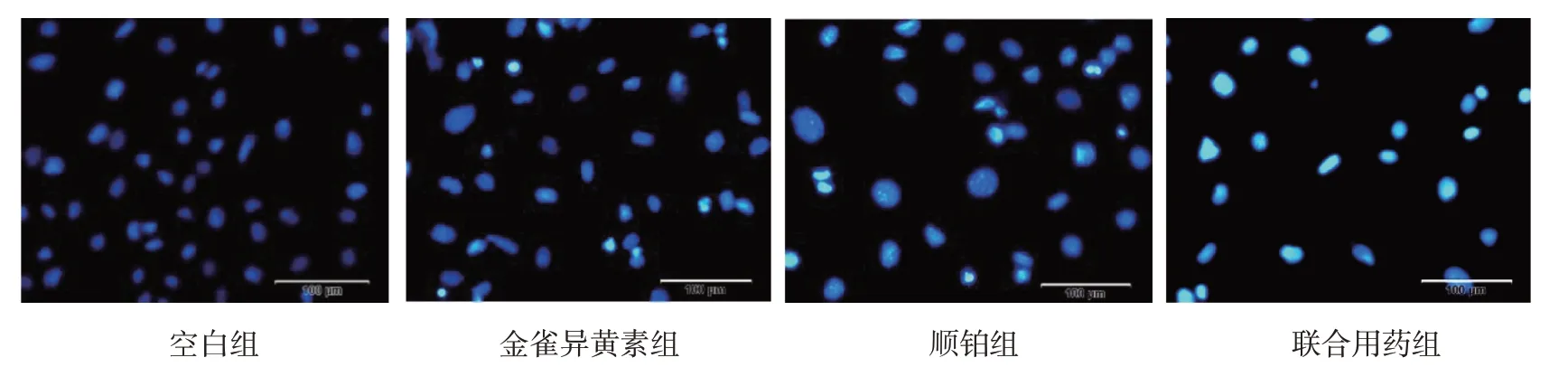
图5 各组SK-OV-3细胞的凋亡情况 (Heochst33342染色×200)
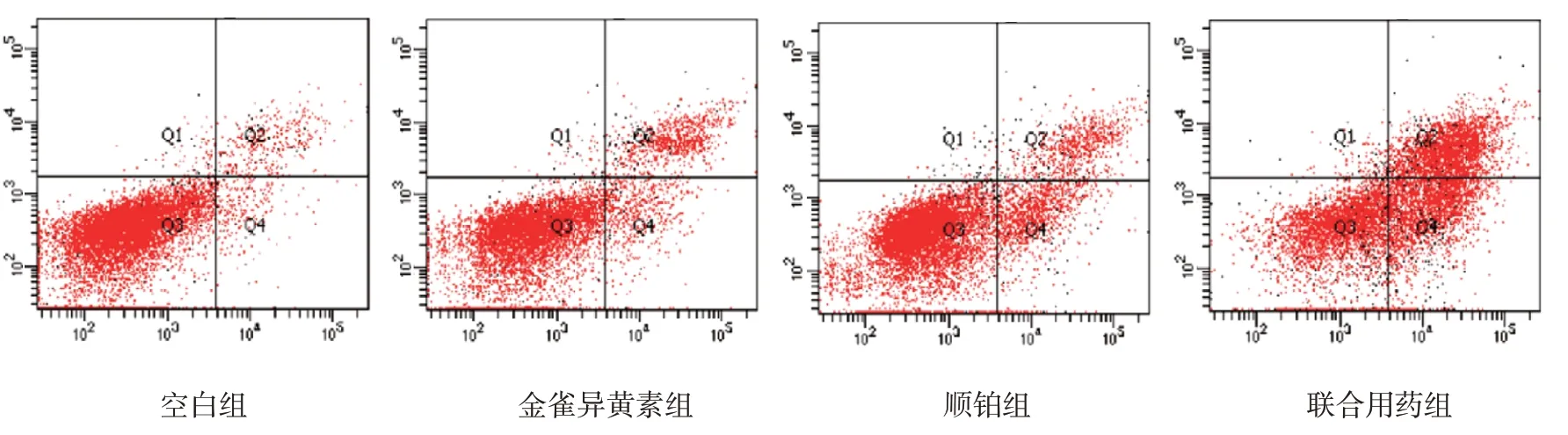
图6 各组SK-OV-3细胞凋亡的流式细胞图
表1 各组细胞凋亡率比较 (%,±s)
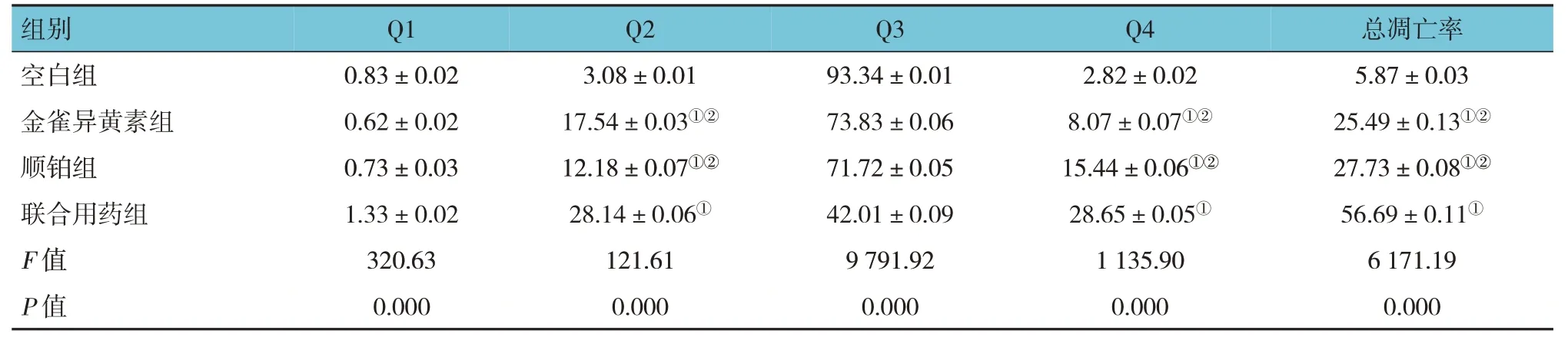
表1 各组细胞凋亡率比较 (%,±s)
注:①与空白组比较,P <0.05;②与联合用药组比较,P <0.05。
总凋亡率组别Q1 Q2 Q3 Q4 5.87±0.0 25.49±0.13 27.73±0.08 56.69±0.1 6 171.19空白组金雀异黄素组顺铂组联合用药组F 值0.83±0.02 0.62±0.02 0.73±0.03 1.33±0.02 320.63 3.08±0.01 17.54±0.03①②12.18±0.07①②28.14±0.06①121.61 93.34±0.01 73.83±0.06 71.72±0.05 42.01±0.09 9 791.92 2.82±0.02 8.07±0.07①②15.44±0.06①②28.65±0.05①1 135.903①②①②1①0.000 P 值0.000 0.000 0.000 0.000
2.5 SK-OV-3细胞凋亡相关蛋白的表达
Western blotting 检测结果显示,处理48 h后各组Akt、p-Akt、PI3K、Bax、Bcl-2、Caspase-3蛋白的相对表达量比较,经方差分析,差异有统计学意义(P<0.05);金雀异黄素组、顺铂组及联合用药组p-Akt、PI3K、Bcl-2 蛋白相对表达量及p-Akt/Akt 比值较空白组降低(P<0.05),Bax、Caspase-3 蛋白相对表达量升高(P<0.05);联合用药组p-Akt、PI3K、Bcl-2蛋白相对表达量及p-Akt/Akt比值较金雀异黄素组、顺铂组降低(P<0.05),Bax、Caspase-3 蛋白相对表达量升高(P<0.05)。提示联合用药对蛋白表达的影响大于单独应用金雀异黄素或顺铂。见图7和表2。
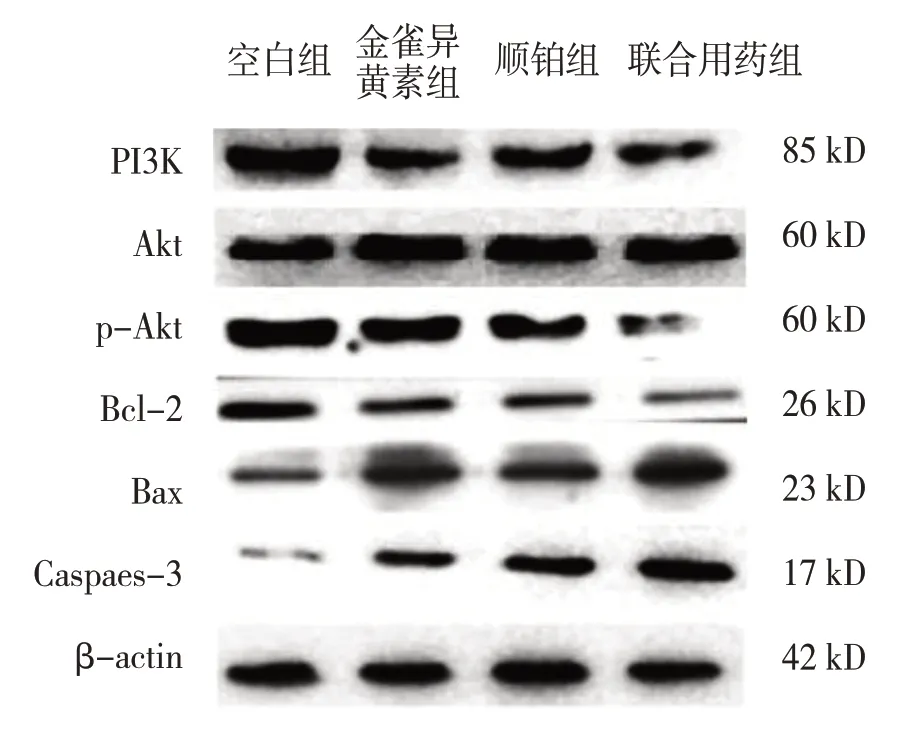
图7 SK-OV-3细胞相关蛋白的表达情况
表2 各组SK-OV-3细胞相关蛋白相对表达量的比较 (±s)
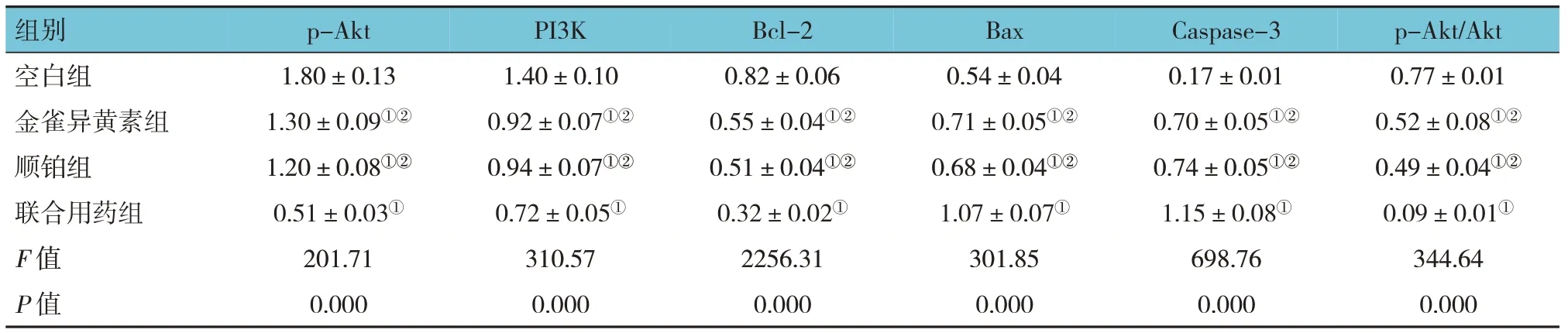
表2 各组SK-OV-3细胞相关蛋白相对表达量的比较 (±s)
注:①与空白组比较,P <0.05;②与联合用药组比较,P <0.05。
p-Akt/Akt 组别p-Akt PI3K Bcl-2 Bax Caspase-3 0.77±0.01 0.52±0.08①②0.49±0.04①②0.09±0.01①344.64 0.000空白组金雀异黄素组顺铂组联合用药组F 值P 值1.80±0.13 1.30±0.09①②1.20±0.08①②0.51±0.03①201.71 0.000 1.40±0.10 0.92±0.07①②0.94±0.07①②0.72±0.05①310.57 0.000 0.82±0.06 0.55±0.04①②0.51±0.04①②0.32±0.02①2256.31 0.000 0.54±0.04 0.71±0.05①②0.68±0.04①②1.07±0.07①301.85 0.000 0.17±0.01 0.70±0.05①②0.74±0.05①②1.15±0.08①698.76 0.000
3 讨论
金雀异黄素具有显著的抗肿瘤作用,其主要通过对细胞周期的调节及抑制血管发生和转移的方式促进肿瘤细胞的凋亡[11-12]。NING 等[7]研究发现,金雀异黄素能够抑制SK-OV-3 人卵巢腺癌细胞的自我更新能力;张芳等[13]研究发现,金雀异黄素可抑制IL-6 诱导的SK-OV-3 细胞增殖,且剂量越高,抑癌效果越好。本研究中MTT 法检测结果也证实,随着金雀异黄素浓度增加,作用时间延长,细胞生长抑制率上升;且发现高浓度的顺铂作用到一定时间后细胞出现耐药性。细胞划痕实验结果显示,与空白组比较,其他3 组细胞数目减少且迁移距离缩短,表明金雀异黄素及顺铂可抑-制SK-OV-3 细胞的迁移能力,且联合用药效果优于单独用药,虽然顺铂具有毒副作用,但在一定浓度的范围内,对SK-OV-3 细胞仍具有抑制作用[14]。
细胞凋亡是由细胞自身及细胞外界环境因素综合作用导致的一种基因控制的细胞自主有序的死亡。研究发现[15-16],Bcl-2 家族蛋白在细胞色素C 释放和胱天蛋白酶激活的线粒体凋亡途径中发挥重要的作用,其存在两种不同功能的蛋白,一种是凋亡抑制蛋白(Bcl-2、Bcl-xl),另一种是促凋亡蛋白(Bax)。本研究结果证实,与空白组比较,金雀异黄素组、顺铂组及联合用药组能够抑制抗凋亡蛋白Bcl-2 的表达,并增加凋亡蛋白Bax 的表达,且联合用药组的效果比金雀异黄素组和顺铂组更显著,表明金雀异黄素联合顺铂能够促进SK-OV-3 人卵巢腺癌细胞的凋亡。PI3K/Akt 信号通路作为机体细胞信号传导的重要通路[17],一方面,可通过影响下游效应分子的活性,启动通路下游的级联反应,进一步磷酸化下游底物,从而抑制细胞的凋亡;另一方面PI3K 的激活使Akt 磷酸化形成p-Akt 可直接调控细胞代谢和生存[18]。YU 等[19]研究表明,在上皮性卵巢癌组织及细胞中激活下游的PI3K/Akt 途径可增强细胞的抗失巢凋亡能力;路晓琳等[20]研究证实,在卵巢癌的发生、发展中,PI3K/Akt 信号被激活从而使卵巢癌细胞的增殖和侵袭能力增强。本研究结果显示,与空白组比较,药物处理后的SK-OV-3 细胞PI3K、p-Akt 及Bcl-2 蛋白表达下调,Caspase-3、Bax 蛋白表达上调,p-Akt/Akt 比值下降,且联合用药效果好于金雀异黄素和顺铂单独用药,提示联合用药比单独用药时下调PIK3 活性的能力增强,使其下游p-Akt 表达进一步减弱,进而引起细胞色素C 的释放量比单独用药时增加,加强Caspase-3 蛋白激活的同时使Bcl-2 家族成员进一步磷酸化。DATTA 等[21]研究证实,生长因子激活PI3K/Akt 信号通路最终抑制Bcl-2 家族成员的磷酸化,从而抑制细胞凋亡和促进细胞存活;盛连兵等[22]也证实,金雀异黄素通过抑制PI3K/Atk 信号通路的激活,进一步诱导SK-OV-3细胞凋亡,从而影响调亡相关基因Bcl-2、Bax 及Caspase-3 的表达。本研究中细胞划痕实验、Hoechst33342 荧光染色法、流式细胞术结果均显示,金雀异黄素和顺铂联合应用时,对SK-OV-3 细胞的体外诱导凋亡效果好于单独用药,提示金雀异黄素与顺铂两者具有协同作用。
本研究初步证实金雀异黄素及顺铂具有协同抗卵巢肿瘤的作用,其机制可能通过抑制PI3K/Akt 信号通路的激活,影响Bcl-2、Bax 及Caspase-3 蛋白的表达,进而诱导SK-OV-3 细胞凋亡,但具体作用机制仍需进一步深入研究。
