小肠类器官的构建及传代培养
2021-02-22郭正昌赵泽玉张宗耀周翔周
郭正昌赵泽玉张宗耀周 翔周 波
(安徽医科大学第一附属医院普外科,合肥 230032)
小肠类器官是小肠干细胞在体外进行3D 培养时,以连续分化的方式形成的一种多细胞类型的三维结构,其与体内小肠上皮的生理结构和功能有很大的相似性。 作为一个新的小肠上皮研究模型,由Clever 教授及其团队[1]于2009 年通过体外三维培养富含亮氨酸重复序列的G 蛋白偶联受体(Lgr5)基因表达的肠道干细胞率先完成体外的构建。
研究表明,许多肠道疾病的病变起始于肠道上皮,在炎症性肠病中肠道上皮中的杯状细胞水平降低导致粘蛋白的分泌减少,这也被认为是炎症性肠病的一个特征性标志[2]。 另外,许多肠道感染性疾病也被证实与病原体和肠道上皮细胞之间的相互作用有关。 现已有研究者开始利用小肠类器官模型来开展病原体与宿主之间的相互作用关系及其致病机制的研究[3-5]。 此外,小肠作为人重要的器官之一,执行着消化、吸收、分泌、免疫屏障等多方面的功能,肠道疾病的发生也与肠道屏障的破坏有关[6-9]。 小肠类器官作为模拟体内小肠上皮的模型,自成功构建以来,已在肠道感染性疾病[10]、再生医学[11]、肿瘤学[12]、药理学[13]和营养学[14]的研究中得以应用,然而,现在国内关于小肠类器官的研究鲜有开展。
由于小肠类器官的构建步骤复杂,模型构建尚未成熟,本研究着重探索及优化小肠隐窝的分离、培养、小肠类器官传代、冻存及复苏的方法,在此基础上研究R-Spondin1(R 脊椎蛋白1)浓度对小肠类器官形成的影响及小肠类器官的蛋白提取方法。
1 材料和方法
1.1 实验动物
SPF 级C57BL/6J 小鼠3 只,体重20~25 g,6~8周龄,雌雄不限,由安徽医科大学实验动物中心[SCXK(皖)2017-001]提供,安徽医科大学实验伦理委员会审批号(LLSC20180416)。 无菌手术在安徽医科大学实验动物中心屏障设施中进行[SYXK(皖) 2017-0124]。 并按实验动物使用的3R 原则给予人道的关怀。
1.2 主要试剂与仪器
类器官基础培养基:Advanced DMEM/F12(美国Invitrogen 公司,货号:12634-010);类器官完全培养基:基础培养基添加1% L-glutamine(美国Invitrogen 公司,货号:25030);1% pen/strep(美国Invitrogen 公司,货号:15140-148);1% Hepes 10 mmol/l(美国Invitrogen 公司,货号:15630080); N2 supplement 1 ∶100(美国Invitrogen 公司,货号:17502-048);B27 supplement 1:50(美国Invitrogen 公司,货号:17504-044);0.1 μg/mL Recombinant Mouse Noggin Protein(美国R&D Systems 公司,货号:1967-NG-025); 0.5 μg/mL Recombinant Mouse RSpondin1 Protein(美国R&D Systems 公司,货号:3474-RS-050);0.05 μg/mL Recombinant Mouse EGF Protein(美国R&D Systems 公司,货号:2028-EG-200);Matrigel Matrix 基质胶(美国BD 公司,货号:356231);EDTA(美国Sigma 公司,货号:431788-25G); DPBS ( 美国 Hyclone 公司, 货 号:SH3002802.02);肠类器官冻存液:80% Advanced DMEM/F12(美国Invitrogen 公司,货号:12634 -010);10%DMSO(美国Sigma 公司,货号:D2650-100ML);10%FBS(美国Gibco 公司,货号:10270-106)。 倒置荧光显微镜(日本Olympus 公司);电泳仪(北京六一);电热恒温培养箱(上海三发科学);脱色摇床(金坛市泰纳仪器);曝光仪(上海勤翔)。RIPA 裂解液(碧云天公司,货号:P0013B)。
1.3 实验方法
1.3.1 小肠类器官的分离
将小鼠腹腔麻醉后脱颈椎处死,放于75%乙醇中浸泡10 min。 在生物安全柜中,于小鼠会阴处开一小口,沿着腹正中线切开皮肤至剑突下,用Alice钳将皮肤向两边拉开,逐层进腹。 找到胃的幽门,在幽门下5 cm 处及距回盲部5 cm 处分别离断小肠。 将小肠放入冰DPBS 中,小心的去除残留的肠系膜及血管,然后用10 mL 注射器吸取冰DPBS 从靠近幽门端轻柔的冲洗肠腔,使肠内容物排出。 用眼科剪小心的纵向切开小肠,用细胞计数板轻轻地刮去小肠绒毛,将刮去绒毛的小肠切成2 ~3 mm 的小段收集到50 mL 的离心管中。 用移液枪吸取15 mL 的冰DPBS,轻柔地反复吹打几次,重复上述步骤,至上清液变澄清。 弃上清,并取20 mL 2.5 mmol/L 的EDTA(乙二胺四乙酸)溶液于离心管中,将离心管放于冰上置于20 r/min 的摇床上摇晃30 min。 然后用润湿的移液器轻柔的吹打3 次,将吹打后的溶液过70 μm 的滤网到50 mL 锥形管中,标记为第1 管,重复上述步骤依次标记2、3、4、5 管。 分别取10 μL 滤液于载玻片上观察,保留小肠隐窝较多且杂细胞较少的管。 将目标管放于离心机中,4℃、1200 r/min 离心5 min,弃上清,沉淀在10 mL 5% BSA/DPBS 溶液中重悬,再以相同的离心参数离心,重复3 次,最后1 次重悬后取10 μL 悬液计数,并计算离心管中的隐窝总数。
1.3.2 小肠类器官的培养
尽可能多的弃去上清液,以1 μL 基质胶12.5个隐窝计算应加入的基质胶体积,在离心管中用移液器重悬肠隐窝,注意不要吹出气泡,基质胶易凝,此步骤冰上操作。 用移液器吸取50 μL 悬液,一次性打入到在培养箱中孵育过的24 孔板中,种板后将24 孔板放于培养箱中孵育30 min 至基质胶完全聚合。 待基质胶完全聚合后沿孔壁添加500 μL 类器官生长培养基。 24 孔板放于37℃、5%CO2培养箱中培养,每2~3 d(培养基变黄)更换培养液。
1.3.3 小肠类器官的传代
培养7 ~10 d 或类器官中央变黑时可以传代,提前将24 孔板放于培养箱中预孵育至少30 min。吸走待传代孔的培养液,每孔中加1 mL 冰DPBS,1 min 后挑起基质胶,用1 mL 枪头将基质胶轻轻吹散,用配备27⅟²G 针头的1 mL 注射器一次性吸走悬液,重复操作1 次,将悬液加入5 mL 离心管中,1200 r/min,4℃、离心5 min,离心,弃上清,按每孔1∶3传代。 铺板及培养同类器官的培养步骤。
1.3.4 小肠类器官的冻存
选择生长状态良好的类器官(一般传代后3 ~4 d),进行冻存,每两孔冻存一管。 吸去培养液,加入1 mL 细胞冻存培养液,用1000 μL 的枪头将基质胶吹散,后将悬液加到细胞冻存管中,放于程序性降温冻存盒中,于-80℃冰箱放置1 d,后转入液氮长期保存。
1.3.5 小肠类器官的复苏
预先将24 孔板放于培养箱预孵30 min。 取出液氮中的冻存管,放于37℃水浴锅中,当冻存液刚好溶解时取出,用配备27⅟²G 针头的1 mL 注射器抽吸一次,然后将细胞悬液转移到15 mL 离心管中,于1200 r/min、4℃的离心机中离心5 min,弃上清,加入5 mL 冰DPBS 重悬,重复上述离心步骤,弃上清。 按照之前类器官培养的步骤铺板和培养,每冻存管小肠类器官传4 孔。
1.3.6 小肠类器官的蛋白提取
小肠类器官在基质胶中3D 培养与传统的贴壁和悬浮培养不同,蛋白提取时操作也有所区别,本研究探索了小肠类器官蛋白提取的方法。 首先吸除24 孔板中的培养基,加入1 mL 冰DPBS,将24 孔板放于冰上30 min 溶解基质胶,用1000 μL 枪头的移液枪重悬,然后将悬液转移至15 mL 离心管中,另外加入5 mL 冰DPBS,800 r/min、4℃离心5 min,小心的去除上清,再次用5 mL DPBS 重悬肠类器官,在同样条件下再次离心,去除上清液,保留沉淀。然后按照每2 孔类器官加入200 μL RIPA 裂解液,冰上充分裂解后离心收集上清。
1.3.7 R-Spondin1 浓度对小肠类器官生长的影响
Wnt 激动剂R-Spondin1 与Lgr5 结合,是单个lgr5+小肠干细胞构建小肠类器官的重要因素之一[1],然而,在肠类器官体外培养过程中R-Spondin1的浓度使用仍有争议[15-16]。 在此我们通过在培养基中设置0.25 μg/mL、0.50 μg/mL、0.75 μg/mL 这3 个浓度梯度,通过在不同时间点对肠类器官的形态观察,来探索R-Spondin1 的浓度对肠类器官形成的影响。
2 结果
2.1 合理的肠隐窝比例更有利于肠类器官的形成
小肠隐窝分离后,将悬液置于倒置显微镜下观察,刚分离出的小肠隐窝在形态学呈短棒状结构(图1A)。 短棒状结构较多,游离的细胞单较少,以图1A 的标准分离出来的小肠隐窝与单细胞的比例关系培养后更易形成类器官。
2.2 小肠类器官的建立及传代培养
刚分离出的小肠隐窝呈短棒状(图1A),分离培养后6 h 开始出现圆圈状结构(图1B);培养第2天,圆圈状结构开始出现出芽趋势,中间可见管腔(图1C);培养第3 天小肠类器官变大,出芽更加明显(图1D);培养后第4 天,小肠类器官体积变大且管腔壁明显增厚,出芽数增多(图1E);培养后第5天,出芽数继续增多(图1F);培养后第6.5 天形成围绕中央管腔的花环状结构,管腔中央脱落的细胞开始凋亡,颜色变深(图1G),此时可进行传代;切割传代后观察小肠类器官被切割成小肠类器官碎片(图1H);在与原代培养细胞相同的条件下,小肠类器官碎片在第4 天重新长成成熟的类器官结构(图1I),此时的小肠类器官可用于后续实验。
2.3 Western blot 验证蛋白提取方法有效
对提取的蛋白进行蛋白电泳,管家基因GAPDH表达如图2 所示,这证实了上述蛋白提取方法是有效的,此模型作为疾病的模型,某种干预因素施加后,用上述方法提取蛋白可以在蛋白水平验证干预因素对肠道上皮的影响。
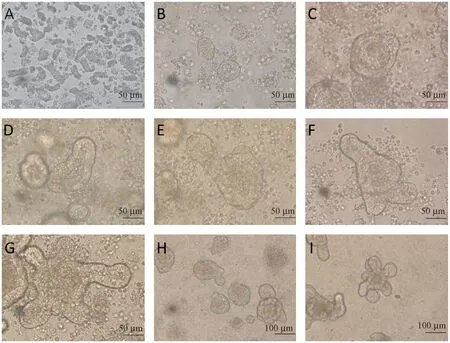
图1 小肠类器官的形成及传代过程中的形态改变Note.A, Small intestinal crypts just separated.B, Small intestinal crypts have been cultured for 6 hours and have formed a circle structure.C,Small intestinal organoids started to bud after 2 days of culture.D, Small intestinal organoids on day 3 of culture.E, Increased number of small intestinal organoids budding on the 4th day of culture.F, Small intestine organoids on day 5 of culture.G, The small intestine organoids on the 6.5th day of culture present a characteristic floral ring structure.H, The small organoids pieces after passage.I, The mature small intestinal organoid structure is reformed on the fourth day after passage.Figure 1 Small intestine organoid formation and morphological changes during passage
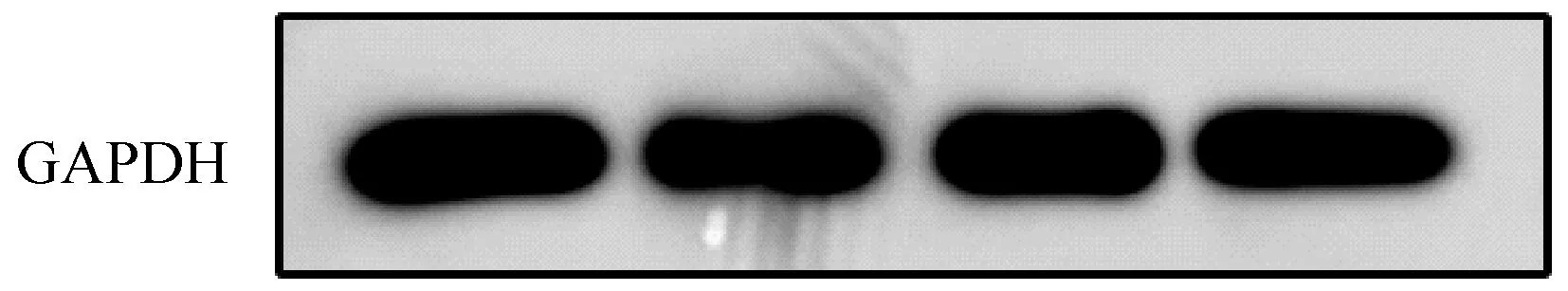
图2 Western blot 验证蛋白提取有效Note.The protein was collected and analyzed by western blot,which showed that the housekeeping gene GAPDH was expressed, which confirmed that the protein extraction was effective.Figure 2 Western blot demonstrated that protein extraction was effective
2.4 低R-Spondin1 浓度小肠类器官的成熟受限
如图3 所示,小肠隐窝分离后在含有低浓度的R-Spondin1 培养基中小肠隐窝的成圈时间无明显差别,在后续的培养过程中低浓度的肠类器官大部分成为类球体,出芽数明显减少,大部分不出芽。 在较高浓度的R-Spondin1 培养基中培养小肠类器官能顺利出芽,且最终可以形成成熟的肠类器官,低于0.50 μg/mL 的R-spondin1 会影响肠类器官的成熟。 本研究还发现在低浓度R-Spondin1 培养基中培养的类球体在移入较高浓度的R-Spondin1 小肠类器官培养基中能重新成长为成熟的肠类器官。
3 讨论
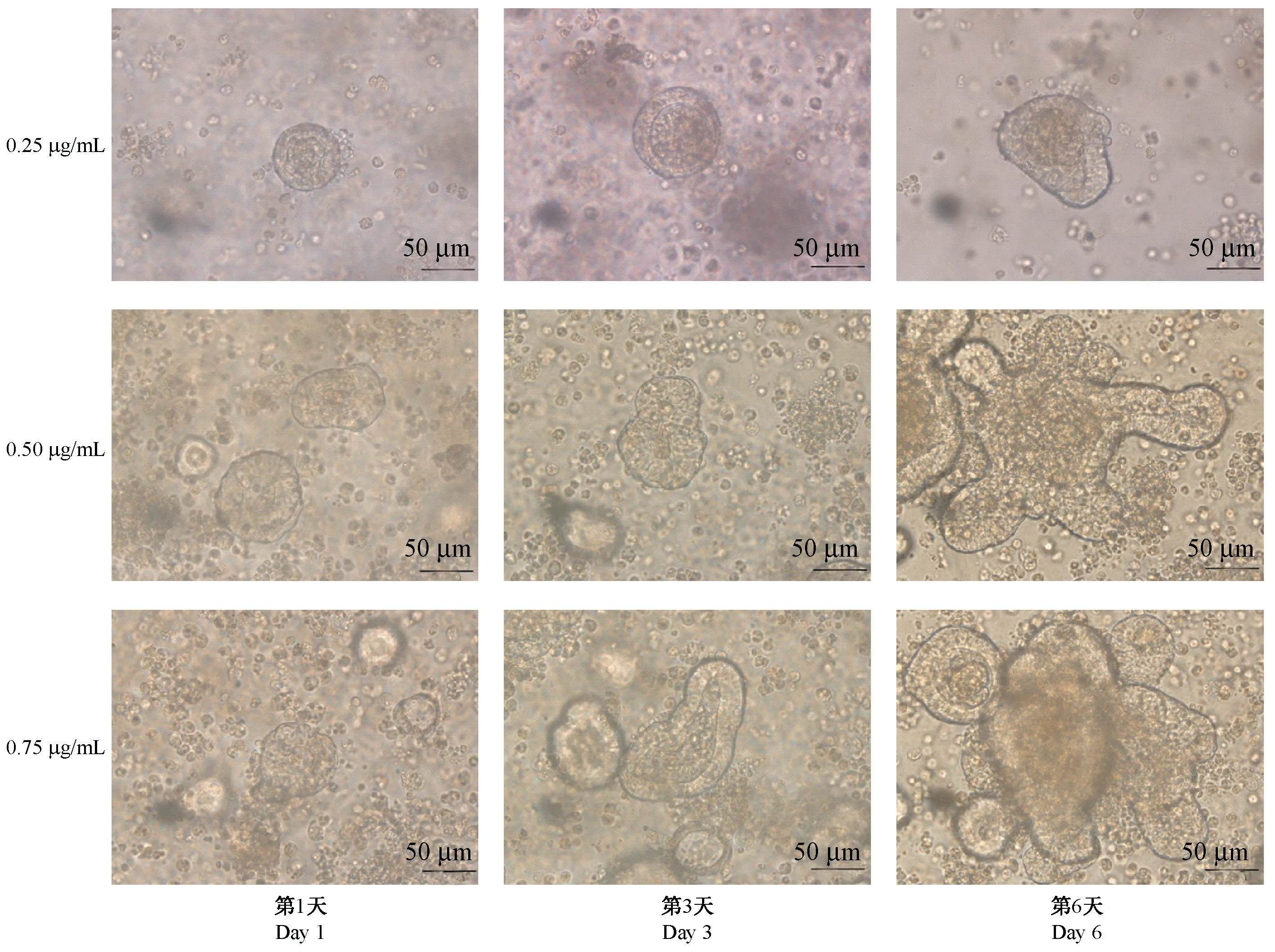
图3 不同浓度R-Spondin1 小肠类器官形态比较Note.The small intestinal organoids were cultured under a concentration gradient of R-spondin1 at 0.25 μg/mL,0.50 μg/mL, and 0.75 μg/mL, and the morphological changes of small intestinal organoids were observed on day 1, day 3, and day 6.Figure 3 Comparison of morphology of small intestinal organoids with different concentrations of R-Spondin1
小肠上皮是单个细胞层,由增殖的隐窝和分化的绒毛组成,包括分泌细胞(如杯状细胞和肠内分泌细胞)、吸收细胞(如肠细胞)、潘氏细胞和干细胞等小肠细胞类型[17-18]。 小肠上皮的更新依赖于位于肠隐窝底部附近的肠道干细胞,它们快速分裂、运输扩增的子细胞至隐窝的其余部分,并逐渐转移至肠绒毛的侧翼,在那里子细胞分化,吸收营养,最终在绒毛顶端凋亡。 肠道内稳态的维持主要依靠四条典型的信号通路控制:WNT[19]、Notch[20]、EGF、BMP[21]。 Clever 教授[1]通过在添加有EGF(表皮生长因子)、Noggin(头蛋白)、R-spondin1 这些细胞因子的培养基中,3D 培养Lgr5 基因表达的肠道干细胞成功的完成了小肠类器官的构建。 作为一种新兴的模型,小肠类器官已经获得了广泛的关注,因为小肠类器官的结构包括大部分小肠上皮细胞类型[22],此外,单细胞测序显示小肠类器官含有先前未鉴定的细胞亚型[23-24]。 因此,小肠类器官概括了自然组织的主要特征,这对于研究细胞类型的动态平衡和疾病状态之间相互作用的复杂性具有很高的价值[25]。 小肠类器官相关病理检测技术的发展也将推动小肠类器官体外培养体系的应用[26]。
然而国内外关于小肠类器官的构建现仍无统一标准,类器官构建的难点在于细节的把控,小肠绒毛的处理不当、培养密度的大小以及污染等问题都会很大程度上的影响小肠类器官构建的成功率。肠道上皮分离物中隐窝和游离单细胞的比例是后期培养成败的关键,本文通过用细胞计数板刮去小肠绒毛,多次吹打,过滤选定小肠隐窝数量较多而游离的单细胞较少的目标管进行培养。 通过取样观察在培养前建立了可以进行后续培养的肠隐窝与单细胞比例的标准(图1A),这很大程度上提高了小肠类器官培养的成功率,避免了盲目培养带来的实验成本的增加。 在传代过程中综合使用了机械法和消化法两种方法处理成熟的类器官,我们发现机械法在传代过程中能更好的保持隐窝的数量及活性。 蛋白组学是基础性研究的重要组成部分,小肠类器官由于其在三维条件下培养,其蛋白提取过程与传统的贴壁及悬浮培养大有不同,本研究中我们通过在低温条件下溶解基质胶成功的收集了小肠类器官,蛋白质的成功提取将有助于研究干扰因素在蛋白层面对小肠道上皮的影响。 R-Spondin1作为小肠培养过程中重要的细胞因子,在此研究中我们发现当其浓度低于0.50 μg/mL 不利于肠类器官的成熟,因此使用合理的R-Spondin1 浓度也决定着小肠类器官培养的成功。
目前以类器官作为疾病的模型及前临床模型已开始用于科学研究。 由于类器官作为疾病的前临床模型在药物开发、基因及细胞疗法等方面有良好的应用前景,而国内关于类器官的研究正处于起步阶段。 本文继续完善了小肠类器官的分离、培养、传代、冻存和复苏及蛋白提取工作,可以为小肠类器官的构建及应用提供新的参考。
