神经干细胞在缺氧后的分化情况及相关信号通路初探
2021-02-22王雨晴陈志刚张斯佳王荣亮罗玉敏赵海苹
王雨晴陈志刚张斯佳王荣亮罗玉敏赵海苹*
(1.首都医科大学宣武医院,脑血管病研究室,北京 100053;2.北京中医药大学东方医院,脑病一科,北京 100078)
神经干细胞(neual stem cells, NSCs)是存在于神经系统中,具有分化为神经元、星形胶质细胞和少突胶质细胞的潜能以及自我更新能力的细胞群。 上世纪60 年代科学家发现成体哺乳动物脑内一些区域分布着神经干细胞,即神经再生区域。 目前成体大脑内公认的神经再生区域主要为侧脑室室管膜下区(subependymal ventricular zone,SVZ)以及海马齿状回颗粒下区(subgranular zone, SGZ)。 其中SVZ 区的神经干细胞在增殖分化为不同的子代后可迁移至脑内其他区域,在损伤后的神经功能恢复中具有重要意义。 影响NSCs 增殖及分化的方式包括调节胞内转录因子、改变神经发生微环境以及激活胞外Eph/ephrin、Notch、Wnt/β-catenin、PI3K/Akt 多种信号通 路 等[1-4]。 研究表明, 促红细胞生成素(erythropoietin,EPO)对脑缺血具有神经保护作用,体内体外实验均证明EPO 具有促进神经干细胞分化的作用, EPO 主要通过 EPOR( erythropoietin receptor ) 和βCR ( β-common receptor)组成同二聚体和异二聚体的受体发挥作用,但是具体介导神经干细胞分化的受体类型还不清楚。 众所周知,MAPK 级联反应几乎控制着所有细胞功能,包括适应、增殖、分化、存活、凋亡等。 PBK(PDZ-binding-kinase)是丝裂原活化蛋白激酶MAPKK 家族的新成员,有研究表明PBK对脑缺血具有一定的保护作用[5-6]。 然而PBK是否参与缺血性损伤后神经再生即神经干细胞的分化目前尚不清楚。 在本实验中我们通过原代神经干细胞氧糖剥夺模型(oxygen and glucose deprivation,OGD)初步分析了神经干细胞向不同成熟神经细胞方向分化的趋势以及EPO 受体和PBK 与神经细胞标志物表达的相关性。
1 材料和方法
1.1 实验动物
SPF 级C57BL/6 孕鼠1 只,孕龄为12~14 d,体重23 g 左右,购于北京维通利华实验动物技术有限公司[SCXK(京) 2016-0006],实验于首都医科大学宣武医院脑血管病实验室动物实验屏障设施中进行[SYXK(京)2015-0016]。 动物实验中涉及的动物所有操作程序已经得到首都医科大学宣武医院实验动物管理和使用委员会的批准(XWH20190603),并按实验动物使用的3R 原则给予人道主义关怀。
1.2 主要试剂与仪器
DMEM/F12、Neurobasal 培养基,购于Invitrogen公司;TRIzol 试剂、无RNA 酶的水、无RNA 酶的糖原购于Invitrogen life technologies;三羟甲基氨基甲烷(Tris-HCl)、乙二胺四乙酸(EDTA)、3-(N-吗啉基)丙磺酸(MOPS)、溴化乙锭(ethidium bromide,EB)购于华美生物工程公司;乙酸钠、甲醛、氯仿、异丙醇、100%乙醇购于上海化学试剂有限公司;甲醛上样染液购于Ambion;琼脂糖购于生工生物工程有限公司;RNA 酶抑制剂购于Epicentre;SuperScriptTMIII Reverse Transcriptase、 5 × RT 缓冲液购于Invitrogen;2.5 mmol/L dNTP 混合液购于HyTest Ltd;2×PCR master mix 购于Arraystar。
洁净工作台(上海博迅实业有限公司医疗设备厂);DK-8D 型电热恒温水槽(上海森信实验仪器有限公 司); Gene Amp PCR System 9700 (Applied Biosystems);ViiA 7 Real-time PCR System (Applied Biosystems)。
1.3 实验方法
1.3.1 神经干细胞的培养和分组
参照文献[7-10]选择孕龄为12~14 d 的C57BL/6孕鼠,断颈处死后取出胚胎置于清洁的PBS 中,分离胚胎脑的皮层神经干细胞,用0.25%胰酶消化5 min 后离心除去胰酶,加入含DNase 的培养基轻柔吹打细胞团块至单细胞状态,900 r/min 离心4 min后用完全培养基(DMEM/F12+Neurobasal+B27+PS+GlutaMax+EGF+FGF)重悬,后接种于低吸附六孔培养板。 2 ~3 d 后传代,用Accutase 消化神经球至单细胞,后离心除去Accutase,完全培养基重悬细胞并继续置于低吸附六孔培养板。 连续传代两次后收集细胞,消化至单细胞后接种至PDL 包被过的细胞板,使细胞在单层贴壁状态下生长。 将细胞分为6组,即对照(control)组,OGD/R 处理后1 h 组,2 h组,4 h 组,6 h 组以及8 h 组。 每组3 孔细胞。
1.3.2 神经干细胞氧糖剥夺/复氧(OGD/R)模型
将单层贴壁原代神经干细胞换至无糖培养基中并置于密闭缺氧盒中,向盒内持续通入95%N2+5%CO2的混合气体5 min,使盒内的空气被完全置换成不含氧气的混合气体。 将缺氧盒置于37℃培养箱,3 h 后将细胞板从缺氧盒中取出并将培养基置换成完全培养基(DMEM/F12+Neurobasal+B27+PS+GlutaMax+EGF+FGF),放入培养箱继续培养,后分别于不同时间点(OGD/R 后1 h、2 h、4 h、6 h、8 h)收集细胞。
1.3.3 RT-PCR 法检测转录水平
分别于OGD 3 h 复氧后不同时间点收集神经干细胞,采用TRIzol 法提取RNA,使用NanoDrop®ND-1000 测定RNA 浓度和纯度。 根据SuperScriptTMIII Reverse Transcriptase 试剂盒进行cDNA 合成。 使用Primer 5.0(英骏生物技术有限公司)设计引物,β-actin(Actb)做为内参(见表1)。 使用2×PCR master mix 试剂盒及ViiA 7 Real-time PCR System 进行实时定量PCR 检测2',3'-环核苷酸3'-磷酸二酯酶(Cnp)、髓鞘碱性蛋白(Mbp)、胶质纤维酸性蛋白(Gfap)、中枢神经特异性蛋白(S100b)、神经元核抗原(Rbfox3)、微管相关蛋白2(Map2)、微管蛋白(Tubb3)、促红细胞生成素受体(Epor)、共β亚基异源受体(Csf2rb)以及PDZ 连接激酶(Pbk)的转录水平。 技术重复3 次。

表1 引物列表Table 1 List of primers
1.4 统计学方法
采用SPSS 25.0 以及GraphPad Prism 8.0 软件分析数据及作图。 组间比较采用单因素方差分析(One Way ANOVA),结果以平均数±标准误差(¯x±s¯x)表示。 相关性分析采用Pearson 相关检验。 以P<0.05 为差异具有统计学意义。
2 结果
2.1 OGD 处理促进神经干细胞向少突胶质细胞方向分化
神经干细胞OGD 3 h,分别于复氧后1 h、2 h、4 h、6 h、8 h 收集细胞,用RT-PCR 检测少突胶质细胞标志物CNP 及MBP 的基因表达。 结果提示在OGD复氧后各时间点,Cnp及Mbp的表达水平较control组均有升高的趋势,在OGD 复氧后4 h 时Cnp升高最为显著,与control 组相比差异具有统计学意义(P<0.05)(见图1)。 综上,缺氧缺糖损伤增加了神经干细胞向少突胶质细胞方向的分化。
2.2 OGD 促进神经干细胞向星形胶质细胞方向分化
神经干细胞OGD 3 h,分别于复氧后1 h、2 h、4 h、6 h、8 h 收集细胞,用RT-PCR 检测星形胶质细胞标志物GFAP 及S100B 的基因表达。 神经干细胞OGD 复氧后2 h 和6 hGfap的表达水平显著降低,8 h表达水平显著升高,与control 组相比差异具有统计学意义(P<0.05);各时间点S100b的表达水平均有升高,2 h、4 h、6 h、8 h 与control 组相比差异具有统计学意义(P<0.05)(见图2)。
2.3 OGD 处理减少了神经干细胞向神经元方向的分化
神经干细胞OGD 3 h,分别于复氧后1 h、2 h、4 h、6 h、8 h 收集细胞,用RT-PCR 检测神经元标志物RBFOX3、MAP2 以及TUBB3 的基因表达。 OGD 复氧后2~8 h 三者的mRNA 表达水平均有降低,其中Rbfox3 及Tubb3 在2 h、4 h、6 h 时降低最为显著且与control 组相比差异均具有统计学意义(P<0.05)(见图3)。 综上,OGD 损伤减少了神经干细胞向神经元方向分化从而损伤神经元再生。
2.4 Epor 及Pbk 的转录水平与少突胶质细胞分化呈正相关
神经干细胞OGD 3 h,分别于复氧后1 h、2 h、4 h、6 h、8 h 收集细胞,用RT-PCR 检测信号分子EPOR、CSF2RB(βCR)以及PBK 的基因表达情况。与control 组相比,Epor和Csf2rb在神经干细胞OGD复氧后1 h 有降低趋势,4 h、6 h、8 h 时有升高趋势;Pbk在神经干细胞OGD 复氧后各时间点表达均降低,其中1 h 及8 h 较为显著,与control 组相比差异具有统计学意义(P<0.05)(见图4)。
通过分析比较三类神经细胞分化标志物与三种信号分子的转录水平相关性,我们发现EPOR 与少突胶质细胞标志物CNP 的基因表达呈正相关(r=0.52,P<0.05);蛋白激酶PBK 与少突胶质细胞标志物CNP、MBP 的基因表达也呈正相关(r=0.51 和r=0.5,P<0.05)。 三种信号分子的基因表达与星形胶质细胞标志物、神经元标志物均无明显的相关性(图5、图6)。 以上结果表明EPOR 及PBK 可能参与神经干细胞向少突胶质细胞分化的过程。
3 讨论
本实验结果显示缺氧缺糖损伤促进神经干细胞向少突胶质细胞以及星形胶质细胞方向的分化,同时抑制其向神经元方向的分化。 另外,本研究发现Epor以及Pbk的表达与少突胶质细胞的分化呈正相关,提示EPOR 与PBK 可能参与少突胶质细胞新生。
少突胶质细胞是中枢神经系统的主要胶质细胞之一,其主要功能是在中枢神经系统中包绕轴突、形成绝缘的髓鞘结构、协助生物电信号的跳跃式高效传递并维持和保护神经元的正常功能。 少突胶质细胞对氧化损伤、兴奋性毒性和其他类型的缺血诱导损伤具有独特的敏感性。 已有研究证实在缺血性中风急性期和亚急性期轴突均会发生快速和显著的损伤[11-13]。 而卒中也会在一定程度上诱导轴突再生[14]。 在本实验中少突胶质细胞分子标志物CNP 的mRNA 水平在OGD/R 处理后4 h 明显上升,证实了卒中后的轴突再生作用可能是由少突胶质细胞新生的增强所引发。 轴突再生是损伤后神经功能恢复的重要基础,因此促进轴突再生被视为缺血性卒中的治疗策略之一。
本研究通过检测OGD/R 后不同时间点各种细胞分化标志物与Epor、Csf2r(βCR)以及Pbk的转录水平并分析数据发现,少突胶质细胞的标志物之一Cnp与受体Epor以及蛋白激酶Pbk的转录水平均呈正相关,另一标志物Mbp与蛋白激酶Pbk的转录水平呈正相关。 PBK 被证实在多个系统的恶性肿瘤组织中高表达,通过激活下游MAPK(p38、ERK、JNK)信号通路,对恶性肿瘤的发生发展、治疗预后起到重要作用[15-16]。 在脑缺血相关的研究中也同样发现MAPK 及上游MAP2K、MAP3K 具有新的潜在药物靶点[17]。 研究证明大鼠缺血24 h 脑组织芯片中,PBK 的mRNA 水平变化较其上游MAP3Ks、其他MAP2Ks、下游MAPK 家族成员更为显著[18]。在脑缺血-再灌注早期,TOPK(PBK)在大鼠脑缺血皮层神经元中活化,可以起到抗氧化及神经保护作用[5]。 以上研究证实PBK 能够减轻缺血性神经损伤。 EPOR 是一种广泛表达的细胞表面受体,既往其形成的异源二聚体被认为主要参与介导EPO 促进红系祖细胞生成成熟红细胞,最近的研究表明EPO 除了具有造血活性外, 还具有广泛的组织保护活性。 它可作用于机体除造血细胞外的多种组织和细胞, 包括神经系统、心脏、肾等, 通过减少细胞凋亡、抑制炎症反应、促进血管生长、促进功能恢复等发挥其保护作用[19-20]。 CSF2RB 通过与EPOR 相关联形成EPO 敏感的组织保护性异质二聚体受体进行信号传导,起到神经保护作用[21-22]。 我们的实验结果进一步提示PBK、EPOR 可能参与缺血性损伤后神经干细胞向少突胶质细胞方向的分化,即少突胶质细胞新生的过程,从而促进了卒中后轴突再生以及神经功能恢复。 两个分子之间是否存在作用关系尚需进一步的研究探讨。
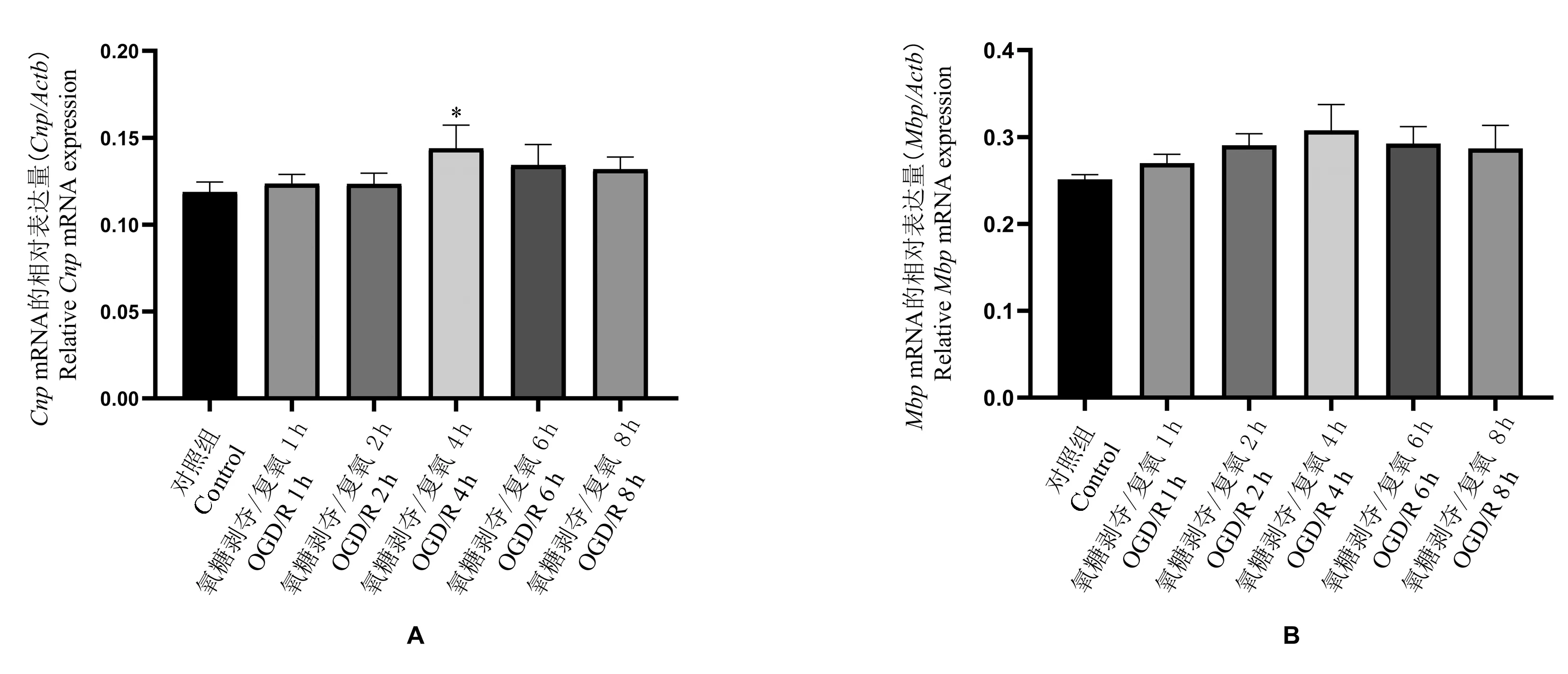
图1 Cnp、Mbp 在神经干细胞OGD/R 后不同时间点的表达水平Note.A, The gene expressions of oligodendrocyte marker CNP in neural stem cells at different time points after OGD 3 h/reoxygenation were compared.B, The gene expressions of oligodendrocyte marker MBP in neural stem cells at different time points after OGD 3 h/reoxygenation were compared. Cnp, 2', 3'-cyclic nucleotide 3'-phosphodiesterase gene. Mbp, Monobutyl phthalate gene.Compared with the control group, *P<0.05.Figure 1 Expression levels of Cnp and Mbp at different time points after OGD/R in neural stem cells
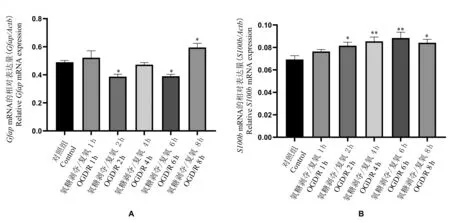
图2 Gfap、S100b 在神经干细胞OGD/R 后不同时间点的表达水平Note.A, The gene expressions of astrocyte marker GFAP in neural stem cells at different time points after OGD 3 h/reoxygenation were compared.B,The gene expressions of astrocyte marker S100B in neural stem cells at different time points after OGD 3 h/reoxygenation were compared. Gfap, Glial fibrillary acidic protein gene. S100b,S100 beta protein gene.Compared with the control group, *P<0.05.Compared with the control group, **P<0.01.Figure 2 Expression levels of Gfap and S100b at different time points after OGD/R in neural stem cells
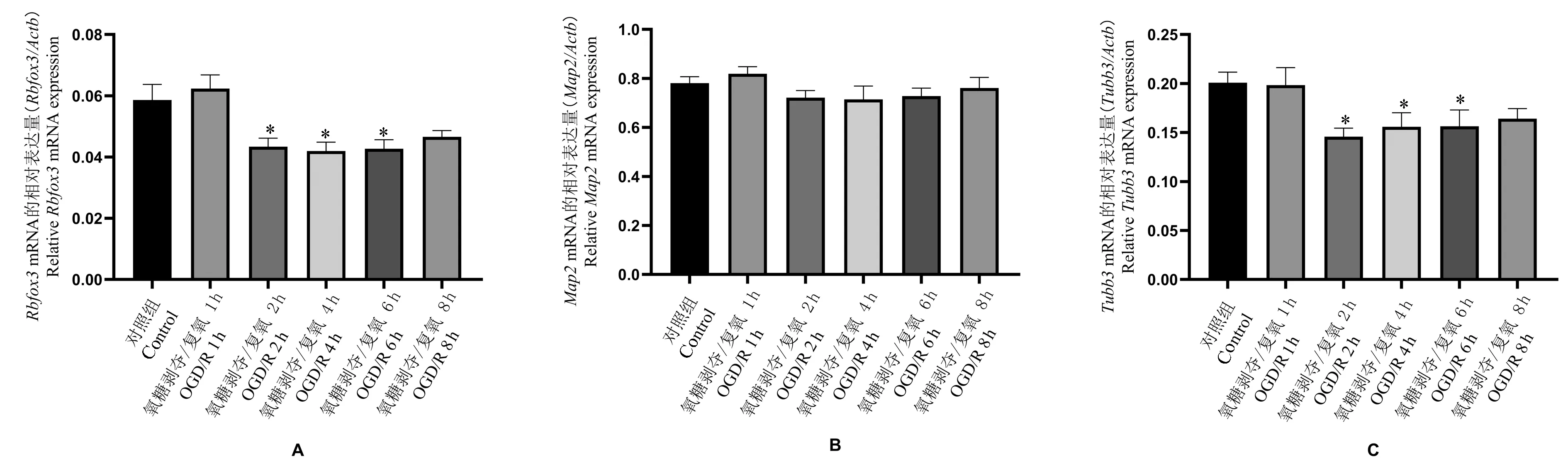
图3 Rbfox3、Map2 以及Tubb3 在神经干细胞OGD/R 后不同时间点的表达水平Note.A, The gene expressions of neuron marker RBFOX3 in neural stem cells at different time points after OGD 3 h/reoxygenation were compared.B, The gene expressions of neuron marker MAP2 in neural stem cells at different time points after OGD 3 h/reoxygenation were compared.C, The gene expressions of neuron marker TUBB3 in neural stem cells at different time points after OGD 3 h/reoxygenation were compared. Rbfox3, Neuronal nuclear protein gene. Map2, Microtubule-associated protein-2 gene. Tubb3, Beta III-tubulin gene.Compared with the control group, *P<0.05.Figure 3 Expression levels of Rbfox3, Map2 and Tubb3 at different time points after OGD/R in neural stem cells
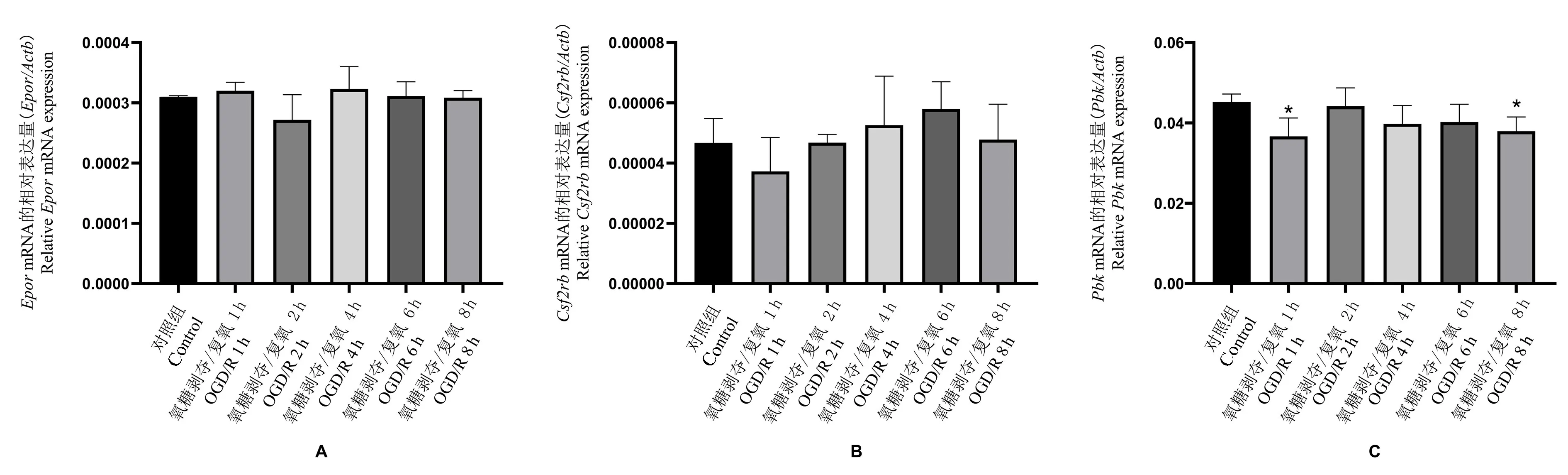
图4 Epor、Csf2rb 以及Pbk 在神经干细胞OGD/R 后不同时间点的表达水平Note.A,The gene expressions of the signal molecule EPOR in neural stem cells at different time points after OGD 3 h/reoxygenation were compared.B, The gene expressions of the signal molecule CSF2RB in neural stem cells at different time points after OGD 3 h/reoxygenation were compared.C,The gene expressions of the signal molecule PBK in neural stem cells at different time points after OGD 3 h/reoxygenation were compared. Epor,Erythropoietin receptor gene. Csf2rb,Common beta-subunit heteroreceptor gene. Pbk, PDZ-binding-kinase gene.Compared with the control group,*P<0.05.Figure 4 Expression levels of Epor、Csf2rb and Pbk at different time points after OGD/R in neural stem cells
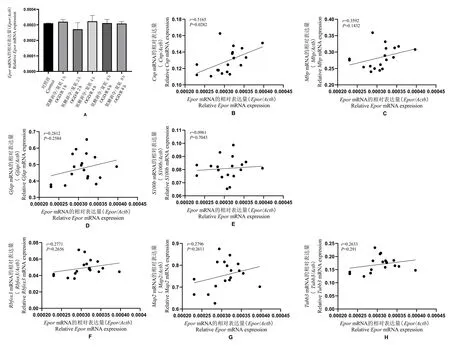
图5 各类细胞标志蛋白与信号分子EPOR 的相关性分析Note.A, Expression levels of Epor at different time points after OGD/R in neural stem cells.B, Correlation between Epor and Cnp. C,Correlation between Epor and Mbp. D, Correlation between Epor and Gfap. E, Correlation between Epor and S100b. F, Correlation between Epor and Rbfox3. G, Correlation between the Epor and Map2. H, Correlation between the Epor and Tubb3.Figure 5 Correlation analysis of cell marker proteins with signal molecule EPOR
星形胶质细胞起支持和分隔神经细胞的作用。GFAP 是一种Ⅲ型中间丝状蛋白,参与细胞骨架的构成并维持其张力强度,是星形胶质细胞活化的标志物[23]。 S100B 蛋白主要在星形胶质细胞中表达,其过量释放可促进脑损伤后神经炎症反应的激活和进展[24]。 本实验结果提示神经干细胞缺氧缺糖后2 h 和6 hGfap的表达减少,8 h 时表达升高;S100b的表达水平则于神经干细胞损伤后逐渐增加,6 h 时达到最高,8 h 时较前稍有下降。 既往学者研究发现,体外培养星形胶质细胞损伤后S100B的总体表达呈单峰变化趋势,损伤后6 h 达到高峰,具有时序性变化的规律[25]。 大鼠脑缺血再灌注后S100B 和GFAP 的表达时间变化关系研究也有说明,缺血再灌注早期S100B 可因星形胶质细胞受损而渗漏到外周微环境,进而刺激其合成水平上升,表达增加且呈双峰趋势;而GFAP 则于S100B 达高峰后,反应性星形胶质细胞开始参与损伤后修复和胶质瘢痕形成时表达增加[26]。 结合本研究实验结果考虑缺血性损伤后神经干细胞可向星形胶质细胞分化,参与炎症反应,继而发生凋亡、坏死。 8 h后更多的星形胶质细胞生成、激活,成为反应性星形胶质细胞参与到胶质瘢痕的形成。 后续我们可以进一步探究神经干细胞氧糖剥夺/复氧8 h 以后的星形胶质细胞标志物变化情况。
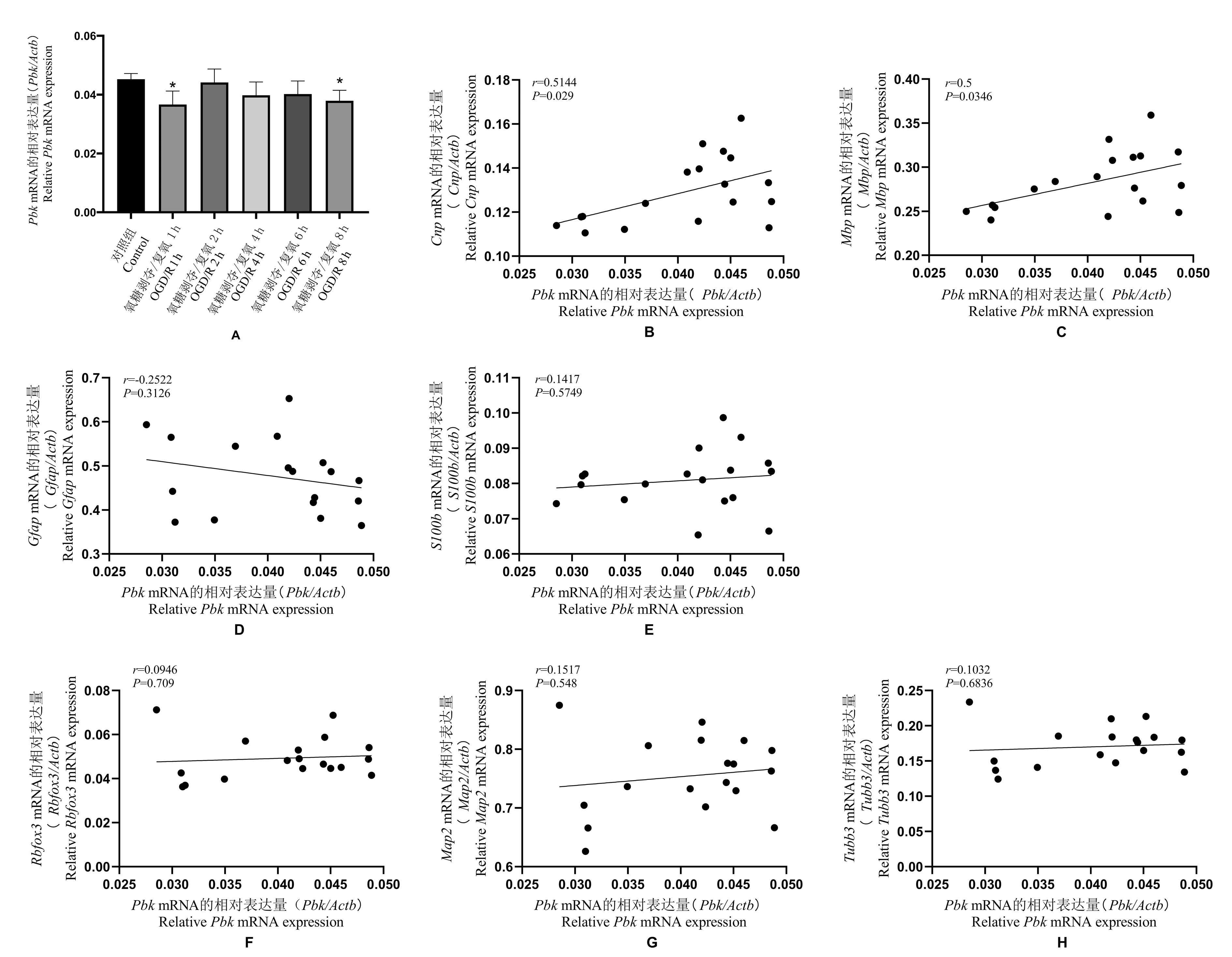
图6 各类细胞标志蛋白与信号分子PBK 的相关性分析Note.A, Expression levels of Pbk at different time points after OGD/R in neural stem cells.B, Correlation between Pbk and Cnp. C,Correlation between Pbk and Mbp. D,Correlation between Pbk and Gfap. E, Correlation between Pbk and S100b. F,Correlation between Pbk and Rbfox3. G, Correlation between Pbk and Map2. H, Correlation between Pbk and Tubb3.Figure 6 Correlation analysis of cell marker proteins with signal molecule Pbk
大量研究结果已表明缺血性脑损伤后成体神经再生作用增强,对神经功能的恢复具有促进作用[27-28]。 然而其机制目前尚不清楚。 在本实验中,利用体外神经干细胞氧糖剥夺模型模拟缺血性脑损伤后神经干细胞的变化。 结果显示OGD/R 后2~6 h 神经元的再生被抑制,表明脑缺血会直接抑制成体神经再生,即缺血后成体神经再生的增强并不是由缺血刺激直接引发的,可能是由周围微环境的变化引起。 具体的作用机制还需要进一步探究。
综上所述,本实验结果提示缺氧缺糖损伤显著促进了少突胶质细胞和星形胶质细胞新生,同时抑制了神经干细胞向神经元方向的分化。 转录分析结果提示EPOR 以及PBK 可能参与神经干细胞向少突胶质细胞方向的分化,为进一步研究缺血后神经再生机制提供了基础。 未来的研究应继续探讨EPOR 以及PBK 参与缺血后少突胶质细胞再生的机制以及其他的调节通路,为临床转化提供更多可干预的分子靶点。
