不同基原大黄指纹图谱、多成分定量结合多元统计分析的质量评价研究
2021-02-22孙冬梅罗思妮魏梅朱德全何广铭罗文安杨锐培
孙冬梅,罗思妮,魏梅,朱德全,何广铭,罗文安,杨锐培
(1.广东一方制药有限公司/广东省中药配方颗粒企业重点实验室,广东 佛山 528244;2.广州中医药大学第五临床医学院,广东 广州 510405)
大黄为蓼科植物掌叶大黄RheumpalmatumL.、唐古特大黄RheumtanguticumMaxim. ex Balf.或药用大黄RheumofficinaleBaill.的干燥根和根茎[1]。现代研究表明,大黄中主要的化学成分为蒽醌类、蒽酮类、二苯乙烯类、鞣质类等化合物,具有抗肿瘤、抗炎、保肝等[2]丰富的药理作用。大黄药用历史悠久,常作为君、臣药在经典中药复方中发挥重要功效。但大黄为多基原的中药,研究表明不同基原大黄所含化学成分种类和含量存在差异,导致其药效和药理作用也存在一定的区别[3-4]。近年来有学者对不同基原大黄的指纹图谱及含量测定进行了研究,并结合化学计量学对不同品种大黄药材的质量进行评价[5-7],但目前尚未见指纹图谱、多成分定量与多元统计分析相结合用于不同基原大黄质量评价的研究。
本研究收集了来自不同道地产区或主产区的51批大黄药材,建立了指纹图谱和同时测定14个化学成分含量的分析方法,并通过聚类分析、主成分分析(PCA)和偏最小二乘法判别分析(PLS-DA)不同基原大黄之间的差异性,为不同基原大黄的鉴别和质量评价提供科学依据。
1 材料
1.1 仪器
1290型超高效液相色谱仪(美国Agilent公司);XP26型百万分之一天平(梅特勒-托利多仪器有限公司);ME204E型万分之一天平(梅特勒-托利多仪器有限公司);KQ500DE型数控超声波清洗器(昆山市超声仪器有限公司);HWS28型电热恒温水浴锅(上海一恒科技有限公司);Milli-Q超纯水系统(德国Merck公司)。
1.2 药材
51批大黄药材经广州中医药大学孙冬梅教授鉴定为蓼科植物掌叶大黄RheumpalmatumL.、唐古特大黄RheumtanguticumMaxim.ex Balf.或药用大黄RheumofficinaleBaill.的干燥根和根茎,药材产地及详细信息见表1。

表1 大黄药材信息
1.3 试药
对照品没食子酸(含量90.8%,批号:110831-201605),儿茶素(含量99.2%,批号:110877-201604),番泻苷A(含量94.7%,批号:110824-201301),番泻苷B(含量95.6%,批号:110825-201502),芦荟大黄素(含量98.3%,批号:110795-201710),大黄酸(含量99.3%,批号:110757-201607),大黄素(含量98.7%,批号:110756-201512),大黄酚(含量99.2%,批号:110796-201319)及大黄素甲醚(含量99%,批号:110758-201616)购自中国食品药品检定研究院;对照品大黄酚-1-O-葡萄糖苷(含量99.9%,批号:6700)购自上海诗丹德标准技术服务有限公司;对照品大黄酚-8-O-葡萄糖苷(含量98%,批号:CFS201801)购自武汉天植生物技术有限公司;对照品芦荟大黄素苷(含量98%,批号:17103003),大黄酸苷(含量98%,批号:17101705)及大黄素-8-O-β-D-葡萄糖苷(含量98%,批号:18080601)购自成都普菲德生物技术有限公司。甲醇、磷酸均为色谱级(德国Merck公司),水为超纯水,其他试剂均为分析级。
2 方法与结果
2.1 色谱条件
Waters CORTECS T3色谱柱(2.1 mm×150 mm,1.6 μm),流动相:甲醇(A)-0.1%磷酸(B),洗脱梯度:0~5 min,3%~21%A;5~20 min,21%~40%A;20~27 min,40%~50%A;27~40 min,50%~58%A;40~50 min,58%~95%A;50~53 min,95%~3%A;流速:0.25 mL/min;检测波长:260 nm;柱温:30 ℃;进样体积:1 μL。
2.2 供试品溶液制备
精密称取各批次大黄药材(过4号筛)0.2 g,置具塞锥形瓶中,精密加入甲醇10 mL,称定质量,超声(功率250 W,频率50 kHz)处理30 min,放冷,再称定质量,用甲醇补足减失的质量,摇匀,用0.22 μm滤膜滤过,取续滤液,即得。
2.3 对照品溶液制备
分别精密称取各对照品适量,加甲醇制成含没食子酸、儿茶素、芦荟大黄素苷、大黄酸苷、番泻苷B、大黄素-8-O-β-D-葡萄糖苷、番泻苷A、大黄酚-8-O-葡萄糖苷、大黄酚-1-O-葡萄糖苷、大黄酸、芦荟大黄素、大黄酚、大黄素、大黄素甲醚质量浓度分别为1.377、1.783、0.440、0.300、0.689、0.300、0.470、0.324、0.373、0.228、0.706、0.736、1.258、0.346 g/L的对照品储备液。
2.4 方法学考察
2.4.1 精密度试验 精密吸取混合对照品溶液,按“2.1”项下色谱条件,连续进样6次,以2号峰(芦荟大黄素苷)为参照峰,计算各对照品相对峰面积的RSD在0.62%~1.20%之间,表明仪器精密度良好。
2.4.2 重复性试验 精密称取同一批掌叶大黄药材(Z19)6份,按“2.2”项下方法制备供试品溶液,按“2.1”项下色谱条件进行测定,以2号峰(芦荟大黄素苷)为参照峰,计算各共有峰相对峰面积RSD在0.86%~2.23%之间,表明方法重复性良好。
2.4.3 稳定性试验 精密吸取同一供试品溶液(Z19),按“2.1”项下色谱条件,分别在0、2、4、8、12、24 h进样测定,以2号峰(芦荟大黄素苷)为参照峰,计算各共有峰相对峰面积的RSD在0.92%~2.30%之间,表明供试品溶液在24 h内稳定。
2.5 指纹图谱的建立及分析
2.5.1 对照图谱建立及相似度评价 按照“2.1”项下确定的色谱条件及“2.2”项下的供试品溶液的制备方法,测定51批大黄的指纹图谱。将23批掌叶大黄、19批药用大黄及9批唐古特大黄指纹图谱分别导入《中药色谱指纹图谱相似度评价系统(2012年版)》进行分析,分别以Z1、Y1、T1为参照图谱,时间窗宽度为0.1,采用中位数法,通过多点校正,全谱峰匹配,生成3种基原大黄对照指纹图谱(图1)及51批大黄指纹图谱叠加图(图2)。以3种基原大黄的对照图谱作为参照图谱,得到23批掌叶大黄指纹图谱相似度为0.819~0.982;19批药用大黄中,除Y17、Y18相似度较低,其余样品相似度在0.800~0.982之间;9批唐古特大黄图谱相似度均大于0.900。表明不同产地、同一基原的大黄药材所含化学成分具有较好的一致性。以掌叶大黄对照指纹图谱作为药用大黄、唐古特大黄参照图谱导入软件,计算得到19批药用大黄的相似度在0.492~0.902之间。其中,Y6~Y8、Y11~Y15样品与掌叶大黄相似度较高,大于0.800;9批唐古特大黄的相似度在0.592~0.700之间,相似度较低,结果见表2。
2.5.2 共有峰成分指认及图谱差异性分析 通过比较图谱,从掌叶大黄、药用大黄、唐古特大黄对照图谱中分别标定了33、25、35个共有峰,从3种基原大黄中标定了18个共有峰(图1),并通过与对照品比对,指认了其中14个成分,分别为没食子酸(1号峰)、儿茶素(19号峰)、芦荟大黄素苷(2号峰)、大黄酸苷(4号峰)、番泻苷B(6号峰)、番泻苷A(7号峰)、大黄酚-1-O-葡萄糖苷(10号峰)、大黄酚-8-O-葡萄糖苷(11号峰)、大黄素-8-O-β-D-葡萄糖苷(12号峰)、芦荟大黄素(14号峰)、大黄酸(15号峰)、大黄素(16号峰)、大黄酚(17号峰)、大黄素甲醚(18号峰)。分析图谱(图1)可知,药用大黄图谱中的共有峰数目最少,保留时间在10~26 min之间,色谱峰响应值较低,而唐古特大黄图谱中色谱峰信息最为丰富,峰面积较大。与药用大黄图谱对比,掌叶大黄图谱中增加了8个共有峰,分别为19~23号峰、26号峰、29~30号峰,其中,26、30号峰在药用大黄中未检测到,而药用大黄图谱中的36号峰在掌叶大黄中未检测到。因此,建立的指纹图谱可以较好地区分3种基原大黄。
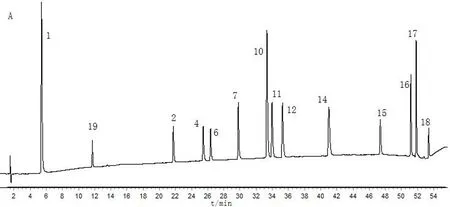
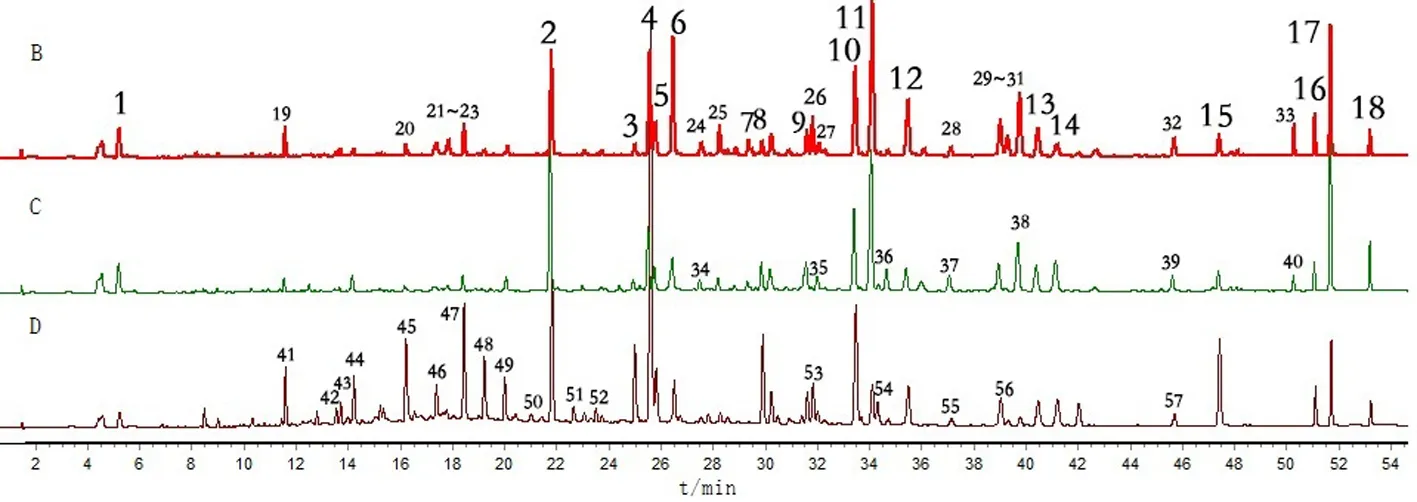
注:A.混合对照品;B.掌叶大黄;C.药用大黄;D.唐古特大黄; 1.没食子酸;2.芦荟大黄素苷;4.大黄酸苷;6.番泻苷B;7.番泻苷 A;10.大黄酚-1-O-葡萄糖苷;11.大黄酚-8-O-葡萄糖苷; 12.大黄素-8-O-β-D-葡萄糖苷;14.芦荟大黄素;15.大黄酸; 16.大黄素;17.大黄酚;18.大黄素甲醚;19.儿茶素图1 混合对照品及3种基原大黄对照图谱
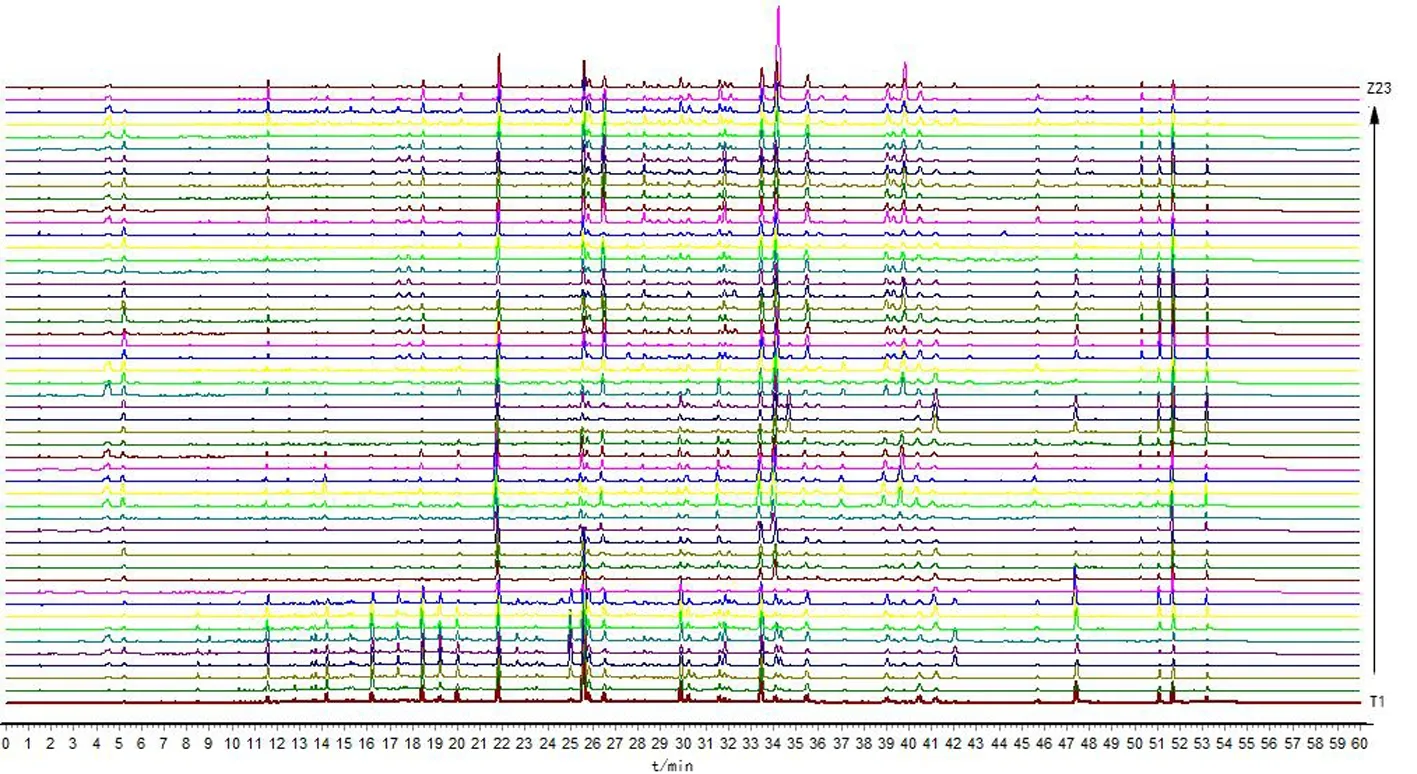
图2 51批大黄叠加指纹图谱
2.6 聚类分析
以掌叶大黄对照图谱中的33个共有峰作为参照,将药用大黄和唐古特大黄中无色谱峰信号的峰面积设置为0,得到51批大黄药材33个色谱峰峰面积。将33个峰面积相对于称样量进行量化,标准化处理导入IBM SPSS Statistics 21.0软件,采用Ward's方法和欧式距离进行聚类分析,聚类结果见图3。由聚类分析树状图可知,51批大黄可分为3类,其中,Y1~Y19、Z20~Z23为Ⅰ类;Z1~Z19为Ⅱ类;T1~T9为Ⅲ类。当分类距离为5时,Z20~Z23与Y6~Y8聚为一类,从产地信息中发现这些样品均来源于四川,提示产于四川北川县的掌叶大黄与产于四川平武县的药用大黄的化学成分较相似。通过分析发现这些药用大黄的图谱与掌叶大黄图谱基本一致,仅部分色谱峰峰面积存在差异,提示部分药用大黄与掌叶大黄两者的图谱相似度较高,因此,与掌叶大黄聚为一类。聚类分析结果与相似度评价结果一致。
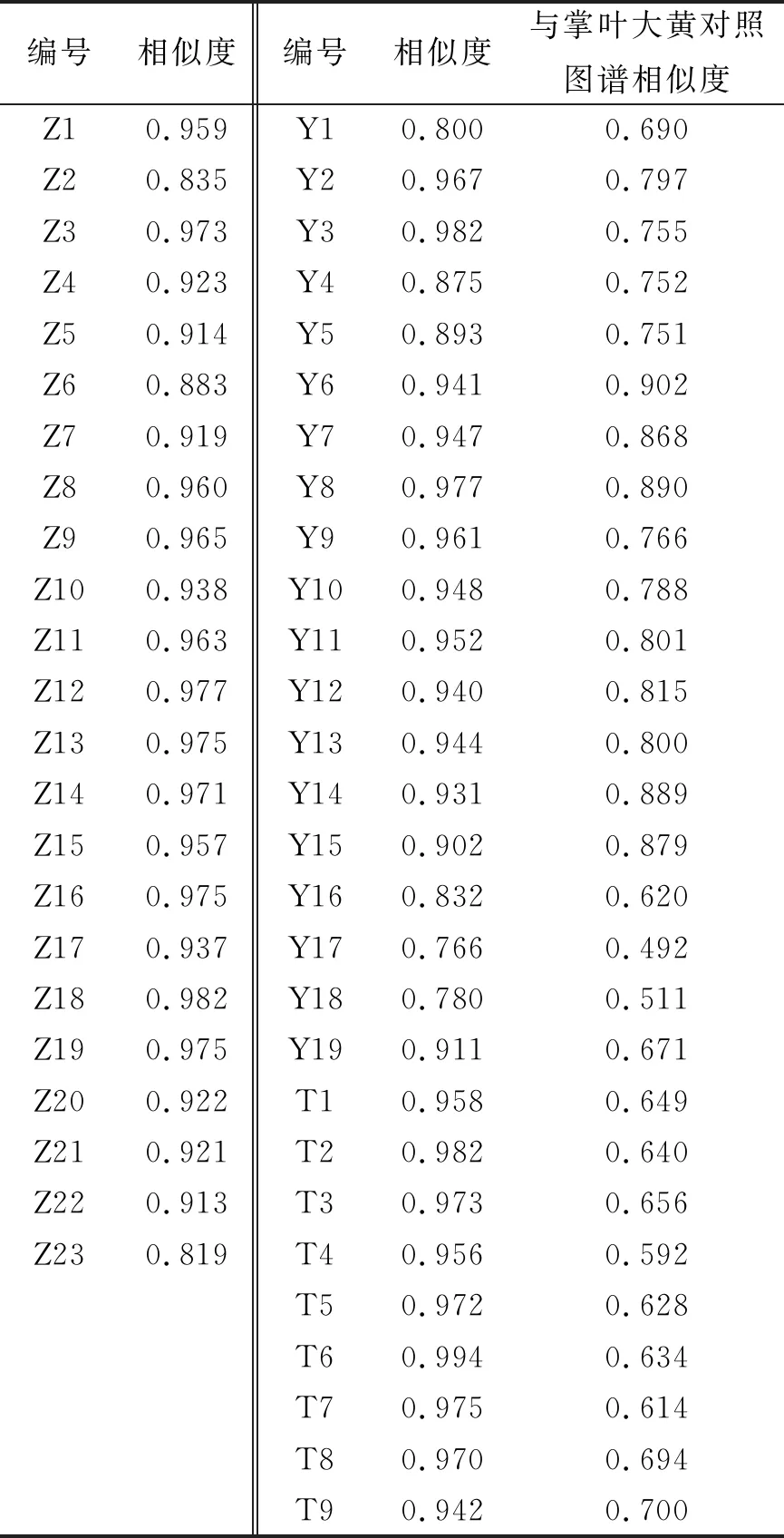
表2 相似度分析结果
2.7 含量测定
为进一步评价3个基原大黄的质量,在建立指纹图谱的基础上,同时测定已指认的14个化学成分的含量,并采用多元统计法,分析区别3种基原大黄的差异性化学成分。
2.7.1 线性关系考察 精密量取“2.3”项下的对照品储备液,加甲醇稀释制得6个不同质量浓度的对照品溶液,以峰面积为纵坐标(Y),质量浓度为横坐标(X,μg/mL)进行线性回归,得到各个对照品的线性关系良好。将最低质量浓度的对照品溶液进行稀释,分别以信噪比S/N=3和信噪比S/N=10的对照品质量浓度为检测限(LOD)和定量限(LOQ)。结果见表3。
2.7.2 精密度试验 精密吸取混合对照品溶液,按“2.1”项下色谱条件,连续进样6次,结果显示,14个对照品峰面积的RSD在0.13%~1.21%之间,表明仪器精密度良好。
2.7.3 重复性试验 精密称取同一批掌叶大黄药材(Z19)6份,按“2.2”项下方法制备供试品溶液,按“2.1”项下色谱条件进行测定,计算14个成分含量的RSD在0.97%~2.68%之间,表明方法重复性良好。
2.7.4 稳定性试验 精密吸取同一供试品溶液(Z19),按“2.1”项下色谱条件,分别在0、2、4、8、12、24 h进样测定,测得14个成分峰面积的RSD在1.01%~2.39%之间,表明供试品溶液在24 h内稳定。
2.7.5 加样回收率试验 精密称取已知含量的大黄药材(Z19)0.2 g,平行6份,加入与样品中含量等量的对照品,按“2.2”项下方法制备供试品溶液,按“2.1”项下色谱条件进行测定,计算加样回收率。测得14个成分平均加样回收率为95.05%~105.10%,RSD<3%。表明该方法回收率良好。
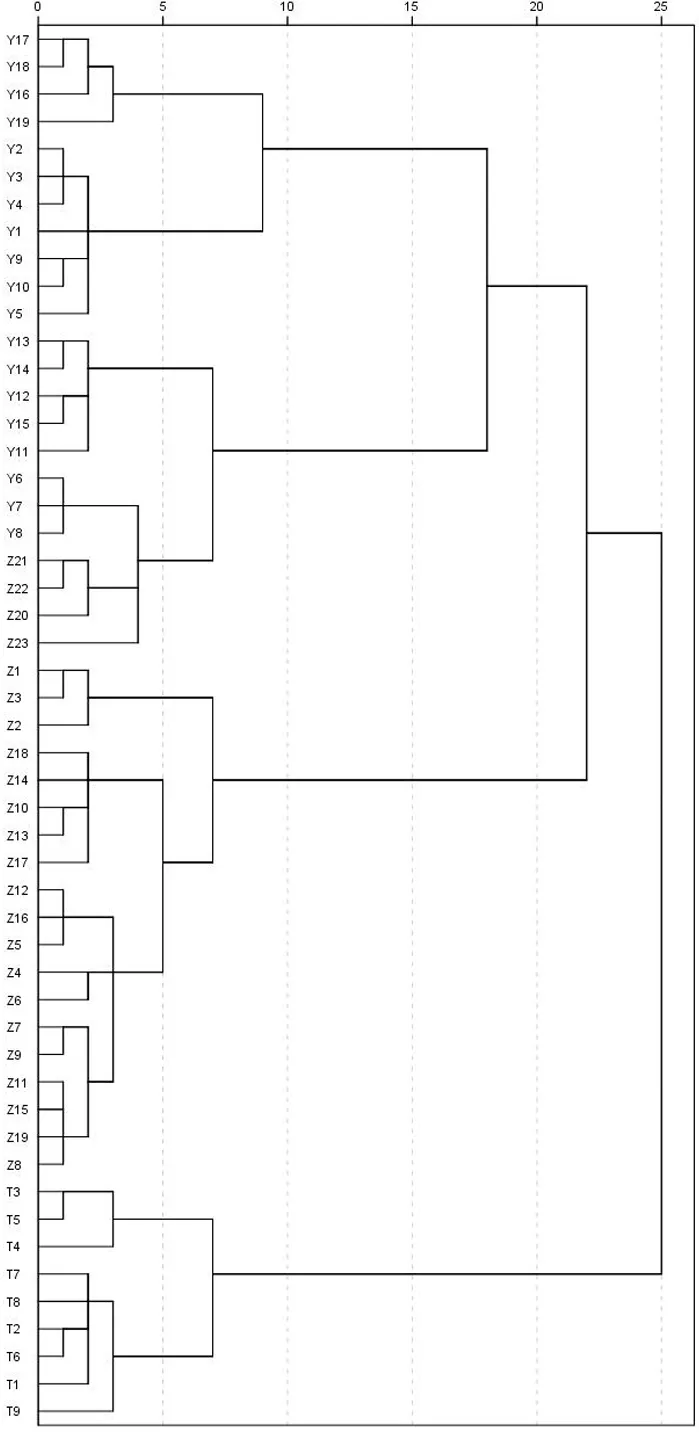
图3 聚类分析结果
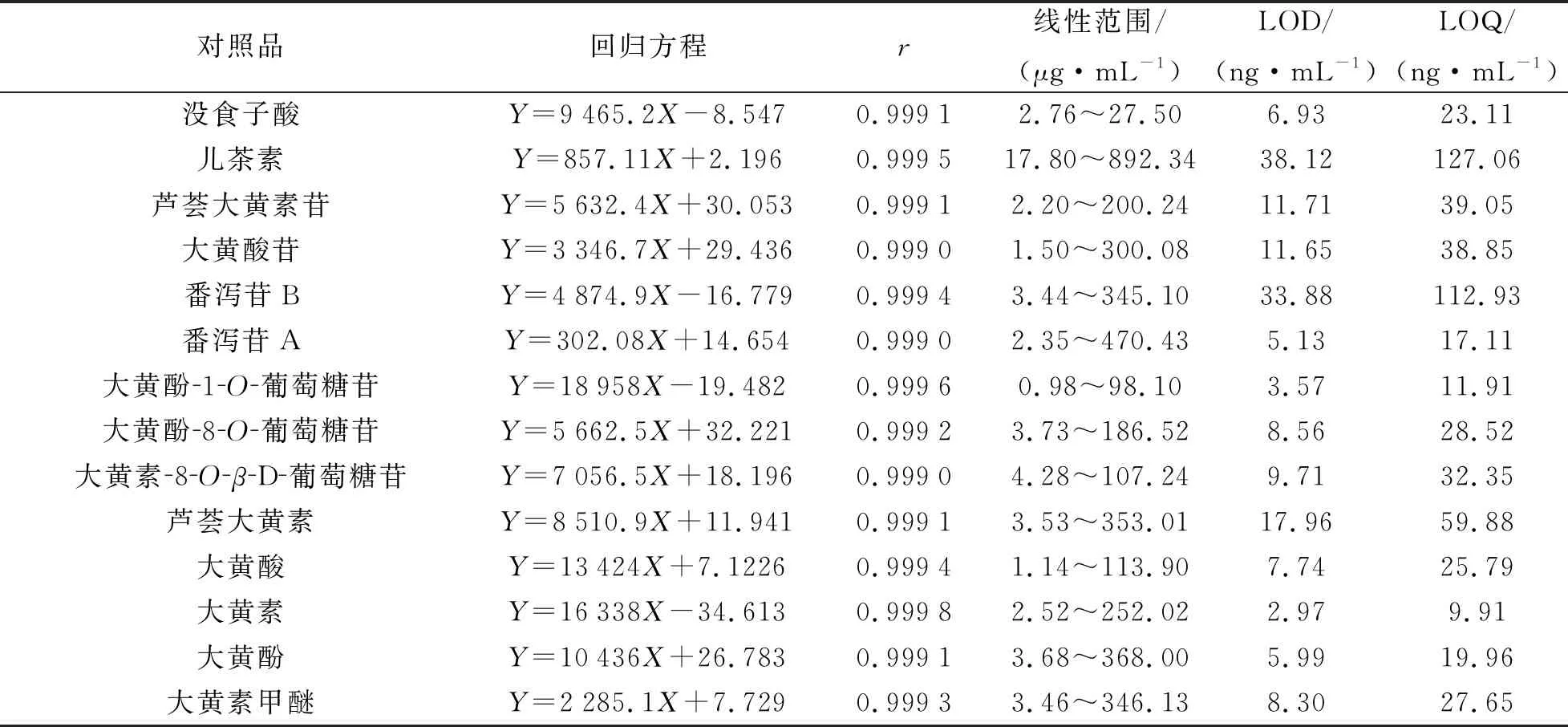
表3 14个化学成分的回归方程、线性范围及LOD、LOQ
2.7.6 样品测定 精密称取51批大黄药材,按“2.2”项下方法制备供试品溶液,按“2.1”项下色谱条件进样测定,得到含量测定结果,见表4。
2.8 多元统计分析
2.8.1 PCA 采用IBM SPSS Statistics 21.0软件对含量测定结果进行标准化处理,采用因子分析和主成分法,选择相关性矩阵分析,计算主成分特征值、积累贡献率。由表5可知,共提取了4个特征值大于1的主成分,累积方差贡献率达85.823%。成分载荷矩阵反映各主成分与各项指标变量之间的相互关系和作用的方向,载荷的绝对值越大对主成分的贡献越大[8]。从表6可以看出,在第一主成分有较高载荷的成分为芦荟大黄素、大黄素甲醚、大黄酚;在第二主成分有较高载荷的成分为番泻苷A。
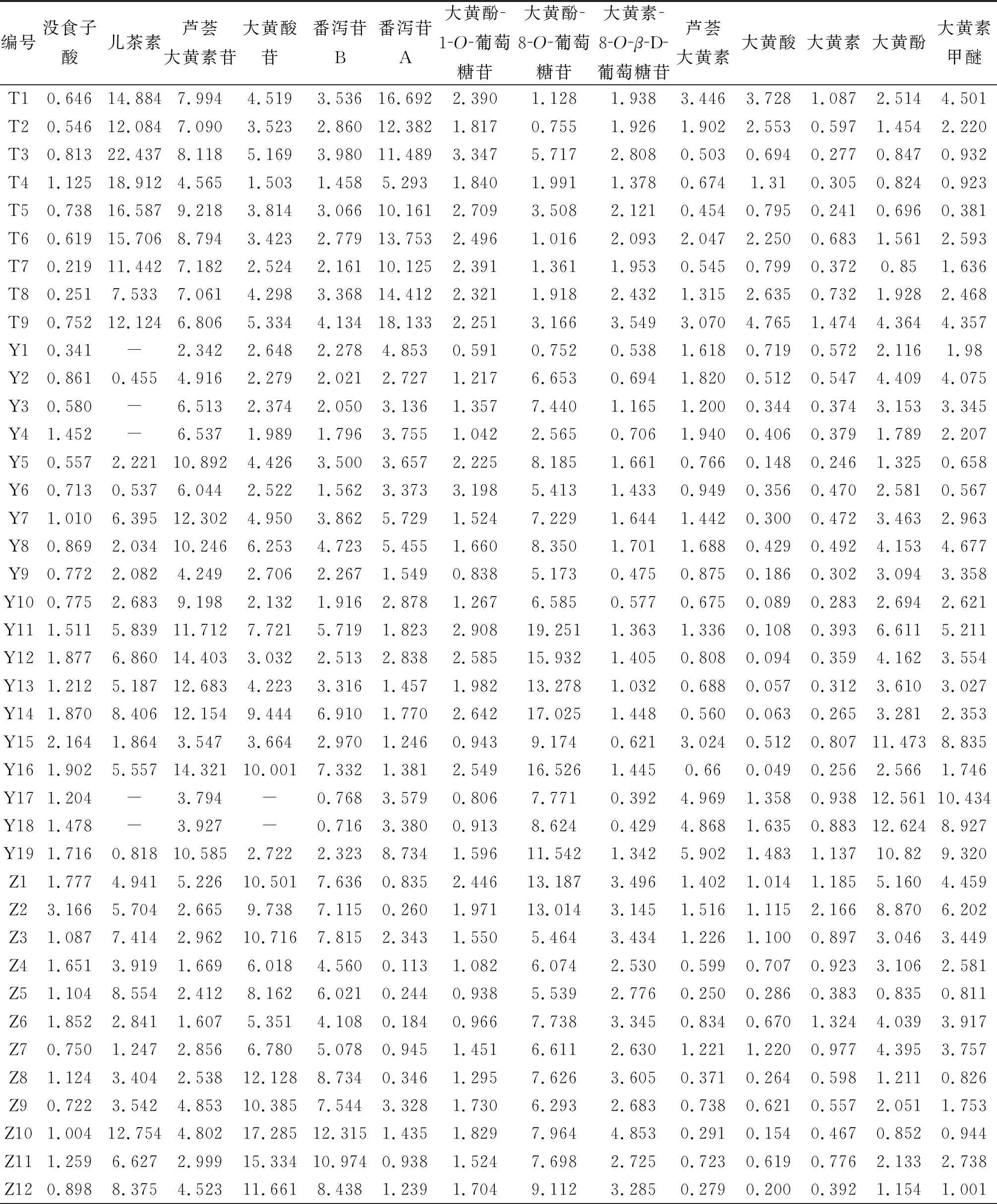
表4 含量测定结果(mg·g-1)
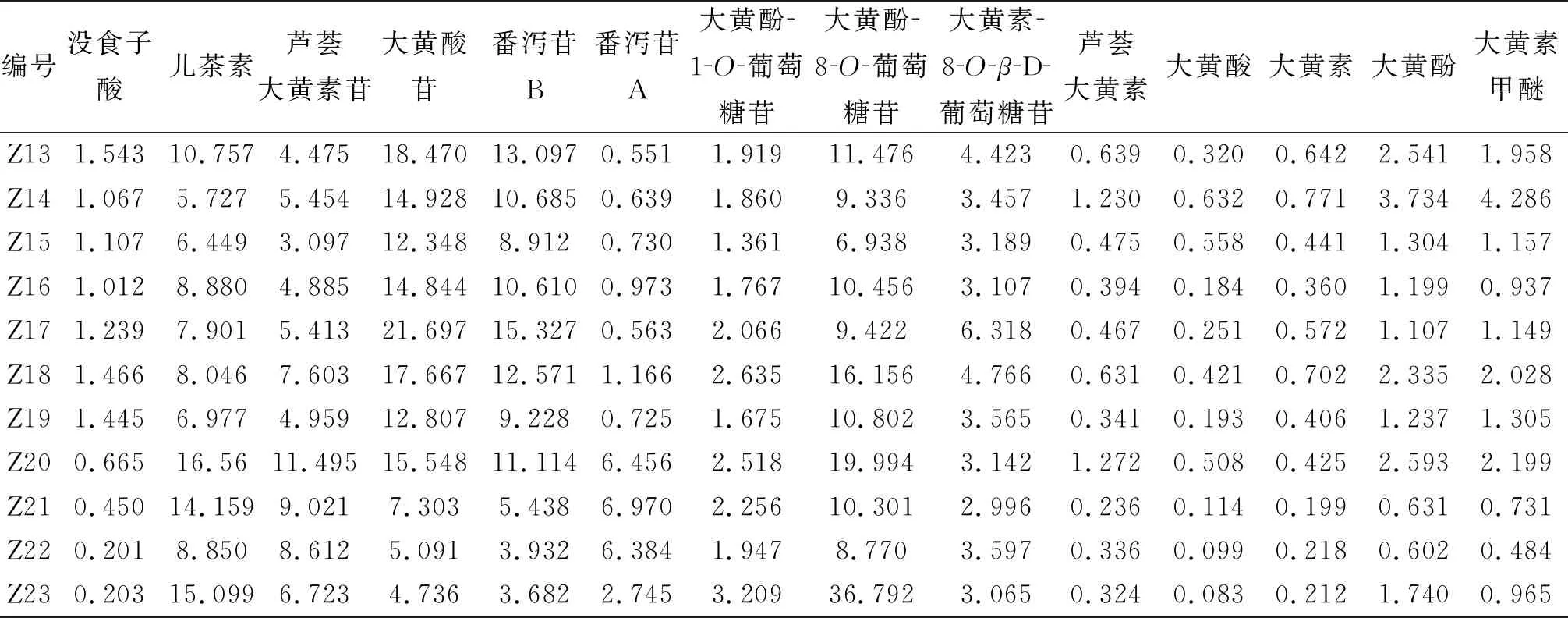
(续表)
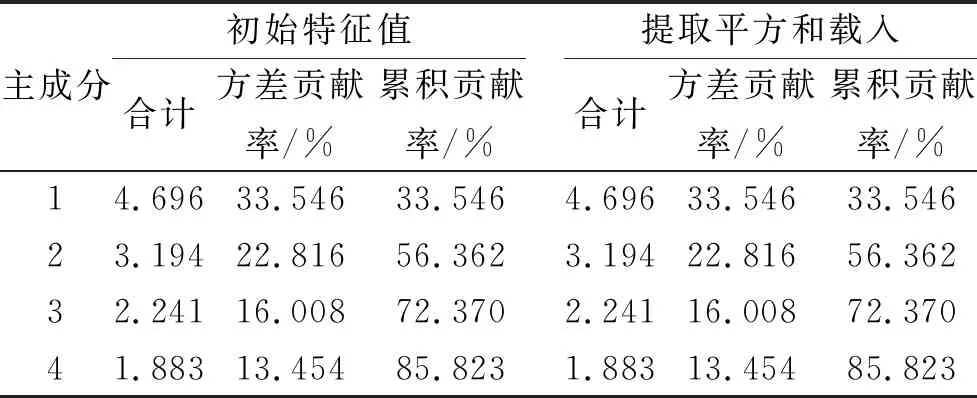
表5 主成分特征值和方差贡献率
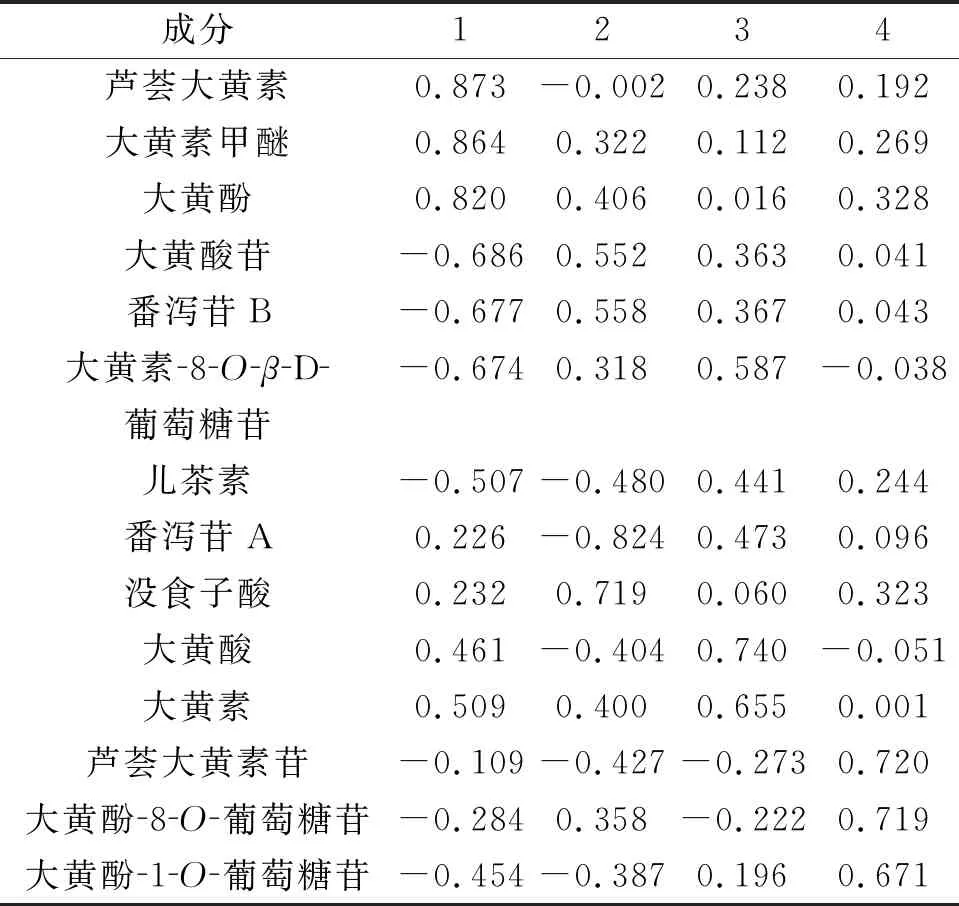
表6 主成分载荷矩阵
2.8.2 PLS-DA PLS-DA是一种无监督的模型识别方法,采用PLS-DA进行模式识别,可以寻找引起样品之间差异的变量。因此,为进一步寻找造成3种基原大黄之间差异的原因,在PCA的基础上,将含量测定结果作为变量导入SIMCA 14.0软件进行PLS-DA分析,得到的模型质量参数R2X为0.715,R2Y为0.823,预测能力参数Q2为0.779。因此,本实验所建立的模型预测效果较好。由PLS-DA得分图(图4)可以看出,3种基原大黄分布在不同的区域,表明该模型可以用于区别不同基原大黄,也进一步说明不同基原大黄之间化学成分存在显著的差异性。
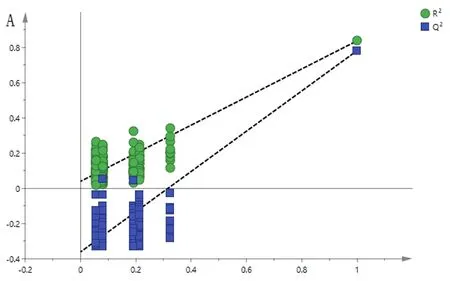
运用统计推断方法分析可验证鉴别模型[9],结果见图5A。由图可知,R2和Q2截距值分别为0.036 7和-0.362,所有位于左边的R2和Q2值均低于其最右边的值,且Q2的回归线截距小于0,说明建立的PLS-DA模型没有出现过拟合现象,预测能力较好。采用变量重要性投影值(VIP)筛选造成3种基原大黄差异性的标志物,其中VIP值大于1的成分有:大黄素-8-O-β-D-葡萄糖苷、番泻苷A、儿茶素、大黄酸苷、番泻苷B、大黄酸,表明这6个化学成分是引起不同基原大黄差异的主要标志性成分,结果见图5B。
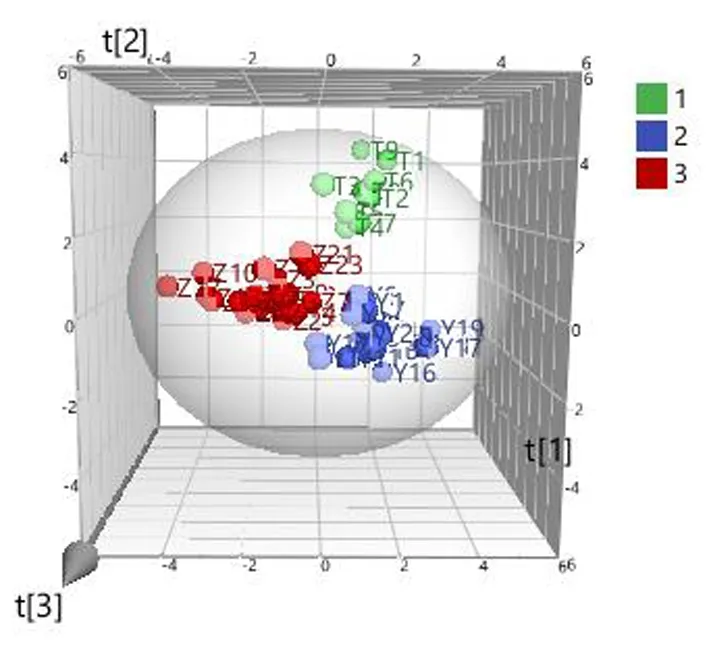
图4 PLS-DA得分图
注:1.没食子酸;2.儿茶素;3.芦荟大黄素苷;4.大黄酸苷;5.番泻苷B;6.番泻苷A; 7.大黄酚-1-O-葡萄糖苷;8.大黄酚-8-O-葡萄糖苷;9.大黄素-8-O-β-D-葡萄糖苷; 10.芦荟大黄素;11.大黄酸;12.大黄素;13.大黄酚;14.大黄素甲醚图5 PLS-DA模型置换验证图(A)及14个化学成分的VIP值(B)
3 讨论
近年来,研究不同基原大黄的文献众多,但研究中普遍存在样品量较少、药材的来源不明确等问题[5,10-11]。本研究从3种大黄的道地产区及主产区收集多个批次的样品进行分析,通过保证药材来源的道地性和代表性,使研究结果具有客观性和普遍性,提高了研究的参考价值。在收集唐古特大黄药材的过程中,发现3批伪品大黄,其指纹图谱与其他样品差异性较大,与对照图谱的相似度均低于0.30,且在图谱中检测到土大黄苷,而几乎检测不到大黄酸和番泻苷A、番泻苷B,这与逄瑜等[7]的研究结论一致。因此,本研究所建立的方法还可为大黄药材真伪的鉴别提供依据。
大黄含有的化学成分复杂,采用HPLC法建立指纹图谱存在分析时间过长、色谱峰分离效果不佳等问题[6,12]。本实验采用UPLC建立了可在较短时间内实现指纹图谱分析和多个化学成分含量测定的方法。建立的对照指纹图谱色谱峰分离度良好,共有峰数目较多,可以为基原鉴别提供依据。相似度评价结果表明,唐古特大黄可与其他2个基原大黄明显区分。但部分药用大黄图谱与掌叶大黄图谱总体峰形特征相似,相似度较高。多个批次药材的含量测定结果也表明,药用大黄中所含的多个游离蒽醌类化合物含量高于掌叶大黄,这与相关文献研究中药用大黄的整体图谱色谱峰峰面积小、质量较差,掌叶大黄所含游离蒽醌类化合物的含量高于药用大黄的结论不一致[5,13-14]。由于药用大黄产量少,较难收集[14-15],研究中涉及的药用大黄样品较少,3种基原大黄质量优劣的结果与文献结论不一。因此,在正品大黄中药用大黄的品质还有待进一步深入研究。
PLS-DA分析与聚类分析相比,可将51批大黄分为3类,分类效果显著。在目前大黄的研究中,关于不同基原大黄的差异成分报道较少,本研究通过PLS-DA筛选出不同基原大黄之间的差异性成分,但筛选出的主要差异性成分尚需要作进一步药理研究,明确药效上的差别。
