基于学习进阶的“化学平衡”教学实践
2021-02-18郑国雄张贤金
郑国雄 张贤金
摘要:基于学习进阶理论的视角,探讨化学核心概念的教与学是当前研究的一个新视角。化学平衡是中学化学中的核心概念,对“化学平衡”的学习进阶分析,深入地了解学生的学习困难和障碍点,整体规划学习路径并设置了合适的“阶”即“脚踏点”,通过认知路径显性化、增强概念本原性理解、认知思路结构化等,引导学生达到中间成就水平,扫除进阶中的障碍点,实现“从知识、到思维、到观念、到素养”的进阶。
关键词:高中化学;学习进阶;化学平衡
文章编号:1008-0546(2021)10-0068-04中图分类号:G632.41文献标识码:B
doi:10.3969/j.issn.1008-0546.2021.10.016
*本文系福建省教育科学“十三五”规划2020年度教改专项立项课题“基于学习进阶的高中化学主题教学设计与实践研究”(课题编号:Fjjgzx20-039)阶段性成果。
化学核心概念如何教与学是化学教育研究领域的一个重要话题。基于学习进阶理论的视角,探讨化学核心概念的教与学是当前研究的一个新视角。学习进阶理论关注学生的思维发展的连续性与阶段性,提出学习的不同阶段的认识对象和认识视角[1]。围绕核心概念教学,教师首先任务是拆解概念,规划学习的中间水平,也是学生学习的阶段起点与落脚点[2-3],即“阶”,对进阶维度——学生所需掌握的核心概念进行刻画和具体描述,再评估学生思维发展过程中的关联性、层次性及认知障碍,关注潜在特质变化及进步表现,反馈学生是否达到预期水平并给予相应支持帮助,将任务和证据与之匹配,激励学生在更大程度的自主学习中收获成就感,更进一步持续学习,以达成能力、素养目标。本文以“化学平衡”概念的教学为例,探讨基于学习进阶的化学核心概念教学实践路径。
一、“化学平衡”的学习进阶分析
“平衡”概念抽象、复杂,是学生学习的难点。笔者围绕《化学反应原理》中的“化学平衡”概念,进行教学设计研究。以学习进阶理论为指引,以核心素养为进阶目标,通过学案导学、递进式的问题设计和情境激疑深究等教学方法,引导学生进行体验式、研究式学习,扩展学生认知对象和视角,完善认知结构,提升学生学科认知水平。
根据课程标准[4]中对“化学平衡”的学业要求、核心素养的五个方面之一—“变化观念和平衡思想”描述,可以划分出5个进阶预期水平,见表1。

概念的理解存在“经验、映射、关联、系统、整合”五个发展水平[5]。同样,化学平衡观念的形成,也要先借助于一些感性认识,从实验或生活经验中认识化学平衡及其影响因素,再用定量思维解释化学平衡,进而与化学反应速率等其他概念进行辨析,形成结构化的认知体系,最终上升为哲学思维。
二、基于学习进阶的“化学平衡”教学探索
为让学生通过学习,在知识、思维、观念和素养等四个层面有逐步提升,最终达到预期水平,从以下4个方面对“化学平衡”教学进行探索。
1.由粗浅到本原,促进概念理解的进阶发展
针对学生学习概念时,常因受到迷思概念的干扰或者混淆一些相似概念进入误区,缺乏本原化理解概念的内涵;对概念的理解陷入表浅或孤立,缺少整体、统摄思维,没有形成概念网络和知识体系,即“只见树木不见森林”;理解不深刻导致思路不够清晰或不会应用,认识视角窄,思维单一或者僵化;囿于下位、应用的思考,没有形成正确的学科观念,无法迁移拓展于其他领域,更谈不上感悟到学科本质和价值。针对以上这些现象,设计学习路径要明确学习的明线与暗线。明线是指知识概念的逻辑序列、教学情景和活动,对“反应的可逆性→平衡的建立→特点→标志→平衡常数→转化率→计算→影响平衡的因素→平衡移动的方向→平衡图像解析→应用”概念逻辑顺序匹配相应的情景、问题、活动、反馈评价。暗线是能力素养的进阶,如表1描述,学习中不能只认识几个概念,还应联系到其他学科领域中平衡观点,建立“平衡观”,进行一定深度的哲学思考,能用对立统一、联系发展和动态平衡的观点考察化学反应,并用于解释生产生活中一些化学现象,或探究设计新反应。
平衡的建立、特点、移动是平衡的分支概念,其中化学平衡常数是重要概念。因为正逆反应的势相当,导致表面的“静止”,这是平衡状态的本质与表象关系。平衡时各个状态函数固定不变,其平衡体系中成分浓度或气体分压的幂之积之商为一常数,“势相当”也是平衡常数的根源。概念的学习不能只停留在文本的理解和要点剖析上,还要明确其化学意义和应用。所以要进行深层次思考,追根溯源、探寻本质,理解概念的本原,即内涵、本质、规律。如平衡常数为什么只与温度有关,因为温度改变了吉布斯自由能变,改变了反应的限度,K是生成物与反应物之间的化学势差的体现,只与反应本身及温度有关,而与初始的濃度压强无关。浓度压强是改变了Q,让Q重新适应K。就如密度是用质量与体积计算,但密度是物体本身属性,而与质量或体积大小无关。因此,教师必须重视知识的本原性理解,避免让学生记背知识,也可以最大程度减少迷思概念对学习的负面影响。
2.由零散到系统,促进思维模型的进阶发展
与化学平衡相似或关联的概念较多,经常有学生误认为反应快的限度大,混淆了反应速率与平衡限度。催化剂对平衡的影响,部分学生误认为催化剂会使平衡发生移动,因为他认为催化剂改变反应的速率,所以平衡必然移动。许多学生混淆了压强、浓度对平衡移动影响。以下的图式思维能将与化学平衡相关的概念进行整合,建构完整的概念网络和整体的系统思维,见图1。
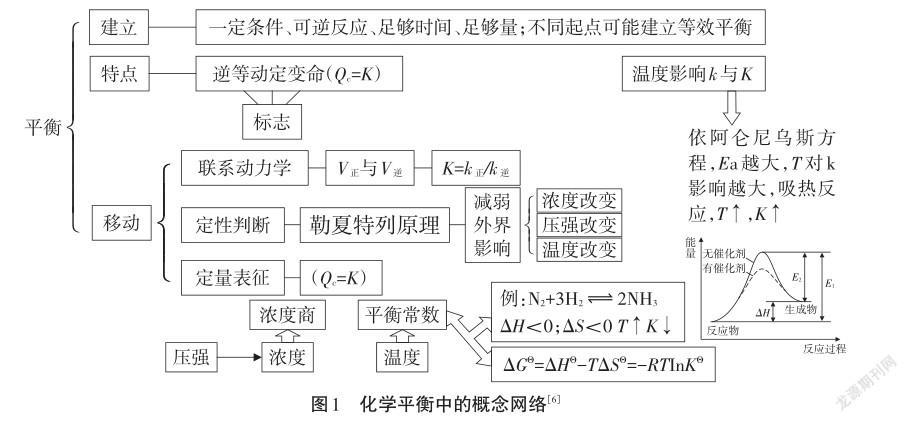
平衡是势相当,而非量相等或浓度相等,所以当反应物与生成物浓度相等或比等于化学计量数比时,不代表一定是平衡状态。化学反应速率是对反应快慢的描述,与反应历程有密切关系,而化学平衡是一种状态,与过程没有必然联系,所以不同的起点可以建立成“等效平衡”。正、逆反应相等时,意味着反应物不再减少,生成物不再增加,但表面的“波平浪静”实则内部的“暗流涌动”,所以“等势”是本质,“浓度、百分含量不变”是表象。因为是动态平衡,所以它可以对外界施加的影响作出一定的“响应”,减弱外界改变的影响。勒夏特列原理能快速定性地判断平衡移动方向,但它也有局限性,只能改变一个条件,只适用于封闭均相体系。但它也体现一个动态平衡体系的自稳定机理,可以联系物理学的“楞次定律—感应电流的磁场总要阻碍引起感应电流的磁通量的变化”,形成跨学科概念和科学观念,并对化学平衡进行哲学思考。压强、浓度的影响有联系也有区别,压强对平衡影响首先要转化为浓度改变的影响,浓度改变会改变速率。对气体分子数不变的平衡体系则平衡不移动。压强改变一般默认为气体总体积的变化,而浓度改变一般是指只改变一种物质的浓度。温度对k、K的影响可以分别得出温度如何影响速率与平衡,一般的反应活化能是大于0,所以依据阿仑尼乌斯公式(k= A·e-Ea/RT)可得,温度升高,反应速率提高。对于吸热反应,因为正反应活化能>逆反应活化能,所以正反应速率受温度影响更大,当升高相同温度,正反应速率提高的倍数>逆反应速率,正反应更有优势,即K增大。合成氨是放热反应,所以温度升高,K减小。使用催化剂,降低了正、逆反应活化能,同时增大k正和k逆,增大倍数相等,因为对于基元可逆反应而言,K=k正/k逆,所以K不变,平衡不移动。ΔGΘ不仅体现反应的方向,也是反应趋势限度的表现,所以ΔGΘ越负,K越大。借助这样图式,能够形成清晰的思维导图,学生在解决化学平衡问题时,自然而然地应用了一个思维模型:确立可逆反应,写出平衡表达式,依据K与Q关系判断平衡移动的方向,分析得出平衡移动的结果。
3.由解题到研究,促进学科观念的进阶发展
学生只了解化学平衡概念的要素、内涵是不够的,要提升到定量、综合、图像、模型理解水平,并能熟练综合应用于解释生产科研中的化学问题,这需要在进阶学习中从繁杂的化学知识体系中提取学科思维方式与方法,形成正确的学科观念。
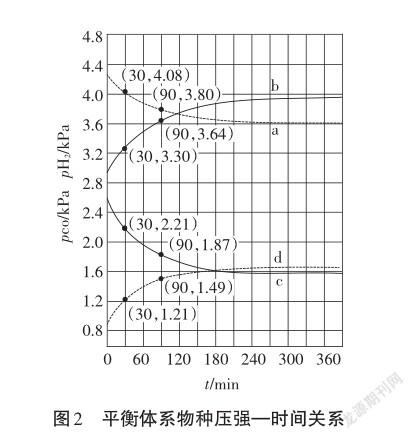
以2019全国理综Ⅰ卷-28题(节选)为例,谈在进阶障碍点实现教学突破。该道题源于科研文献,是一个真实情景的学术问题,信息量大,需要学生提取、加工、整合其中的有效信息,并调动各个方面的化学原理知识,进行综合分析判断。研究结果计算得出,CO(g)+H2O(g)CO2(g)+H2(g)ΔH=-69kJ·mol-1;K= 1.32(721℃下)。Shoichi研究了467℃、489℃时水煤气变换中CO和H2分压随时间变化关系(如图2所示),催化剂为氧化铁,实验初始时体系中的pH2O和pCO相等、pCO2和pH2相等。467℃时pH2和pCO随时间变化关系的曲线分别是、。489℃时pH2和pCO随时间变化关系的曲线分别是、。【答案】bcad
引导学生进行研究性学习:难点是不能直接判断四条曲线的组合(同一方向投料的反应中,因为该反应中四种物质的化学计量数相等,均等于1,生成物压强增大与反应物压强减小的绝对值是相等的。根据30-90min时段,图中曲线a减小0.28,曲线d增大0.28,是一个组合;曲线c减小0.34,曲线b增大0.34,是一个组合)。学生容易忽略投料是两个不同的方向,很容易误认为斜率绝对值大的一定是温度高的,因为即使起始气体总压强相等,但因为正反应方向是放热的,所以正反应的活化能是小于逆反应的活化能。可能出现情况是:虽然温度更高,其反应速率更小,原因是活化能大的反应速率小,事实也是如此。根据正反应方向是放热,所以温度越低,其平衡常数越大,所以K(467℃)>K(489℃)>K(721℃)>1,意味着a、b表示的是H2的分压,c、d表示的是CO的分压,而且b、c表示的是467℃;a、d表示的是489℃;因为平衡时b/c>a/d。
该道题综合运用了速率与平衡原理,需要学生在复杂、不良结构的问题情境中有效获取信息,加工整合,与原理进行综合运用,解决问题。这也是学习进阶要求:从知道到理解、到应用、到综合。应让学生基于情境获得知识、应用知识,从而在丰富其认知结构的同时,有效培养学生解决实际问题的能力和创新意识。
4.由机械到灵活,促进问题解决能力的进阶发展
平常教学中,经常是教师展示了“三段式”计算的模式,只强调格式的重要性,却忽略了这个模式背后深层的原因,没有说明是基于什么原理,这样学生学了“套路”,没有追根溯源。以下以一道高考题为例,分析如何加深学生对化学学科本质的理解。例:2018全国理综Ⅰ卷-28题(节选)-F. Daniels等曾利用测压法在刚性反应器中研究了25℃时N2O(5g)分解反应:

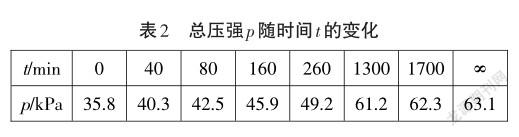
在分析这道题时,先要充分预估学生的解题困难点,为引导学生深入思考作铺垫,也是破解题目的关键。引导学生发散思维,一题多解,拓展视角,并加深了对平衡计算的认识。具体见表3。

运用3种解法,为学生打开平衡计算的视野,能让学生深思“三段式”计算模型的本质和意义,“平衡”的建立体现过程与结果的关系,须符合反应中质量守恒定律。这样让学生体会到概念的理解应该是從事实到方法、到方法论、到学科本质。帮助学生从记忆型思维向理解型思维转化,实现深度学习,发展高阶思维,体会到化学学科的定量思维方式对生产科研的重要意义。
三、结束语
“化学平衡”是核心概念,让学生从概念理解进阶到形成平衡观念,理解化学学科本质,推崇化学价值。教学中需要经历多个中间水平,所以教学设计应该有总目标、总规划,充分考虑学生的不同基础和认知水平,多路径开发学习进阶过程,适时反馈阶段达成度,调整阶段目标。通过教学实践,笔者认为本设计研究对其他概念教学实践同样有借鉴意义的经验有:一是,概念的文本描述学生多读几遍或许能短暂记下,但要深刻理解概念的内涵本质规律,则需要放在概念群中辨析整合,融入原有的知识体系,这就需要教学重点放在深化概念的本原性与结构化理解。二是,因为充分考虑学生个体差异性,深入地了解学生的学习困难和障碍点,不仅有知识缺漏,还有思维漏洞,为学习路径进行整体规划、设置中间的“脚踏点”提供依据,这样才能让学生在学习进阶中顺畅过关,按期达标。因为中间的“脚踏点”有具体的指标、路径方法、帮助和资源补给方法,让学习更多自主地进行,学生在完成阶段目标后也有成就感和进一步学习的动力。三是,学习进阶契合素养的形成层级性,在“学习进阶”教学中,师生都要明确知识仅仅是载体,更重要的是扩展自己的认识对象与视角,发展关键能力和学科核心素养。
参考文献
[1]姜显光.高中化学反应限度学习进阶研究[D].长春:东北师范大学,2019
[2]王桂桃,严文法.基于SOLO分类理论的化学核心概念学习进阶研究——以“化学平衡”为例[J].化学教与学,2017(5):2-5
[3]邹国华,童文昭.“离子反应”学习进阶及其教学分析[J].化学教育,2018,39(17):22-25
[4]中华人民共和国教育部.普通高中化学课程标准(2017年版)[S].北京:人民教育出版社,2018:4-5,33
[5]郭玉英,姚建欣.基于核心素养学习进阶的科学教学设计[J].课程·教材·教法,2016,36(11):64-70
[6]北京师范大学,华中师范大学,南京师范大学无机化学教研室.无机化学(第四版)[M].北京:高等教育出版社,2003:620
