葫芦素B抑制CIP2A/AKT表达抗非小细胞肺癌的作用
2021-02-17王菊辉丘韶校徐羽中李元广
王菊辉 丘韶校 徐羽中 李元广 何 臣
肺癌是全世界癌症死亡的主要原因,其最常见的病理类型非小细胞肺癌(NSCLC),占所有病例的83%[1]。近年来肺癌治疗取得了长足的发展,但肺癌死亡率仍居高不下,肺癌的整体治疗效果仍较差,非小细胞肺癌5年相对存活率仅为23%[2]。探讨新的肺癌治疗药物及其作用机制已成为肺癌治疗的突破点。PP2A的内源性癌性抑制剂CIP2A是一种人类癌蛋白,在多种人类恶性肿瘤的增殖和侵袭中起重要作用[3],研究表明,CIP2A可促进不依赖贴壁的细胞生长和体内肿瘤形成,并在结肠及头颈部恶性肿瘤中过表达[4]。且其过表达与肿瘤侵袭,转移和患者生存相关[5]。在肺癌标本中及人肺癌细胞株中也被证明存在CIP2A的过表达,并且CIP2A的过表达与肺癌患者预后相关[6]。CIP2A 抑制抑癌蛋白PP2A的表达使AKT的磷酸化(pAkt)下降,从而促进了肿瘤的增殖和进展[7]。在骨肉瘤细胞、肝癌细胞、乳腺癌细胞等多种肿瘤细胞的研究中被证实[8]。在阿曼托双黄酮及氯硝柳胺作为CIP2A的癌性抑制剂的实验中发现其可促进非小细胞肺癌细胞凋亡[9,10],从而发挥抗癌作用。葫芦素B ( Cucurbitacin B )是葫芦素家族中含量最丰富的成员,其抗肿瘤作用是近年来的研究重点,既往的多项研究显示葫芦素B可能通过抑制多种细胞信号传导通路来抑制肿瘤生长和促进肿瘤细胞凋亡[11],但其在不同肿瘤细胞中机制并不完全相同。在多柔比星耐药乳腺癌细胞[12]、耐药胃癌细胞[13]、多形性胶质母细胞瘤[14]中发现葫芦素B通过抑制CIP2A下调pAkt的表达,加速了肿瘤细胞的凋亡。综上,葫芦素B在多种肿瘤细胞中通过抑制CIP2A下调癌症相关信号通路AKT的表达,促进肿瘤细胞凋亡,但葫芦素B在非小细胞肺癌中是否存在相同机制尚需进一步研究,在本研究中我们探讨了葫芦素B通过CIP2A/AKT对非小细胞肺癌A549细胞的影响。
1 材料与方法
1.1 材料
非小细胞肺癌 A549 细胞购于中国科学院上海细胞库;葫芦素 B、MTS、DMSO购自美国Sigma公司;胎牛血清、RPMI 1640 培养基、胰蛋白酶购自美国Gibco公司;BCA蛋白定量试剂盒购自美国Pierce公司;PP2A 酶活性检测试剂盒购自 Upstate 公司;抗体购自美国Cell Signaling公司;二氧化碳恒温细胞培养箱购自美国Hera-eus公司;超净台购自苏州净化设备厂;细胞计数板上海医用仪器公司;台式高速离心机购自上海安亭科学仪器厂;酶标仪购自芬兰Labsystem公司;垂直电泳仪购自美国Biorad公司。
1.2 实验方法
1.2.1 细胞传代培养 参考文献[15]进行实验,实验方法简述如下:用培养液(10%胎牛血清+RPMI1640)培养肺腺癌A549细胞,将细胞置于温度:37℃,湿度:饱和,CO2浓度5%的培养箱中。观察细胞生长情况,当细胞生长至80%融合时进行一次传代,在本次实验中选用生长良好的对数生长期细胞,实验重复3次[15]。
1.2.2 MTS法检测细胞增殖 参照文献[15]方法进行,简述如下:将已用胰酶消化,离心后的A549细胞制成浓度为3×104个/ml的细胞悬液,以每孔100 μl在96孔培养板中加入细胞悬液,观察细胞贴壁后加入不同浓度的葫芦素B储存液,使其终浓度分别为0、20、40、80 nmol/l,试剂对照组及细胞对照组均设置3个复孔,并在条件为37℃、饱和湿度、5% CO2的培养箱中培养,24、48 h后在96孔培养板中加入MTS溶液,每孔10 μl,孵育4 h,在酶标仪上490 nm处检测OD值,计算细胞存活率[存活率=1-(对照组-实验组)/对照组]×100%。
1.2.3 划痕实验检测细胞迁移 在6孔板上平铺细胞密度为5×105个/ml的A549细胞,每孔500 μl,同时加入含RPMI 1640培养液,其中含10%胎牛血清,在上述培养条件下培养24 h,观察是否形成单层细胞。用marker笔在细胞呈单层生长的6孔板背后,用直尺均匀划间隔约0.5 cm的横线,直线横穿过孔,用PBS清洗3次,随后分别加入终浓度为0、20、40、80 nmol/l葫芦素B,放入培养箱中培养,培养条件同上,在0 h、24 h、48 h拍照取样。取样后图片用Image J软件处理,随机在细胞边缘划取6条直线,计算两直线间距离,计算均值后代表细胞迁移距离。
1.2.4 PI染色法检测细胞周期 参照文献[15],取胰酶消化,离心后的A549细胞,以浓度为5×105个/ml制成细胞悬液,在6孔板中接种细胞悬液,2 ml/孔,在同上所述相同条件下培养24 h;更换培养基,加入终浓度为0、20、40、80 nmol/l及DMSO对照的葫芦素B,继续在相同条件分别培养2 h、48 h。将以上所得细胞制成细胞悬液,细胞浓度为5×105个/ml,取细胞悬液1 ml离心(2000 rpm),弃去上清液后加入1 ml PBS液,继续2000 rpm离心2次,每次2 min,弃去上清,加入-20 ℃70%乙醇3 ml,混匀后,4℃固定过夜,2000 rpm离心2 min,弃去上清,加入1 ml PBS液重悬细胞;再次2000 rpm离心2 min,弃上清,加入浓度为100 mg/ml的PI染液500 μl,其中含50 μg/ml RNA酶;经30 min避光染色后上机用流式细胞仪检测,所得结果用Multicycle软件进行分析。
1.2.5 流式细胞仪检测细胞凋亡 参照文献[15],用不含EDTA的胰酶消化细胞后,1500 rpm,离心3 min,去除上清液后,用PBS液洗涤1遍,用PBS重悬细胞离心细胞,取含5×105个细胞的细胞悬液,离心后弃去上清后加入Binding buffer 500 μl重悬细胞,加入5 μl Annexin V-APC,混匀细胞后,加入7-AAD染液5 μl,再次混匀,在室温避光环境下反应10 min,置于冰上1 h内进行流式细胞仪检测。
1.2.6 Westem blot法检测CIP2A、P-AKT、AKT表达 取已消化离心处于对数生长期的A549细胞,配成细胞浓度为5×105个/ml的细胞悬液,在10 cm培养基上接种细胞悬液10 ml,观察细胞生长至80%时,换用含40 nmol/l、80 nmol/l葫芦素B及DMSO对照的完全培养基培养,分成24 h组、48 h组,收集经上诉处理后的细胞,加入PIRA裂解液裂解冰浴,每分钟12000 r,4℃环境下离心10 min,取离心后上清液,BCA法测定蛋白浓度,加入同体积的SDS,混合震荡均匀,在99 ℃环境下煮5 min,使蛋白变性。经SDS-PAGE电泳,PVDF转膜后5%牛奶封闭,一抗在4 ℃下孵育过夜,HRP(辣根过氧化物酶)标记后的二抗在室温下2 h孵育,ECL发光盒显影检测。
1.3 统计学分析
2 结果
2.1 葫芦素B对A549细胞增殖的抑制作用
根据MTS结果可知,浓度不同的葫芦素B处理A549细胞24 h及48 h后均对细胞的增殖存在抑制作用,且细胞存活数与药物浓度及作用时间呈负相关。经ANOVA方差后,P<0.05。用LSD-t检验后示不同试剂及不同时间分组与对照组间均存在有显著性意义(P<0.05),且在80 nmol/l、48 h组时存活率达最低,为54.8%(其中P<0.0001),综上提示葫芦素B以剂量、时间依赖性抑制A549细胞的增殖(表1)。

表1 不同浓度葫芦素B作用A549细胞不同时间后细胞存活率检测
2.2 葫芦素B对A549细胞迁移的抑制作用
浓度不同的葫芦素B处理A549细胞24h及48h后与对照组相比对细胞的迁移能力存在抑制作用,且细胞迁移距离与药物浓度及作用时间一定程度上呈负相关,且在48 h 80 nmol/l时达到最小迁移距离,此结果提示葫芦素B以剂量及时间依赖性抑制A549细胞迁移,见图1。

图1 不同浓度葫芦素B作用A549细胞不同时间后的迁移距离
2.3 葫芦素B对A549细胞周期分布的影响
浓度不同的葫芦素B处理A549细胞24h及48h后经流式检测:随着浓度梯度的增大及作用时间的延长,处于G2/M期细胞的比例逐渐增加,显示葫芦素B导致A549细胞G2/M期阻滞,且与作用浓度及时间呈正相关,见图2。
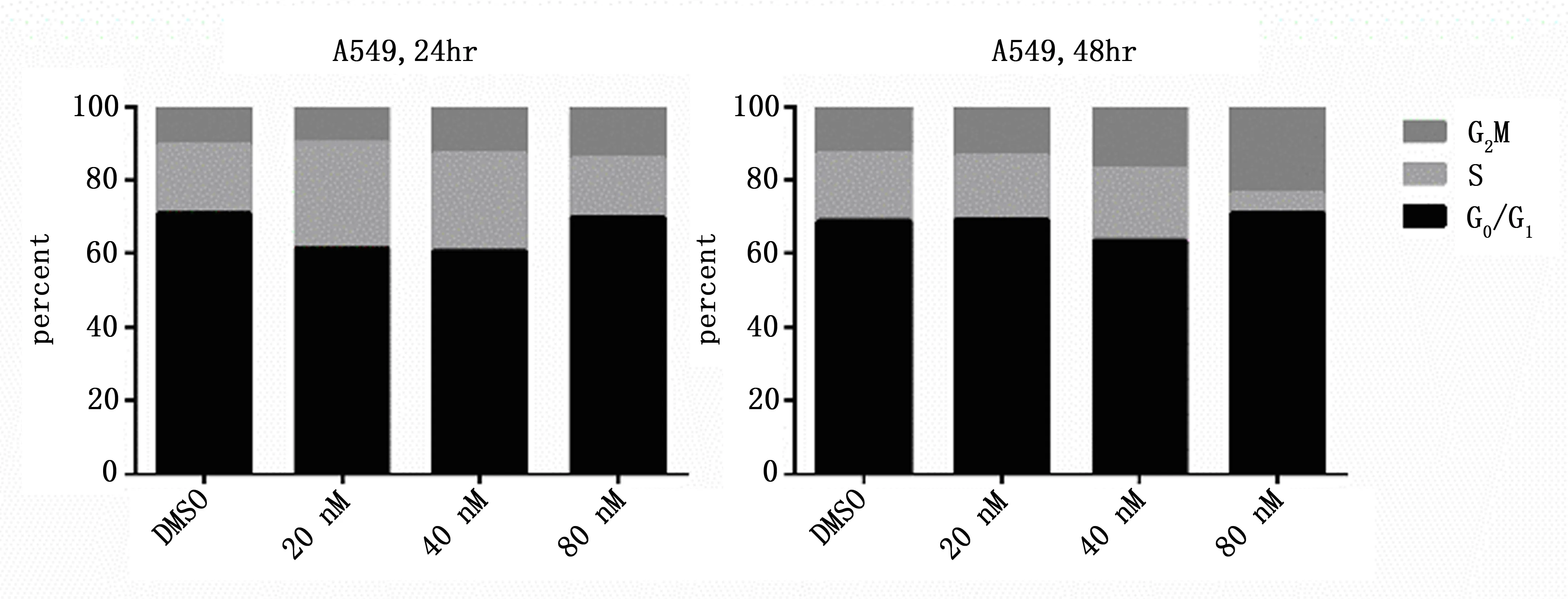
图2 不同浓度葫芦素B作用A549细胞不同时间后细胞周期分布
2.4 流式细胞仪检测葫芦素B对A549细胞凋亡的影响
浓度不同的葫芦素B处理A549细胞24 h及48 h后经流式检测显示葫芦素B促进细胞的凋亡,且葫芦素B的浓度及作用时间与细胞凋亡呈正相关,在48 h,浓度为80 nmol/l时达到最大细胞凋亡率32.1%,与对照组相比具有显著差异,见图3。

图3 不同浓度葫芦素B作用A549细胞不同时间后细胞凋亡影响
2.5 葫芦素B作用于A549细胞后对CIP2A、PAKT、AKT蛋白表达的影响
Western blot检测葫芦素B在40 nmol/l浓度下,作用A549细胞24 h及48 h后对CIP2A、PAKT、AKT表达的影响,结果显示与对照组相比,CIP2A、PAKT表达显著下降,且随着作用时间的延长,CIP2A、PAKT的表达随之下降。表明葫芦素B可抑制CIP2A的表达,从而抑制AKT的活化,且呈现时间依赖性,见图4。

图4 Western Blot检测40 nmol/l葫芦素B作用A549细胞不同时间后对蛋白表达的影响
3 讨论
近年来,随着中医药的发展,越来越多的中药成分用于临床治疗及辅助化疗中[11]。葫芦素B作为肿瘤药物的研究显示:葫芦素B对多种类型的肿瘤细胞具有明显的抑制作用,且在不同肿瘤细胞中其作用机制并不完全相同[16]。研究发现,葫芦素B对结肠癌、乳腺癌等实体肿瘤,及白血病等血液系统肿瘤均有抗肿瘤的效应。葫芦素B通过抑制肿瘤细胞增殖、迁移、侵袭、诱导细胞凋亡及阻滞细胞周期等发挥抗肿瘤作用[17]。在本研究中使用MTS法检测不同浓度葫芦素B处理A549细胞不同时间后,结果显示葫芦素B以剂量和时间依赖性抑制A549细胞增殖。且在80 nmol/l,48 h组时存活率达最低,为(54.8±2.8)%(其中P<0.0001)。细胞迁移是癌症转移的重要过程,划痕试验结果表明葫芦素B可抑制A549细胞迁移,且在一定程度上呈剂量、时间依赖性。流式细胞仪检测细胞周期结果显示,在不同作用时间及药物浓度下,葫芦素B均对A549细胞的凋亡产生了一定的促进作用,且细胞周期出现G2/M期阻滞,以上变化呈现出明显的剂量及时间依赖性。流式检测细胞凋亡结果显示,加入不同浓度葫芦素B后与对照组相比细胞凋亡明显增加,且这种增加表现为随着药物浓度梯度增加、作用时间延长,细胞凋亡率增加。表明在体外条件下葫芦素B对非小细胞肺癌具有促进凋亡的作用。综上表明,葫芦素B抑制了A549细胞增殖及侵袭,使细胞出现G2/M期阻滞,促进细胞的凋亡,从而发挥其抗肿瘤作用。这与既往葫芦素B在多种肿瘤细胞中的作用是一致的[11]。
CIP2A作为1个新兴的癌症治疗靶标,在多项研究中被证实,其通过抑制PP2A介导的Akt的去磷酸化来激活Akt从而促进肿瘤的发生[13]。Liang等在研究Rabdocoetsin B作为癌症抑制剂的实验中发现,Rabdocoetsin B可以作用于CIP2A/AKT通路来抑制肿瘤细胞的生长[18]。在研究多形性胶质母细胞瘤中,葫芦素B作为抑癌剂抑制了CIP2A的表达,并且通过调节其下游的AKT信号分子使多形性胶质母细胞瘤发生凋亡[14]。在本研究中,运用40nmol/l葫芦素B分别作用A549细胞24h及48h后,western Blot结果提示A549细胞中存在CIP2A表达,且与对照组相比,葫芦素B作用后A549细胞中CIP2A、PAKT的表达下降,且随着作用时间延长,CIP2A、PAKT的表达下降越明显,这与葫芦素B通过时间依赖性抑制非小细胞肺癌细胞凋亡是同步的,提示葫芦素B通过抑制CIP2A、PAKT的表达,抑制肿瘤细胞的增殖,促进细胞凋亡。
综上,我们的研究表明葫芦素B通过抑制CIP2A/AKT信号途径显著抑制非小细胞肺癌A549细胞的增殖、迁移,阻滞细胞周期于G2/M期,促进细胞的凋亡,进而发挥其抗癌作用。
