G蛋白偶联雌激素受体特异性活化促进骨肉瘤SW1353细胞生长的机制
2021-02-17邹平安陶志伟余腾骅
邹平安 徐 楠 陶志伟 王 熙 刘 哲 余腾骅
骨肉瘤是临床上最常见的原发性骨恶性肿瘤,好发于10~20岁青少年。尽管外科手术、化疗、放疗等综合治疗手段已使骨肉瘤患者的5年生存率获得较为显著的提高,但早期骨肉瘤的治疗方法仍以截肢为主,对患者的身体及心理造成了极为严重的伤害。临床数据进一步显示,约20%的骨肉瘤患者初诊时已发生远处转移,其中肺转移占90%[1]。化疗是临床控制肿瘤肺部转移的主要手段,遗憾的是,超过70%伴有肺转移的患者对化疗反应较差,化疗产生的毒性作用更是危及患者生命[2]。目前,虽有大量研究对骨肉瘤患者的临床治疗方案进行积极探索,如免疫治疗[3]、抗血管生成治疗[4]等,但均未获得满意的疗效。因此,寻找新的治疗模式进而提高骨肉瘤患者的预后及生活质量迫在眉睫。
研究发现,雌/孕激素受体(estrogen/progesterone receptor,ER/PR)在骨肉瘤组织及细胞中呈现一定比例的表达[5-6],且体外雌激素可刺激骨肉瘤MG-63细胞生长,应用雌激素受体阻断剂可部分抑制其增殖效应[7]。结合患者处于性激素旺盛期的疾病好发年龄,强烈提示骨肉瘤发生发展可能与激素受体的异常活化相关。研究团队前期大量的数据证实,G蛋白偶联雌激素受体(GPER)是除ER、PR外的第三种独立作用的雌激素受体,且在多种正常细胞与恶性肿瘤细胞系中均证实GPER可独立介导活化后的下游雌激素效应,提示GPER可能是预测多种肿瘤患者临床预后与治疗敏感性的有效生物学指标[8-12]。然而,目前GPER在骨肉瘤发生发展中的作用尚属于研究“盲点”。因此,本研究拟利用GPER特异性激动剂(G1)[10-12]及GPER特异性拮抗剂(G15)[10-12]等小分子化合物首次探讨GPER特异性活化对骨肉瘤细胞生长的影响。
1 材料与方法
1.1 材料
人成骨细胞系hFOB1.19与骨肉瘤细胞系MG-63、HOS、SW1353购自中国科学院上海细胞库,高糖DMEM培养基(Gibco公司),南美胎牛血清(Gibco公司)。G1与G15(Sigma公司),DAPI与FITC标记山羊抗兔IgG抗体(北京中杉金桥公司),总RNA提取试剂盒、逆转录试剂盒(TaKaRa公司),荧光定量PCR试剂盒(BioTeKe公司),GPER、cyclinA、cyclinD1、Actin抗体(Abcam公司),CCK-8试剂盒(碧云天公司)。流式细胞仪(FACS Callur),二氧化碳培养箱(BECKMEN公司),多功能酶标仪、全自动荧光PCR分析仪和稳压 DNA电泳仪(Bio-Rad公司),荧光倒置显微镜(Olympus公司)。
1.2 方法
1.2.1 细胞培养 hFOB1.19、MG-63、HOS与SW1353细胞均培养于10%胎牛血清的高糖DMEM培养基中,37 ℃、5% CO2培养箱内生长,隔日换液,待细胞密度生长至80%左右时用0.25%胰酶消化离心后传代。
1.2.2 数据库分析 使用生物信息学技术分析在线肿瘤基因表达阵列数据集(https://tnmplot.com/analysis/)内骨肉瘤组织和邻近正常组织中GPER基因表达差异(其中骨肉瘤组织88例,正常组织564例)。
1.2.3 荧光定量PCR检测GPER mRNA表达量 取对数生长期的hFOB1.19、MG-63、HOS与SW1353细胞,用Trizole试剂提取各组细胞总RNA,逆转录为cDNA。逆转录及PCR反应均按照TaKaRa试剂盒及荧光定量PCR试剂盒说明进行操作。GPER上游引物序列为5’-ACGAGACTGTGAAATCCGCAACCA-3’,下游引物序列为5’-ATCAGGCTGGAGGTGCACTTGGAA-3’;以β-Actin为内参对照,上游引物序列为5’-AGCGAGCATCCCCCAAAGTT-3’,下游引物序列为5’-GGGCACGAAGGCTCATCATT-3’。实验重复3次。
1.2.4 Western blot法检测GPER、cyclinA及cyclinD1蛋白表达 GPER蛋白检测实验中临床新鲜组织样本、成骨细胞系及骨肉瘤细胞系无需药物处理,按相应试剂盒说明书步骤进行检测。骨肉瘤SW1353细胞处理如下:待细胞生长至60%~70%密度,无血清DMEM培养基饥饿细胞12 h,依照实验分组加入100 nmol/L G1和/或1 μmol/L G15处理12 h,各组调整DMSO至一致,处理相应时间后立即终止,PBS洗3次,最后将细胞移入EP管中。收集组织/细胞、细胞总蛋白提取、测蛋白浓度、制胶、上样(200 μg)、电泳、转膜、封闭、一抗孵育(稀释比例均为1∶500)、二抗(山羊抗鼠/兔 IgG,1∶1000)孵育、ECL化学发光成像,Quantity one软件进行灰度值测定。实验重复3次。
1.2.5 细胞免疫荧光检测SW1353细胞中GPER表达定位 取对数期生长的SW1353细胞胰酶消化离心重悬后以3×105/ml接种于底部放有小玻片的24孔板中,置于细胞孵箱中培养,待细胞生长状态及密度合适后,取出24孔板用PBS洗3次,加入4%多聚甲醛200 μL固定20 min,PBS洗3次,10%山羊血清37℃封闭30 min,加入GPER抗体(1∶50稀释)30~40 μL,4℃孵育过夜,PBS洗3次,暗室中加入FITC荧光二抗(1∶100),37℃ 60 min,PBS洗3次,加入DAPI(1∶10)染核5 min,PBS洗3次,每次5 min,封片后于暗处倒置荧光显微镜下拍照。
1.2.6 CCK-8法检测SW1353细胞增殖 取对数生长期SW1353细胞接种于96孔板中,细胞贴壁后更换无血清培养基饥饿12 h后分别加入不同浓度(10 nmol/L、50 nmol/L、100 nmol/L、500 nmol/L与1 μmol/L)的G1或100 nmol/L G1和/或1 μmol/L G15处理上述细胞24 h,各组调整DMSO至一致。24 h后倒出培养基,每孔加入10 μL CCK-8试剂,细胞孵箱中孵育2 h,酶标仪测定各孔的吸光度(OD值),波长选择450 nm,获得各组相对细胞数。实验重复3次。
1.2.7 流式细胞学检测SW1353细胞周期 取对数生长期SW1353细胞接种于6孔板中,至肿瘤细胞密度达到约50%,移去培养基,PBS洗2次,加入无血清培养基饥饿24 h,使各组细胞周期同步于G0/G1期。分别加入100 nmol/L G1和/或1 μmol/L G15处理细胞24 h,各组调整DMSO至一致,24 h后收获SW1353细胞,70%乙醇固定,置于4℃冰箱过夜,PI染色避光室温孵育30 min,流式细胞仪检测肿瘤细胞中各细胞周期中DNA的含量。实验重复3次。
1.3 统计学分析

2 结果
2.1 GPER在骨肉瘤组织中的表达
应用生物信息学技术预测分析骨肉瘤组织(Tumor,n=88)及正常组织(Normal,n=564)中GPER的基因表达情况,结果显示GPER在骨肉瘤组织中的基因表达量显著升高(P<0.001,图1A)。我们进一步检测了临床3例新鲜样本中骨肉瘤组织(C)与正常组织(N)的GPER蛋白表达量,结果同样显示GPER在肿瘤组织中的表达量明显高于与之对应的正常组织(P<0.05,图1B)。
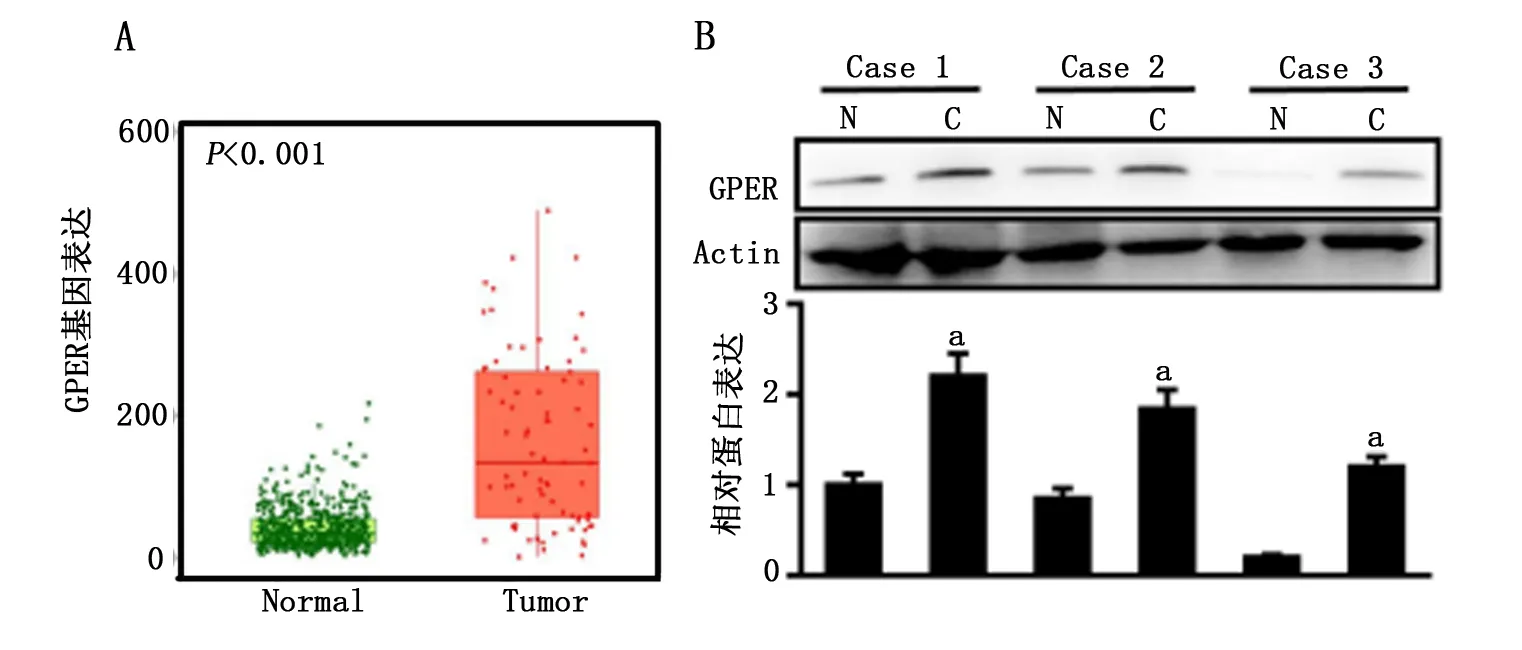
A:生物信息学预测GPER在骨肉瘤组织与正常组织中的基因表达水平(P<0.001,与Normal组比较);B:Western blot检测GPER在3例临床骨肉瘤组织与正常组织中的蛋白表达水平(a为与Normal组比较,P<0.05)。
2.2 骨肉瘤SW1353细胞系是良好的GPER体外研究模型
实时荧光定量PCR结果显示,3种骨肉瘤MG-63、HOS与SW1353细胞系中GPER mRNA表达水平均显著高于正常成骨hFOB1.19细胞系,且在SW1353细胞系中表达量最高(P<0.05,图2A)。Western blot检测亦获得了类似的实验结果(P<0.05,图2B),提示骨肉瘤SW1353细胞系是良好的、稳定的后续GPER体外研究模型。细胞免疫荧光实验进一步显示GPER主要表达于SW1353细胞核与细胞质中,细胞膜表达量较低(图2C)。
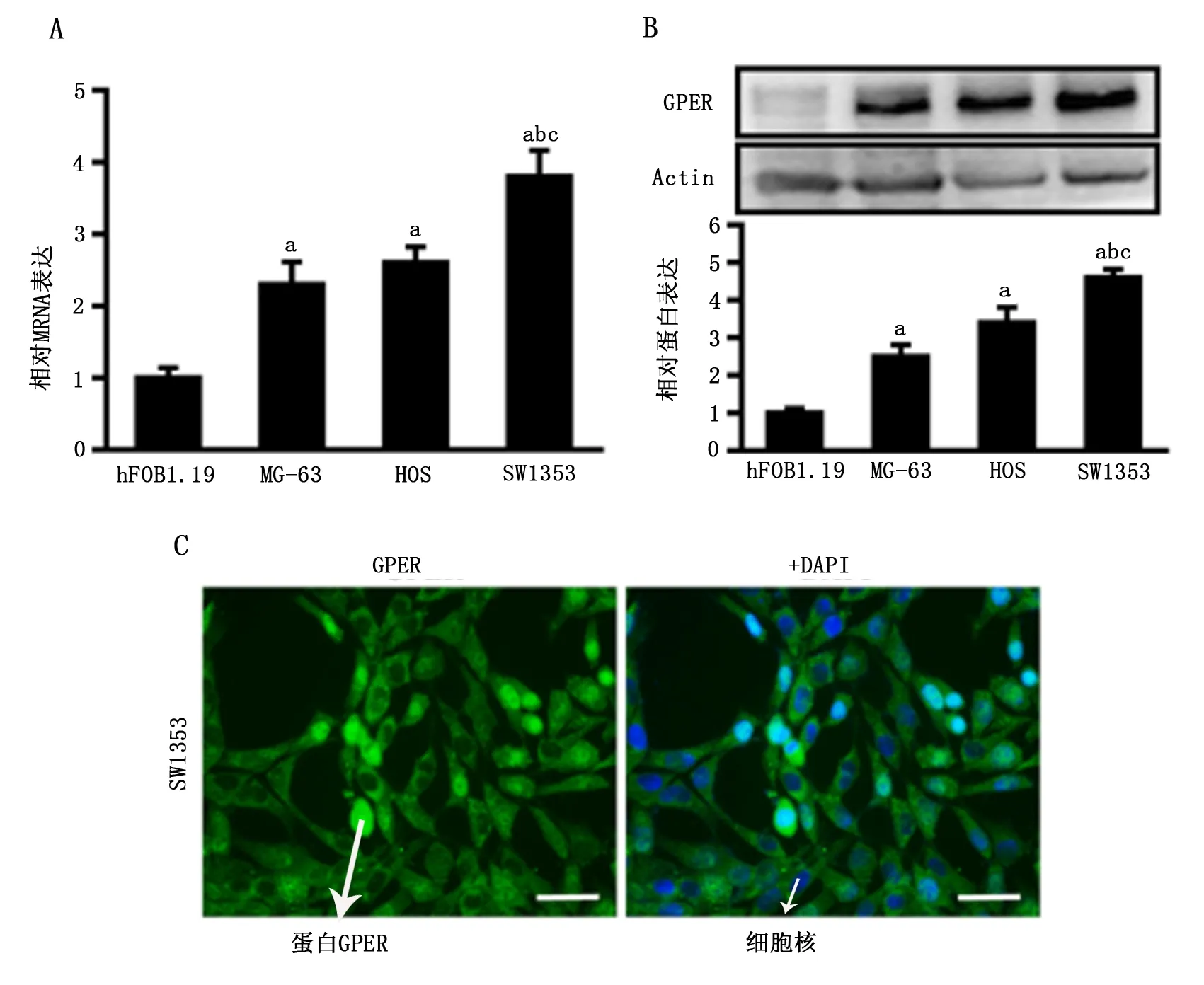
A-B:荧光定量PCR(A)与Western blot(B)分别检测正常成骨hFOB1.19细胞系与骨肉瘤MG-63、HOS与SW1353细胞系中GPER mRNA与蛋白的表达水平;a:P<0.05,与hFOB1.19细胞比较;b:P<0.05,与MG-63细胞比较;c:P<0.05,与HOS细胞比较。C:细胞免疫荧光法检测骨肉瘤SW1353细胞系中GPER的表达及细胞内定位情况(MERGE为两者融合图像,放大倍数400,标尺50 μm)。
2.3 G1特异性活化GPER对骨肉瘤SW1353细胞增殖的影响
G1药物浓度梯度实验(CCK-8实验)显示,100 nmol/L G1对SW1353细胞增殖有最佳的促进效应,而药物浓度进一步提升后,500 nmol/L与1 μmol/L G1将表现出一定的药物毒性,使SW1353细胞增殖能力减低(P<0.05,图3A)。此外,应用G15特异性拮抗GPER活性后,100 nmol/L G1诱导的SW1353细胞增殖能力显著下降(P<0.05,图3B)。以上数据均提示,G1特异性活化GPER能促进骨肉瘤SW1353细胞增殖,且最佳药物作用浓度为100 nmol/L。

A:不同浓度的G1处理24 h后对骨肉瘤SW1353细胞增殖的影响;a:P<0.05,与对照组比较。B:不同药物组合处理24 h后对骨肉瘤SW1353细胞增殖的影响;a:P<0.05,与对照组比较;b:P<0.05,与G1+G15组比较。
2.4 G1特异性活化GPER对骨肉瘤SW1353细胞周期进展的促进作用
流式细胞学分析显示,G1可明显增加SW1353细胞周期中DNA合成期(S期)细胞比例(P<0.05,图4A),促进细胞周期进展;与之相符的是,G1同时上调细胞周期蛋白cyclinA与cyclinD1的表达量(P<0.05,图4B),以上效应均可被G15所阻断(P<0.05,图4A-B)。
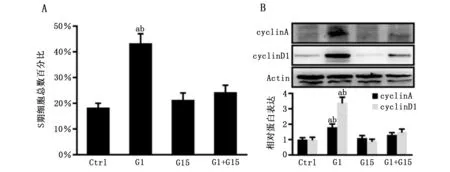
A-B:G1特异性活化GPER显著提高骨肉瘤SW1353细胞周期中S期细胞比例(A),同时上调细胞周期蛋白cyclinA与cyclinD1的表达(B);a:P<0.05,与对照组比较;b:P<0.05,与G1+G15组比较。
3 讨论
目前,少有研究证实雌激素受体介导的特异性活化可调节骨肉瘤临床进展,而有关新型雌激素受体GPER在骨肉瘤中的表达情况及其潜在生物学效应更是未知之数。为此,本实验进行此次研究,我们惊喜的发现GPER在骨肉瘤组织(体内)及骨肉瘤细胞系(体外)中均呈现高表达,在骨肉瘤SW1353细胞系中表达水平最高,其细胞内表达主要定位于细胞核与细胞质中;特异性激动剂G1可通过活化GPER显著促进骨肉瘤SW1353细胞增殖及细胞周期进展。结合本研究结果及团队的前期发现,我们推测GPER有望在未来成为骨肉瘤较好的潜在治疗靶点之一。
既往研究发现,大约20%的人类癌症与GPER的表达及功能状态相关[13]。然而,近年来大量报道显示GEPR在肿瘤发生发展中的作用尚存在一定争议。在表达水平方面,我们的前期研究发现GPER在肝癌、胃癌、结肠癌等多种消化道恶性肿瘤组织中的表达水平较正常组织显著降低[8-9]。相反,在ER+他莫昔芬耐药乳腺癌[10]、三阴性乳腺癌[12]、卵巢癌[14]等恶性肿瘤中,GPER在肿瘤组织中的表达量却显著升高。本研究也得到了类似的结果,GPER无论在临床样本组织中还是体外细胞系水平上,其在骨肉瘤中的表达量均显著高于正常组织或细胞,这提示GPER在骨肉瘤的恶性进展中可能扮演着促癌的关键因素。
我们在随后的细胞增殖与细胞周期功能学实验中进一步证实:GPER的特异性活化可显著增加骨肉瘤SW1353细胞周期中S期的细胞比例,促进细胞周期进展,且导致快速的细胞生长,应用GPER特异性拮抗剂G15则逆转以上变化。上述骨肉瘤中GPER介导的生物学效应与研究团队前期在三阴性乳腺癌中发现的作用极为相似[10-12],两者同为极度恶性的肿瘤亚型,这将有助于我们在未来更深入的探讨GPER在骨肉瘤中的具体生物学功能。有趣的是,本研究应用细胞免疫荧光方法还发现GPER可表达于骨肉瘤细胞内两种不同的亚细胞位置:细胞质与细胞核,这与我们前期在乳腺癌微环境肿瘤相关成纤维细胞(cancer-associated fibroblast,CAFs)中所得到的结果一致,即GPER可定位于CAFs的细胞核与细胞质中,分别特异性的介导下游GPER/ERK及GPER/PKA信号通路的活化[11],提示GPER在骨肉瘤中不同的亚细胞定位可能会发挥不同的生物学作用,然而这还有待更多的临床样本及体内外实验去验证。
细胞周期蛋白cyclinA与cyclinD1过表达时,可显著缩短细胞周期中G1期的比例,促使细胞提前进入S期进行大量的DNA合成,引起细胞生长失控。有研究报道,骨肉瘤发生发展中伴有显著的cyclinA与cyclinD1过表达现象,提示以上两种细胞周期蛋白的过表达对骨肉瘤的恶性进展具有重要意义[15-16]。同时,有学者提出GPER特异性活化介导的EGFR/ERK信号通路下游可以定位于cyclinA与cyclinD1的启动子区域促进其转录及翻译从而出现肿瘤异常生长[17]。我们用GPER特异性激动剂G1处理骨肉瘤SW1353细胞12 h后,Western blot方法检测到cyclinA与cyclinD1的蛋白表达量明显增加,而在G1联合G15的处理组中,两者的表达均被显著抑制,说明骨肉瘤中GPER特异性活化可能通过调控下游信号通路靶向cyclinA与cyclinD1过度表达,进而表现细胞周期进展及细胞过度生长的恶性生物学行为,但是具体的信号转导机制还有待后续进一步研究。
综上所述,作为独立作用的新型雌激素受体,本研究结果首次揭示GPER的特异性活化在骨肉瘤发生发展中的潜在功能,靶向GPER有望成为提高患者临床预后的新思路,但这还需要更多的体内及临床实验来进一步验证与支持。
