杜鹃兰种子非共生萌发中的形态结构变化
2021-02-15彭思静高燕燕杨宁线张明生
彭思静, 高燕燕, 杨宁线, 李 林, 阳 娇, 张明生
(贵州大学生命科学学院/山地植物资源保护与种质创新教育部重点实验室, 贵阳 550025)
杜鹃兰[Cremastraappendiculate(D.Don)Makino]为兰科(Orchidaceae)杜鹃兰属(Cremastra)多年生草本植物,具根状茎和假鳞茎[1],其干燥假鳞茎又名山慈菇,用于治疗上火引起的口鼻肿痛、肺热引起的咳嗽、跌打损伤引起的筋骨伤痛及烧伤烫伤[2],还可用于治疗食道癌、淋巴肿瘤等疾病[3],在急性痛风性关节炎、降糖降压治疗上有较好的效果[4],其化学成分如黄酮类、生物碱等均具有重要的药用价值,为紧缺中药材之一[5]。随着山慈菇药用成分的开发,市场需求增大,过度的采挖和生态环境破坏致其资源匮乏,又因其自然繁殖率极低,野生资源几近枯竭,使其处于濒危状态。
自然条件下,杜鹃兰结实率不到5%,本课题组前期通过人工辅助授粉可使其结实率提高到97.78%以上[6];虽然成熟蒴果含有大量种子,但种子极难萌发,一方面因为种胚未成熟且缺乏胚乳[7-8],另一方面,与热带地区的附生兰相比,温带地区陆生兰的种子萌发更为复杂,因为陆生兰的成熟种子通常有两层坚韧的种皮,即覆盖胚胎的内外种皮,其不透气及不透水性可能导致种子萌发困难[9];此外,随着种子成熟,抑制物质(如酚类化合物和脱落酸)的积累可诱导种胚的生理休眠[10-11]。有研究采用不同的方法来优化兰科种子的萌发,包括未成熟种子的培养[12]、液体悬浮培养[13]、添加植物生长调节剂,以及培养前对种子进行不同预处理,如划破种皮、KOH溶液浸种等,对兰科种子萌发率往往有较大影响[14-15]。
目前,有关杜鹃兰的研究主要集中在假鳞茎化学成分分析[16]、组培快繁[17]等方面,有关种子非共生萌发过程中各阶段形态结构变化鲜见报道。本研究采用种子非共生萌发,筛选种子最佳采收胚龄,观察种子不同发育时期的外部形态及内部结构变化,探究破除种皮抑制萌发的预处理方法,以期为构建杜鹃兰有效繁殖技术提供理论依据。
1 材料与方法
1.1 材 料
不同胚龄的杜鹃兰蒴果采自贵州大学实验农场(26°27′55″N,106°39′21″E),为人工授粉所得。果荚健康饱满、未开裂。
1.2 方 法
1.2.1不同胚龄种子萌发率测定
收集不同胚龄(60,75,90,120,135 d)的蒴果各5个,消毒后将不同蒴果内的种子(100~150粒)均匀撒播在萌发培养基(MS+NAA 1.0 mg·L-1+6-BA 1.0 mg·L-1+75 g·L-1土豆泥+0.5 g·L-1活性炭+4 g·L-1琼脂)上,培养基pH值为5.6。培养条件:(25±1)℃,光照强度1 500~2 000 lx,光照时长12 h·d-1。每个处理播种9瓶,3个重复。播种90 d后统计每瓶萌发率。
萌发率(%)=[(种胚突破种皮数+原球茎数+根状茎数)/接种的种子数]×100%[18]。
1.2.2形态学及解剖学观察
将萌发过程中不同阶段的组织材料置于Stemi 508体式显微镜和Hitachi S 4000 cFE-SEMs扫描电镜下观察并拍照,记录种子发育各阶段的形态变化特征及萌发情况。
不同阶段的样品用2.5%戊二醛和1.6%多聚甲醛固定液(pH=6.8)固定24 h。固定后,样品通过乙醇系列梯度脱水,然后用Technovit 7100(德国Kulzer & Co., Germany)逐渐渗透,将样本嵌入Technovit 7100中[19]。切片采用Laica RM 2016旋转切片机(8 μm厚),用甲苯胺蓝染色试剂盒(TBO,Sangon)进行常规组织学染色。中性树胶封片,切片置于Olympus BX 53光学显微镜下进行解剖结构观察并拍照。
1.2.3NaClO对种子TTC染色和萌发率影响的测定
为了评估NaClO对种子萌发率的影响,采用3因素3水平L9(34)正交设计,通过控制NaClO浓度和处理时间,以不同质量分数的TTC染液验证种子活力。置于光学显微镜下观察。种子经预处理后用无菌水漂洗3次进行非共生萌发实验(培养条件及萌发率统计同1.2.1)。
TTC染色率(%)=(视野内染色数/视野内种子总数)×100%。
1.3 数据统计分析
采用Origin软件作图,Microsoft Excel 2007软件和SPSS 19.0软件对试验结果进行统计学分析,用Duncan氏法进行差异显著性检验。
2 结果与分析
2.1 不同采收时间对杜鹃兰种子萌发的影响
不同采收时间对种子萌发率有明显的影响,表1结果显示,授粉后120 d时萌发率最高,达54.01%。在这一时期,种子含水量适中,呈黄白色絮状,胚体具有较高生活力。135 d后种子含水量低,随后蒴果裂开,种子被释放,种子萌发率显著降低(47.54%),木质素含量达最大值(315.37 mg·g-1),大多数种子已变成浅棕色。在60 d时收集的种子播种后没有萌发就大部分褐化,原因是种胚尚未发育完全,在培养基中无法吸水膨胀进而停止发育。此外,胚龄60~75 d的蒴果瘦小,与胚龄较大的蒴果存在明显差异,种子细小呈白色,含水量较高(85.3%),紧贴于胎座组织而难以分散开充分吸收养分。杜鹃兰种子成熟度对其萌发率有较大影响,授粉后120 d左右采收种子较为适宜。
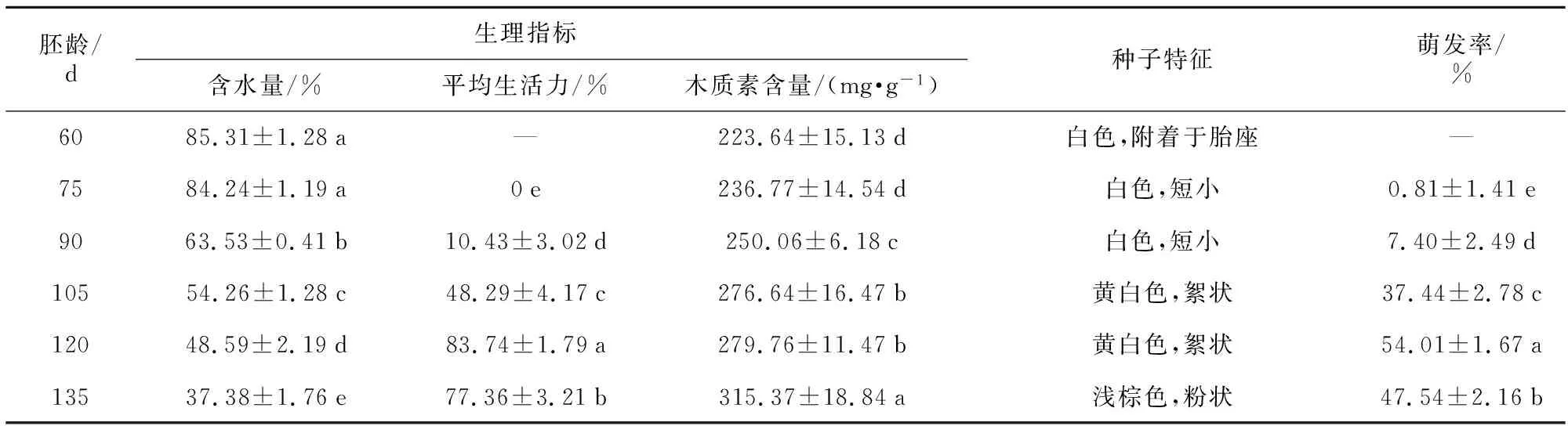
表1 不同采收时间对种子质量和萌发的影响
2.2 杜鹃兰种子结构及其非共生萌发过程的形态变化
杜鹃兰种子细小呈纺锤形,黄白色,通过扫描电镜观察到种皮表面未附着任何物质(图2 A),致密无间隙。种胚为尚未发育成胚的胚性细胞团,不含胚乳。种皮细胞壁木质化增厚且有纵横交错的网状条纹,使种胚不易吸收水分和交换气体,抑制了种胚发育(图2 B)。上述结果证明,杜鹃兰种子之所以在自然环境下难以萌发,除了缺乏营养物质外,还与种皮厚度、种皮细胞的疏密程度等自身结构有关。将种子播种于MS培养基30 d后,种胚吸水膨胀变大(图3 B),并挤压种皮,种皮被撕裂。45 d左右露出局部种胚(图2 C、图2 D)。种胚渐渐出现极性,在形成小球状胚体时,能观察到多数粘连有已破碎的种皮(图2 F)。
观察发现,种子非共生萌发初期形成的原球茎多呈椭球形。光照条件下,球状体顶端细胞内形成叶绿体,使原球茎从白色变为绿色(图3 D)。顶端分化出叶原基,绿色芽点在后期分化成子叶,此时杜鹃兰种子由异养转为自养(图3 F)。原球茎分化出芽,呈匍匐生长(图3 G)。用扫描电镜观察切面,可以看到大型类圆形薄壁细胞,内含大量草酸钙针晶束,未糊化淀粉粒呈圆形,充满整个薄壁细胞(图2 I)。但原球茎基部未发育成根,而是产生许多由表皮细胞发育而来的白色毛状物(图2 H),这些突起的“假根”呈不规则的束状分布(图3 E)。发育较快的原球茎继续培养,大量吸收养分并快速伸长形成根状茎,茎端分生组织陆续分化出第一片叶和第二片叶,叶片逐渐舒展(图3 G、图3 H)。随着杜鹃兰叶片的生长伸长,与根状茎之间形成一定的夹角,并在拐角处逐渐膨大形成假鳞茎,假鳞茎基部分化出不定根,更有利于吸收营养(图3 I)。将带有假鳞茎和生根的幼苗(图3 J、图3 K)经驯化移栽到混有大量腐殖质且排水良好的蛭石基质中(图3 L),移栽后30 d生长旺盛,叶片伸长3 cm左右,有的还能长出1片新叶。经过90 d的移植,幼苗成活率最高(80%)。
在非共生萌发过程中发现有少量双胚种子,2个胚在种子中的位置多数呈上下排列,大小相差不大。这种双胚现象,是合子胚在发育过程中分裂成两部分,每一部分又独立发育成胚,所以种子萌发过程中有部分形成2个原球茎。有些原球茎有2个以上生长点,其中有一部分后期能发育成完整植株。有部分原球茎未产生叶绿体,停止发育后褐化。杜鹃兰原球茎不仅可以直接形成幼苗,还可以通过形成丛生芽再分化出苗。杜鹃兰种子发育途径也不完全一致,一种是在胚未转绿时就突破种皮,另一种是胚转绿后再突破种皮,形成原球茎,而且同一瓶中生长状态并不统一。
2.3 杜鹃兰种胚发育过程的结构变化与原球茎形成
种子发育120 d时具内外种皮的球形胚,无胚乳,单细胞胚柄退化,外种皮由一层细胞组成,无内含物,内种皮致密薄膜状。切片观察种皮细胞木质化加厚,细胞表层具纹理,采用TBO染色法,种皮内外壁呈蓝绿色,表明种皮壁中存在酚类化合物(图4 A)。135 d时,种皮的细胞脱水变成薄薄的一层,紧贴种胚。成熟种胚具有极性,远离胚柄端表面一层细胞体积较小,呈不规则四边形,胚柄端细胞数目较少,细胞体积大,胚体两侧细胞呈不规则的长方形,这一时期染色深,细胞质浓厚,充满大量的贮藏物质(图4 B)。培养30 d后,种胚吸水膨胀,胚胎迅速增大,细胞数量增加,导致种皮严重破裂,胚体前端出现极性(图4 C)。此时细胞分裂快,细胞小而多,核大质浓,逐渐成为具有分生组织特点的细胞群。然后种胚继续生长,胚柄端细胞体积增大,但分裂较慢。当胚柄细胞退化消失、胚体完全脱离种皮时形成原球茎(图4 D)。胚体向一侧慢慢倾斜,倾斜的胚体上方出现背嵴,从这个分生组织区继续伸长,导致种胚具有明显的背腹对称。当原球茎由白色转成绿色时,切片可观察到少量草酸钙晶体,多位于茎端分生组织。顶端圆锥状凸起遵循原套-原体学说,为具典型原套原体结构的生长锥。原套为表面一层排列整齐、等径的小细胞构成,可以使茎尖表面积增大;原体位于被原套覆盖的顶尖分生组织内部,细胞较大,向各个方向分裂(图4 E)。后期顶端细胞不断分化向外隆起形成叶原基,其包裹的顶端分生组织缺乏贮藏物质,基部薄壁细胞中贮藏有糊粉粒及少量淀粉(图4 F)。随着原球茎发育,茎端分生组织向内逐渐分化出一束维管束,维管束周围的原形成层为一团排列紧密、核大体积小的分生组织细胞,其代谢活动旺盛,分裂能力强,会不断分化出维管束细胞和薄壁细胞,向基部延伸连接胚根和子叶,周围细胞形成的白色毛状“假根”,无内含物,是吸收营养的结构(图4 G)。基本分生组织内细胞排列具有极性,越靠近茎端分生区细胞体积越小,排列越紧密,大多数细胞核大、液泡小,随着分生组织细胞分裂可促进原球茎生长伸长。叶原基逐渐形成幼叶,随着居间分生组织的细胞分裂、增大后,叶片不断伸长变宽(图4 H)。维管束细胞分裂增多并在基部开始横向延伸,形成胚根,属于内起源(图4 I)。最后基本分生组织分化为液泡较大的薄壁组织,开始积累营养物质,带有假鳞茎和根的幼苗初始形成。
2.4 NaClO预处理对种皮透水透气性的影响
对种子非共生萌发中形态结构观察发现,种皮木质化是导致其透水透气性差的原因之一,故必须解除这一影响才能促进种子萌发。用NaClO溶液预处理显著提高了萌发率(p<0.05),2.5%的NaClO溶液处理10 min达到最佳萌发率,随时间延长萌发率显著下降(表2)。TTC种胚染色率与种子萌发率不存在相关性,说明种子经NaClO溶液处理后TTC溶液更易渗进种胚,间接证明NaClO预处理可能会破坏种皮,增加种子对氧气和营养物质的渗透性。但NaClO质量分数过高或处理时间过长时,对种胚伤害较大,使部分种子失活。
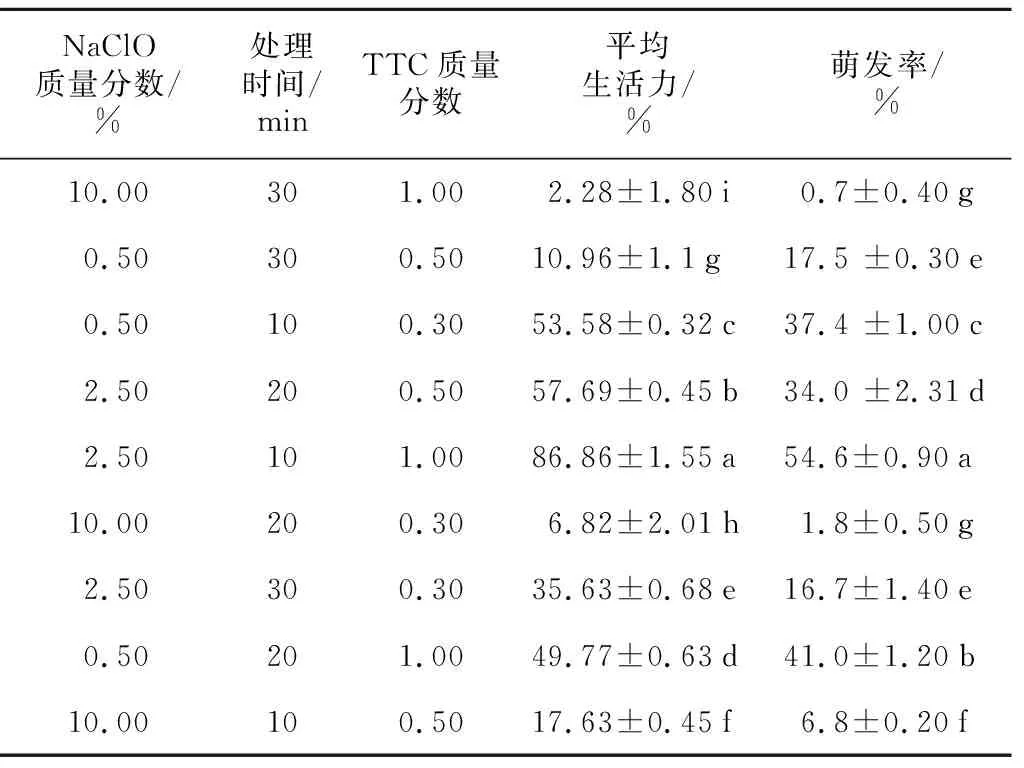
表2 NaClO预处理对杜鹃兰种子萌发的影响
3 讨 论
兰科植物种子的胚龄直接影响其萌发率,在采收的杜鹃兰种子中,120 d未成熟种子是体外培养的最佳时期,证实未成熟的杜鹃兰种子存在一个最佳的采收时期。因为种皮尚未发育完全,此时采收可以提高种子的发芽率,过早采收种子,培养条件更复杂且培养过程中容易死亡,晚于最佳时期采收的未成熟种子中存在抑制因素,胚胎被内种皮包裹得更紧密,导致种皮产生休眠,影响种子萌发。在其他陆生兰中,授粉后100 d左右的春兰种子萌发时间最短,且有较高萌发率[20];带叶兜兰的最佳采收时间为授粉后180 d,采收时间过早或过晚其萌发效果均不理想[21]。本研究初步探索了杜鹃兰种子非共生萌发的最佳采收时期,为更好地完善杜鹃兰非共生萌发和离体繁殖体系,还需对离体条件进行更深入的研究。
根据外部形态和内部结构观察,确定了6个幼苗发育阶段:1)无萌发,种皮完整;2)种皮破裂,露出球形胚;3)原球茎的形成;4)可见顶端分生组织和假根;5)分化出第一片叶;6)叶伸长及分化出不定根,初步形成幼苗。发育过程大致遵循兰科植物种子发育的基本规律。杜鹃兰胚胎被包裹在具木质化加厚的单层细胞种皮内时,组织分化非常有限,由顶端的小细胞和底端的大细胞组成,显示出结构极性,并表现出一种特殊的形态休眠[22]。胚吸胀至种皮破裂后,萌发后的胚成熟和幼苗发育发生在种皮之外[23],其游离的胚胎被称为“原球茎”。原球茎是分化发芽的胚胎还是发育不良的发芽幼苗是争论的来源。因原球茎的两极性,一些兰科植物学家认为它是发育不完全的幼苗,用于产生芽和根源分生组织[24]。Nishimura[25]认为,原球茎为幼苗是因观察到部分原球茎具有光合作用,作用类似于第一片叶子。虽然目前文献中兰科中“胚”“原球茎”和“幼苗”之间的区别还有待研究,但经过切片观察发现,杜鹃兰原球茎仍在胚发育阶段。有研究认为,顶端分生组织在原球茎发育中起重要作用,遵循原套-原体学说,分生组织细胞强烈分裂,形成叶原基,向内发育形成维管束,并向基部延伸然后发育成叶;Nguyen H等[26]研究表明,由具真叶的茎分生组织和根分生组织组成幼苗。因此,本研究以第一根的出现判定杜鹃兰进入幼苗期。在原球茎的基部,观察到单细胞假根,它们吸收营养,或者在自然萌发的情况下可能与菌根真菌的渗透有关。兰科植物种子从异养转变为自养取决于叶绿素的合成,杜鹃兰原球茎在发育期给予适当光照,原球茎短时间转绿。长期的黑暗容易导致其白化或停止发育。转绿的原球茎通过光合作用将无机物转变为有机物,有利于光合产物的运输与分配,有利于干物质积累,通常叶绿素含量越高,干物质积累得越多。细胞组织学观察发现,根状茎的形成建立于内部维管束组织的分化。本研究在培养基营养充足及相关激素诱导下,种子萌发成原球茎后可直接分化出苗。在原球茎形成及发育阶段,在薄壁细胞中都观察到淀粉颗粒,胚胎细胞中的淀粉积累可能与培养基中糖的存在有关[27]。存在于薄壁细胞内的草酸钙晶体能够有效地对钙进行调节,在植物组织支持、保护及促进植物运输管道的生长方面具有重要作用。本研究对杜鹃兰幼苗早期发育阶段从外部形态到内部结构的观察,可以为杜鹃兰种子非共生萌发提供重要信息。
在自然环境中,种皮可以延长杜鹃兰种子的存活时间,增加其与适当共生体建立菌根联合体的机会。然而,通过TBO预染色,种皮被染成蓝绿色,表明种皮细胞壁中含有大量酚类物质。金兰成熟种子内表皮中木质素等物质的积累,可能是抑制萌发的原因之一[28]。为了使种皮更具渗透性,使用超声波或消毒剂进行种子预处理对提高成熟种子的萌发率至关重要。在本研究中,杜鹃兰的种子萌发率受NaClO处理的显著影响,但TTC染色与种子萌发率之间不存在相关性。不同的次氯酸盐溶液,如Ca(ClO)2和NaClO已被用于兰科种子的表面杀菌,并有促进种子萌发的效果[29]。而NaClO还是一种强氧化剂,常用于木质素的降解[30],可破坏种皮细胞壁增加亲水性。此外,次氯酸盐溶液还可能加速抑制物质的浸出,例如内源性ABA[31]。TTC染色进行生活力测定已成功应用于兰科种子质量评估,是一种可以判断贮藏后种子活力的实用方法,但部分TTC染色法判定的种子活力与实际萌发率不符,可能是因为种皮限制。在C.acaule中,通过NaClO处理后,从受伤胚胎释放脱氢酶可导致胚胎的生活力提高[32]。说明具有木质化种皮的种子在其传播过程中既可以提供保护,也能引起种子休眠。通过NaClO预处理会侵蚀种皮,破坏细胞壁的完整性,从而增加种子对氧气和营养物质的渗透性,而脱落酸等抑制剂可能会在种子中减少。
