川楝素对胃癌细胞糖酵解效应的影响及相关机制
2021-02-15李锡丁周永平李旻昊范新奇
李锡丁,周永平,李旻昊,范新奇
(南京医科大学附属无锡第二医院 1.普外科; 2. 肝胆外科,江苏 无锡 214002)
川楝素是从传统中药楝属植物川楝子和苦楝皮中提取出的一种四环三萜类化合物,具有良好的抗肿瘤作用,是一种极具潜力的抗癌药物[1]。既往文献表明川楝素可抑制胃癌细胞的恶性表型,并促进胃癌细胞凋亡[2-3]。恶性肿瘤是一种以逃避细胞增殖检查点为特征的疾病。即使在氧气存在的情况下,癌细胞也可将葡萄糖代谢重新编程为有氧糖酵解方式,以替代常规的氧化磷酸化途径来供给能量[4]。肿瘤细胞常通过调控葡萄糖摄取、乳酸生成和ATP合成等代谢方式,发挥其增殖、侵袭、转移和逃逸等恶性潜能,有助于其在肿瘤进展期间无限地增殖和存活[5-6]。研究提示,胃癌细胞在恶性转化的过程中,细胞的代谢模式会从氧化磷酸化转化为有氧糖酵解以满足更多的能量需求[7]。
线粒体NAD依赖性脱乙酰酶Sirtuin-3(SIRT3)是一种肿瘤抑制因子,是有氧糖酵解的关键调节剂,可通过缺氧诱导因子-1α(hypoxia inducible factor-1α, HIF-1α)抑制糖酵解效应,进而抑制葡萄糖转运蛋白1 (glucose transporter 1,GLUT1)和乳酸脱氢酶(lactate dehydrogenase A,LDHA)等糖酵解关键调控因子的表达,抑制肿瘤的恶性生物学行为[8]。信号传导与转录激活因子3 (signal transducer and activator of transcription 3, STAT3)是一种具有促癌功能的转录因子。研究表明,STAT3/SIRT3/HIF-1α信号轴在卵巢癌细胞的增殖和糖代谢重塑等恶性表型中可发挥重要调控作用[9]。既往有研究报道,STAT3是川楝素的潜在作用靶点[10]。为探究川楝素是否通过STAT3/SIRT3/HIF-1α信号轴抑制肿瘤细胞糖酵解效应,本研究拟从糖代谢角度探讨川楝素对胃癌细胞中糖酵解效应的影响,及其对STAT3/SIRT3/HIF-1α信号通路的调节作用。
1 材料和方法
1.1 组织标本、细胞及主要试剂
收集2020年4月至10月在南京医科大学附属无锡第二医院通过手术切除的31例胃癌患者的石蜡包埋胃癌组织切取片。所有患者术前均未曾接受任何治疗,术后通过病理诊断证实为胃腺癌。
胃癌AGS和HGC-27细胞购自中国科学院细胞库(北京)。根据既往文献报道[11]购买同一批次川楝素,购自武汉ChemFaces公司。将川楝素溶于二甲基亚砜中,制成10 mol/L溶液,于-20 ℃储存备用。葡萄糖吸收和乳酸生成分析试剂盒均为美国Biovision公司产品;pRL-TK、pGL3-control 载体、双荧光素酶检测试剂盒为美国Promega公司产品;LipofectamineTM转染试剂购自美国Invitrogen公司;pcDNA3.1(+)质粒和pcDNA3.1(+)-STAT3质粒购自苏州泓迅生物科技有限公司,并经测序证实;大肠埃希菌DH5α感受态细胞购自天根生化科技有限公司;STAT3(人抗兔单抗)、SIRT3 (人抗兔多抗)和HIF-1α (人抗兔单抗)一抗均为英国Abcam公司产品;DAB染色液、二抗试剂盒和抗原修复液购自福州迈新生物开发有限公司;总RNA抽提、逆转录试剂盒和荧光实时定量PCR(qRT-PCR)试剂盒购自北京天根生化科技公司。
1.2 免疫组织化学法检测SIRT3、STAT3和HIF-1α表达
将甲醛固定和石蜡包埋的标本行5 μm切片。经二甲苯浸泡10 min脱蜡、无水乙醇浸泡5 min、95%乙醇浸泡5 min和70%乙醇浸泡5 min水化。随后分别用0.3%过氧化氢和10 %正常山羊血清封闭15 min,蒸馏水摇洗3遍(3 min/次)。在沸水中加入EDTA(pH 8.0)枸橼酸钠缓冲溶液(pH 6.0)浸泡5 min后使用高压热修复10 min。切片与抗体(STAT3 1 ∶1 000,SIRT3 1 ∶500,HIF-1α 1 ∶100)孵育过夜;用0.01 mol/L PBS彻底洗涤。加入相应的鼠抗兔二抗工作液,室温孵育30 min。以不加一抗、不加二抗以及一抗和二抗均不加作为阴性对照。最后用DAB染色,镜下控制显色,保证显色时间基本一致。切片浸入自来水中终止显色反应,苏木精复染15 s,自来水冲洗返蓝30 min,脱水封片。免疫组化切片经3D HISTECH数字切片扫描系统(匈牙利3D HISTECH公司)扫描后,采用3D HISTECH定量Center2.1分析软件计算棕色区域(阳性区域)和蓝色区域(阴性区域)的面积和灰度值,通过总灰度值计算积分光密度值(integral optical density,IOD),最后将IOD除以图片阳性面积得到最终指标平均光密度值(mean optical density, MOD)[11]。
1.3 细胞实验
1.3.1 细胞培养及分组 胃癌AGS和HGC-27细胞复苏后以2×106/mL密度接种在25 cm2细胞培养瓶中,加入含10%胎牛血清的RPMI-1640培养基,置于37 ℃和5 % CO2培养箱中培养;细胞隔天换液至生长达80%~90%时,用0.1%胰酶消化并传代,选取对数生长期的细胞用于实验。细胞设立溶剂对照组和2个不同浓度的川楝素处理组。分别给予DMSO、100 nmol/L川楝素和250 nmol/L川楝素处理24 h[12],药物浓度经预实验确定有效。
1.3.2 葡萄糖和乳酸水平检测 用BioProfile FLEX分析仪(美国诺华生物医学)和乳酸试剂盒测量培养基中的葡萄糖和乳酸水平,并将其标准化为细胞数。在新鲜培养基中加入细胞孵育30~60 min,测量培养基中乳酸盐水平(乳酸盐试剂盒),并将其标准化为每个细胞的数量。
1.3.3 qRT-PCR检测GLUT1mRNA和LDHAmRNA表达 抽提胃癌细胞内总RNA,逆转录后进行qRT-PCR。STAT3上游引物:5′-GGAGGAGGCATTCGGAAAG-3′,下游引物:5′-TCGTTGGTGTCACACAGAT-3;SIRT3上游引物:5′-CCATCGGAAGGACTAGGTGTCT-3′,下游引物:5′-GGCTTGGGGTTGTGAAAGAAG-3′;HIF-1α上游引物:5′-TCGTTGGTGTCACACAGAT-3′,下游引物:5′-CCATCGGAAGGACTAGGTGTCT-3′。GLUT1上游引物:5′-AACTC TTCAGCCAGGGTCCA-3′,下游引物:5′-CACAGTGAAGATGATGAAGAC-3′;LDHA上游引物:5′-GGAGATTCCAGTGTGCCTGT-3′,下游引物:5′-GTCCAATAGCCCAGGATGTG-3′;β-肌动蛋白上游引物:5′-AGAGCTACGAGCTGCCTGAC-3′,下游引物:5′-AGCACTGTGTTGGCGTACAG-3′,引物均由上海生工生物工程技术服务有限公司合成。20 μL反应体系包含:Master混合物10 μL,酶混合物1 μL,上游引物 1 μL,下游引物 1 μL,探针1 μL,RNA模板6 μL。扩增条件:50 ℃逆转录30 min,95 ℃初始化15 min,94 ℃变性1 min,55 ℃ 1 min,72 ℃ 1 min,30~35个循环,72 ℃ 10 min。反应完成后首先查看每个基因的熔解曲线是否为单峰和扩增情况,导出相应的阈值循环数(Ct值),采用2-△△Ct法计算实验组(川楝素处理)与对照组(DMSO处理)之间基因表达量的差异。
1.3.4 荧光素酶报告基因实验测定SIRT3启动子转录活性 从http://dbtss.hgc.jp网站数据库检索获得SIRT3启动子序列的-2000~+100部分序列,设计启动子引物序列,并在上游引物5′端加入KpnⅠ酶切位点GGTACC,在下游引物5′端加入HindⅢ酶切位点AAGCTT。
收集对数生长期HGC-27细胞约1×107个,DNA提取试剂盒提取基因组DNA。以HGC-27细胞基因组DNA为模板,PCR扩增获得SIRT3启动子条带,参照试剂盒的操作说明回收并纯化。将SIRT3的人启动子序列作为pGL3-SIRT3-promoter插入pGL3-基本载体中。在铺有AGS和HGC-27细胞的6孔板中转染pGL3-SIRT3质粒(100 ng)和Renilla对照质粒(5 ng)。将细胞分为3组,2个川楝素处理组和对照组,分别加入250 nmol/L川楝素、250 nmol/L川楝素和等体积DMSO溶剂。其中一组川楝素处理细胞转染STAT3过表达质粒(5 ng)。在转染后48 h采用双荧光素酶测定试剂盒检测荧光素酶活性。报告荧光素酶活性基于海肾荧光素酶标准化,然后重新调整为单位等于1的载体对照信号。
1.4 统计学处理

2 结果
2.1 STAT3/SIRT3/HIF-1α信号轴蛋白在胃癌组织中的表达
免疫组织化学结果显示,在胃癌组织中,可观察到STAT3和HIF-1α蛋白在肿瘤细胞核中整体表现为阳性或强阳性,而SIRT3在肿瘤细胞核中整体表现为阳性或弱阳性(图1)。
分析三者表达的MOD值,结果显示,SIRT3免疫染色表达与STAT3 (r=-0.425,P=0.017)和HIF-1α (r=-0.513,P=0.003)呈负相关,而STAT3和HIF-1α (r=0.598,P=0.001)的免疫染色表达呈正相关。见图2。

图1 免疫组织化学法检测胃癌组织中SIRT3、STAT3和HIF-1α蛋白表达(×100)
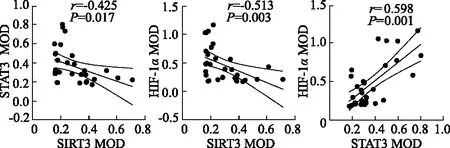
图2 胃癌组织中SIRT3、STAT3和HIF-1α蛋白表达的相关性分析
2.2 川楝素对胃癌细胞糖酵解效应的影响
与对照组比较,100 nmol/L、250 nmol/L川楝素作用于AGS和HGC-27 细胞后,胃癌细胞葡萄糖相对吸收值和相对乳酸生成量明显降低(P均<0.01)。与100 nmol/L川楝素处理组比较,250 nmol/L川楝素处理组胃癌AGS和HGC-27 细胞葡萄糖相对吸收值和相对乳酸生成量明显降低(P均<0.01)。见图3。

a:P<0.01,与对照组比较;b:P<0.01,与100 nmol/L川楝素比较
2.3 川楝素对胃癌细胞GLUT1和LDHA mRNA表达的影响
结果显示,与对照组比较,100 nmol/L、250 nmol/L川楝素组AGS、HGC-27胃癌细胞GLUT1mRNA和LDHAmRNA表达明显降低(P<0.05或<0.01)。与100 nmol/L川楝素组比较,250 nmol/L川楝素组AGS、HGC-27胃癌细胞GLUT1、LDHAmRNA表达明显降低(P均<0.01)。见图4。

a:P<0.05,与对照组比较;b:P<0.01,与100 nmol/L川楝素比较
2.4 川楝素对胃癌细胞STAT3、SIRT3和HIF-1α mRNA表达的影响
与对照组相比,100 nmol/L、250 nmol/L川楝素组AGS和HGC-27胃癌细胞STAT3、HIF-1αmRNA表达明显降低(P均<0.01),SIRT3mRNA表达明显增强(P均<0.01)。与100 nmol/L川楝素处理组比较,250 nmol/L川楝素处理组胃癌细胞STAT3和HIF-1αmRNA表达明显降低(P均<0.01),SIRT3mRNA表达明显增强(P均<0.01)。见图5。
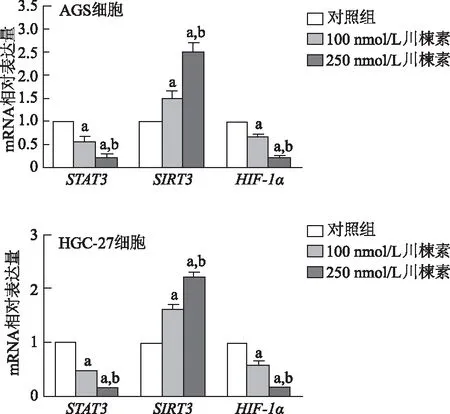
a:P<0.01,与对照组比较;b: P<0.01,与100 nmol/L川楝素比较
2.5 川楝素通过抑制STAT3来上调SIRT3启动子活性
上述实验结果显示,高浓度川楝素(250 nmol/L)在胃癌细胞中的调控作用更显著,所以本实验选用高浓度川楝素处理细胞。结果显示,川楝素处理明显升高AGS和HGC-27细胞中SIRT3启动子诱导的荧光素酶活性(P<均0.01);而在川楝素处理的AGS和HGC-27细胞中导入STAT3质粒,与川楝素处理组比较,过表达STAT3则可从一定程度降低川楝素对SIRT3启动子诱导的荧光素酶活性的促进作用(P均<0.01)。见图6。

a:P<0.01,与对照组比较;b:P<0.01,与250 nmol/L川楝素比较
3 讨论
HIF-1α是控制糖酵解基因表达的转录因子,而线粒体NAD依赖性脱乙酰酶SIRT3是一种肿瘤抑制因子,SIRT3作为Warburg效应的关键调节剂,通过使HIF-1α不稳定来介导代谢重编程,进而调控GLUT1和LDHA等糖酵解关键调控因子表达,抑制肿瘤的恶性生物学行为[8]。本研究检测发现STAT3、SIRT3和HIF-1α蛋白均在胃癌组织中表达,而且SIRT3蛋白表达与STAT3和HIF-1α表达呈负相关,STAT3和HIF-1α蛋白表达呈中度相关,提示STAT3/SIRT3/HIF-1α信号通路可能参与胃癌细胞糖代谢的调控。
根据既往文献报道[12],本研究中分别选用低浓度100 nmol/L和高浓度250 nmol/L的川楝素处理胃癌细胞。选用两株胃癌细胞(AGS细胞和HGC-27细胞),以证实相关影响在胃癌细胞中的普遍性。结果显示,川楝素均可抑制葡萄糖摄取和乳酸生成,抑制糖酵解关键调控因子GLUT1mRNA和LDHAmRNA表达,高浓度川楝素可获得更强的抑制效果。由此提示,川楝素可呈一定浓度依赖性降低胃癌细胞中的糖酵解水平。
既往研究表明,川楝素可通过调节具有促癌功能的转录因子STAT3实现抗肿瘤抑制作用[10]。本研究发现,川楝素可以抑制STAT3和HIF-1αmRNA表达,促进SIRT3mRNA表达,且川楝素浓度越高调控效果越强。利用川楝素处理胃癌细胞,可促进SIRT3启动子的活化,但在川楝素处理的胃癌细胞中过表达STAT3则可以部分削弱川楝素的作用。由此表明,川楝素通过上调SIRT3启动子活性促进SIRT3转录表达;过表达STAT3可以抑制川楝素对SIRT3启动子的活化作用。
综上所述,川楝素可通过介导STAT3表达影响SIRT3/HIF-1α调控轴,继而抑制胃癌细胞糖代谢水平。但是,川楝素是否通过糖代谢相关分子途径影响胃癌细胞侵袭、转移和凋亡等恶性表型,需要进一步探讨。
