厚藤提取物对胶原诱导关节炎模型大鼠的治疗作用研究*
2021-02-12韦棪婷郝二伟夏中尚蒋秋燕杜正彩邓家刚侯小涛
韦棪婷,郝二伟,夏中尚,3,蒋秋燕,杜正彩,邓家刚,侯小涛**
(1.广西中医药大学药学院,广西南宁 530200;2.广西中医药大学,广西中药药效研究重点实验室,广西南宁 530200;3.成都中医药大学药学院,四川成都 611137)
0 引言
类风湿性关节炎(Rheumatoid Arthritis,RA)是一种慢性、系统性、自身免疫性炎症疾病,主要攻击滑膜关节,进而导致关节破坏、关节畸形和功能丧失等障碍疾病,这是造成劳动力丧失和残疾的主要原因,严重危害人类健康[1,2]。在我国,RA总患病率为0.32%-0.36%[3]。目前临床上常用于类风湿性关节炎的药物为非甾体抗炎、甾体激素等[4],均存在诸多不良反应。RA在中医属“痹证”范畴,其病由人体正气不足、脏腑功能失调、风湿寒热燥等外邪入侵,痰瘀气滞,气血运行不畅所引起[5]。中医药具有疗效好、依赖性低、副作用少等优点,利用其治疗RA疾病已成为研究热点[6]。
厚藤(Ipomoeapes-caprae)为旋花科(Convolvulaceae)番薯属(Ipomoea)植物,是我国常用海洋中药材,具有祛风除湿、消痈散结、拔毒消肿的功效,在民间应用广泛。现代药理研究报道,厚藤具有抗炎、免疫调节、抗氧化等功效[7]。目前,厚藤抗RA作用的研究报道较少,本文探讨厚藤提取物(Ipomoeapes-capraeExtract,IPE)对Ⅱ型胶原诱导关节炎(Collagen-induced Arthritis,CIA)模型大鼠的治疗作用,为临床应用及产品开发提供研究基础。
1 材料与方法
1.1 材料
1.1.1 实验动物
SPF级雄性SD大鼠,6周龄,体质量160-200 g,由湖南斯莱克景达实验动物有限公司提供,动物许可证号SCXK (湘) 2019-0004。动物饲养于温度(23±2)℃、湿度50%-60%、12 h/12 h昼夜交替光照的环境中,自由进食饮水。动物实验经广西中医药大学动物伦理委员会批准(批准号DW20190418-015)。
1.1.2 药材
厚藤采自广西防城港市北仑河口国家级自然保护区,经广西中医药大学韦松基教授鉴定为旋花科植物厚藤(Ipomoeapes-caprae(L.)Sweet)的全草。
1.1.3 药品及试剂
牛Ⅱ型胶原(CⅡ,美国Chondrex,批号:190578),弗氏不完全佐剂(IFA,美国Chondrex,批号:190572),弗氏完全佐剂(CFA,美国Chondrex,批号:190447),雷公藤多苷(江苏美通制药公司,批号:200401),PGE2 ELISA Kit (Bioswamp生物科技有限公司,批号:RA20013),RF ELISA Kit (上海酶联生物科技有限公司,批号:ml525301),CRP ELISA Kit (上海酶联生物科技有限公司,批号:ml038253)。
1.1.4 仪器
CPA225D万分之一天平(德国赛多利斯科学仪器北京公司),HDM-500型恒温电热套(江苏天由发展有限公司),Hei-VAP型旋转蒸发仪(德国Heidolph公司),TGL-16M型台式高速冷冻离心机(湖南湘仪实验室仪器开发有限公司),M200PRO型酶标仪[帝肯(上海)贸易有限公司]。
1.2 方法
1.2.1 厚藤提取物的制备
称取厚藤全草2.5 kg,切成约10 cm粗段,加水提取2次,第1次加12倍量水,第2次加10倍量水,煮沸后再煎30 min,用200目纱布过滤,合并药液,55℃减压浓缩至稠膏,取提取物稠膏,稀释至相应灌胃浓度进行实验。
1.2.2 动物分组、模型复制及给药
60只大鼠经适应性喂养5 d后,按体质量随机选取8只作为空白组,其余52只大鼠用于复制模型。造模时,将牛Ⅱ型胶原(CⅡ)溶液与等体积弗氏完全佐剂(CFA)混合乳化后,除空白组外,其余组大鼠取背部脊柱两侧和尾根部皮内注射配置好的胶原乳剂0.1 mL,共0.3 mL。初次免疫第7 d,将CⅡ溶液与等体积弗氏不完全佐剂(IFA)混合乳化后,在大鼠右侧踝关节皮下注射0.1 mL进行第2次免疫。空白对照组于相同部位注射等量生理盐水。造模24 d后,挑选造模成功(关节炎指数AI≥3)的大鼠,根据炎症指数随机分为5组,即模型组,阳性组,厚藤提取物高、中、低剂量组,每组8只。
厚藤提取物高、中、低剂量组分别按2.271 2,1.135 6,0.567 8 g/kg鼠重(分别相当于人每日服生药材120,60,30 g)灌胃,阳性对照组按9 mg/kg鼠重给予雷公藤多苷混悬液(加蒸馏水配制成0.6 mg/mL雷公藤多苷混悬液)灌胃,空白组和模型对照组给予等体积的纯化水,每次灌胃容量按1.5 mL/100 g鼠重给予。每日1次,连续21 d。
1.2.3 大鼠情况观察
自给药起,每日观察并记录大鼠活动情况、精神状况、皮毛光泽度、大小便等变化。
1.2.4 踝关节肿胀度测定
造模前,在每只大鼠踝关节测量处用马克笔进行画线标记,确保每次测量位置一致。经2次免疫后,每3 d采用2-3 mm宽纸条和透明软尺,固定测量大鼠右后足踝关节0.5 mm处的关节周径。踝关节肿胀度=(致炎后关节周径-致炎前初始周径)/致炎前初始周径。
1.2.5 足跖肿胀度测定
大鼠经2次免疫后,每3 d用数显游标卡尺测量大鼠右后足跖厚度,足趾肿胀度=(致炎后足跖厚度-致炎前足跖厚度)/致炎前足跖厚度。
1.2.6 关节炎症指数评价
根据关节炎症评分与计数的标准[8](表1),对大鼠进行关节炎指数评分(总分为四足评分之和)。

表1 关节炎指数评分标准
1.2.7 血清中PGE2、RF、CRP含量测定
末次给药后,大鼠禁食不禁水12 h。采集血液标本前,用10%水合氯醛按0.3 mL/100 g鼠重腹腔注射使各组大鼠麻醉,腹主动脉取血,室温放置2 h,3 000 r/min离心10 min,吸出血清,于-80℃低温冰箱保存待测。采用ELISA试剂盒按照说明书检测各组大鼠血清中前列腺素E2(Prostaglandin E2,PGE2)、类风湿因子(Rheumatoid Factor,RF)、C-反应蛋白(C-reaction Protein,CRP)表达情况。
1.2.8 滑膜组织病理分析
腹主动脉取血后,截取大鼠的踝关节,剔除表面皮肤和肌肉,置于4%多聚甲醛溶液中固定3 d后,换入新的固定液继续固定4 d,将踝关节用PBS清洗3次,继而用纯化水清洗3次,将踝关节转移至20倍体积的脱钙液中脱钙,脱钙液每周更换1次,4-6周时用针刺、钳夹的方法检查脱钙情况,待针刺无阻力感时终止脱钙,将组织脱水、石蜡包埋、切片,经切片脱蜡后进行HE染色。
1.2.9 数据处理
2 结果与分析
2.1 大鼠后肢肿胀情况观察
大鼠后肢踝关节肿胀情况如图1所示。空白组(图1a)大鼠活动自如,无关节炎症现象,毛发顺滑光亮,饮食、大小便正常。模型组(图1b)大鼠踝关节肿胀严重,以右后足踝关节肿胀最为明显,行动迟缓,毛发枯萎且色泽暗淡,精神逐渐萎靡,进食减少。给予厚藤提取物干预后,大鼠踝关节肿胀程度得到减轻。

图1 各组大鼠后肢肿胀情况
2.2 厚藤提取物对CIA大鼠踝关节肿胀度的影响
由表2可知,各组造模大鼠踝关节肿胀度与空白组相比均显著提高(P<0.01)。各治疗组与模型组相比均无显著性差异(P>0.05),其中,厚藤提取物高剂量组有减轻踝关节肿胀度的趋势。厚藤提取物高、中、低剂量组与阳性组比较,无统计学意义(P>0.05)。
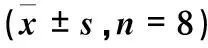
表2 厚藤提取物对CIA大鼠踝关节肿胀度的影响
2.3 厚藤提取物对CIA大鼠足跖肿胀度的影响
厚藤提取物对CIA大鼠足跖肿胀度的影响结果如表3所示。与空白组相比,各组造模大鼠足跖肿胀度均显著提高(P<0.01)。与模型组相比,厚藤提取物各治疗组在给药18 d后,随着给药浓度的升高,足跖肿胀度有逐渐下降的趋势,但各组间无显著性差异(P>0.05)。厚藤提取物各组与阳性组比较,均无显著性差异(P>0.05)。
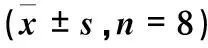
表3 厚藤提取物对CIA大鼠足跖肿胀度的影响
2.4 厚藤提取物对CIA大鼠关节炎症指数的影响
由图2可知,与空白组相比,各组造模大鼠关节炎指数显著升高(P<0.01)。与模型组相比,阳性组、厚藤提取物高剂量组在给药15 d后关节炎症指数降低(P<0.05),厚藤提取物中剂量组在给药18 d后关节炎症指数降低(P<0.05)。与阳性组相比,厚藤提取物各治疗组均无统计学意义(P>0.05)。
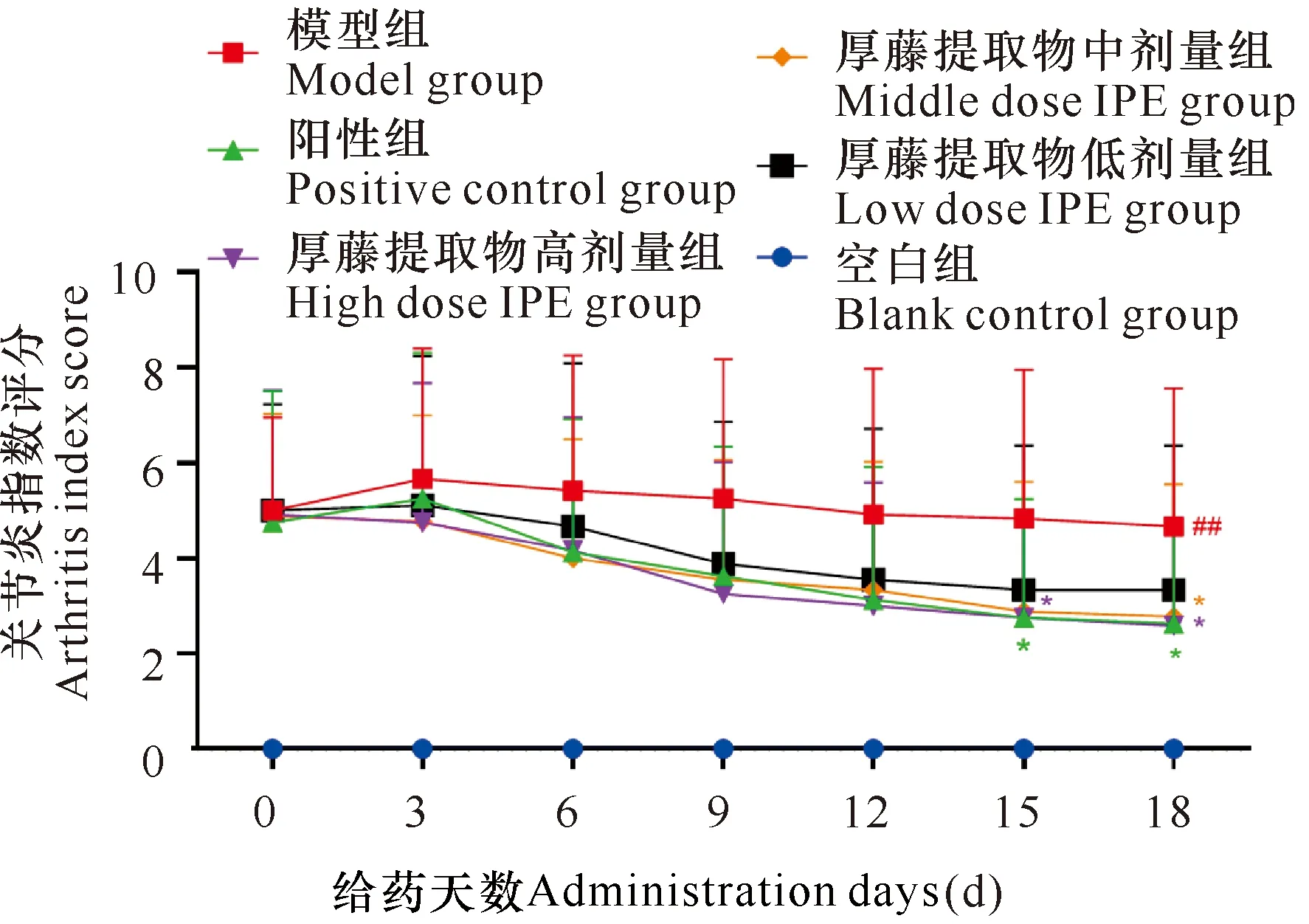
与空白组比较##P<0.01;与模型组比较*P<0.05
2.5 厚藤提取物对CIA大鼠血清中PGE2、RF、CRP表达的影响
由表4可知,模型组大鼠与空白组相比,血清中PGE2、RF、CRP水平均显著升高(P<0.01)。与模型组相比,各给药组能显著降低RF水平(P<0.01);除厚藤提取物低剂量组外,厚藤提取物高、中剂量组能显著降低PGE2、CRP水平(P<0.05,P<0.01)。与阳性组相比,厚藤提取物低剂量组血清中PGE2含量明显升高(P<0.05),厚藤提取物各组RF含量均显著升高(P<0.01),而CRP含量无显著性差异(P>0.05)。
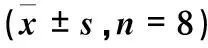
表4 厚藤提取物对CIA大鼠血清中PGE2、RF、CRP表达的影响
2.6 厚藤提取物对CIA大鼠滑膜组织病理变化的影响
大鼠踝关节病理切片结果如图3所示。光学显微镜下,空白组踝关节组织软骨结构完整,骨层清晰,关节面光滑,软骨细胞分布均匀,软骨内无血管和神经,骨小梁较宽,骨髓腔中细胞分布密集、无空旷区;滑膜结构清晰完整,衬里层由单层或双层滑膜细胞组成,排列疏松且部分不连续,滑膜组织无炎性细胞浸润及纤维组织增生。模型组软骨和软骨下层骨组织受侵蚀,见局部软骨细胞严重减少,部分软骨细胞坏死,见软骨细胞着色较深,胞质溶解,排列紊乱,软骨层及软骨下层骨组织形成纤维裂隙,裂隙间大量毛细血管增生形成血管翳,较多炎性细胞浸润,见核呈圆形深染的淋巴细胞和核呈杆状或分叶状的中性粒细胞,骨组织中见大量的纤维组织填充,可见核呈长椭圆形的成纤维细胞增生。与模型组相比,厚藤提取物低剂量组踝关节组织病变程度相差不大,厚藤提取物中剂量组踝关节组织病变程度相对有所减轻,阳性组和厚藤提取物高剂量组踝关节组织病变程度得到明显减轻。
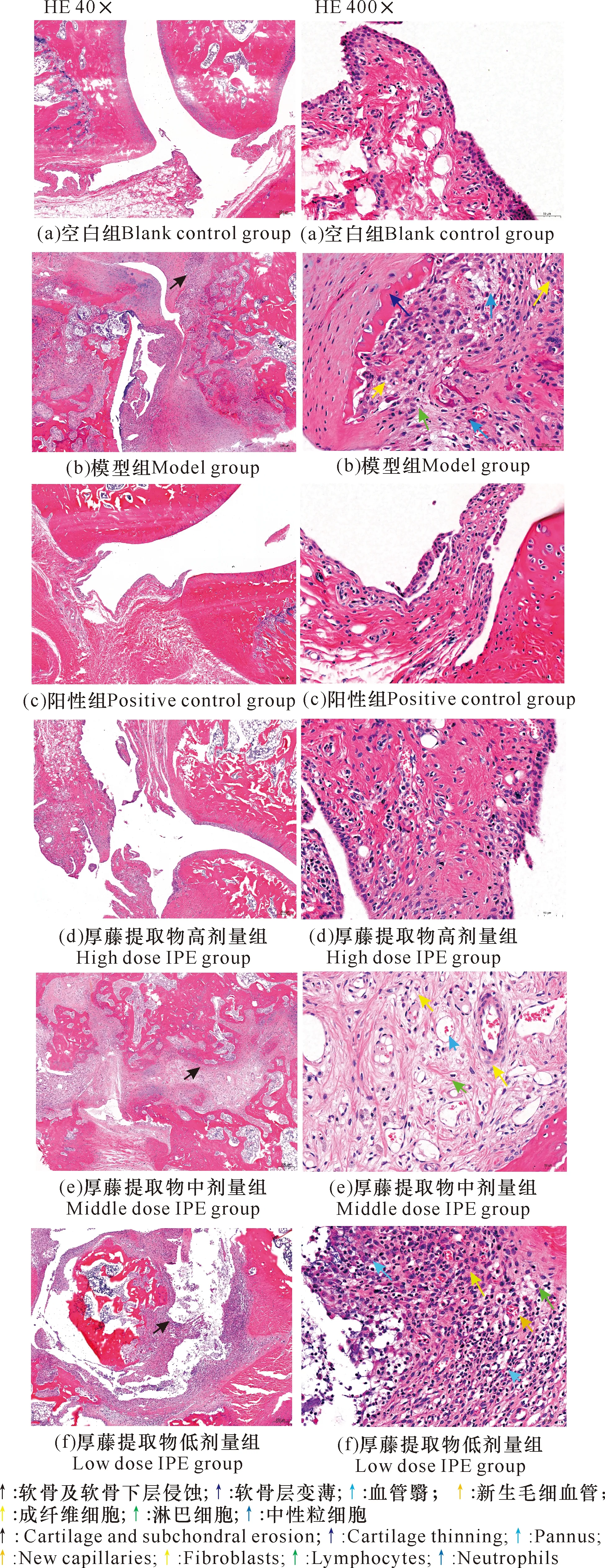
图3 厚藤提取物对CIA大鼠踝关节病理切片的影响
3 讨论
厚藤作为一种常用海洋中药,现代研究表明,厚藤中含有树脂糖苷类、黄酮类、酚酸类等成分,具有抗炎、镇痛、免疫调节、抗肿瘤等多种药理活性[7]。本课题组前期研究发现,厚藤水提物具有抗急性痛风性关节炎(Acute Gouty Arthris,AGA)作用[9],AGA与RA都属于风湿病,归属于中医“痹证、痹病”等范畴,本研究旨在探讨厚藤提取物对CIA大鼠的治疗作用。
CIA大鼠关节肿胀和炎症指数评价是反映病程的主要指标,进而评定药物的治疗效果。实验结果表明,与模型组相比,厚藤提取物各治疗组的踝关节肿胀度、足跖肿胀度有减轻的趋势但无显著性差异(P>0.05),厚藤提取物高、中剂量组可降低CIA大鼠关节炎症评分指数。在实验过程中,造模大鼠发病时间、病情程度不一。首次免疫时将CⅡ和CFA混合乳化后,在大鼠背部两侧及尾根部3点皮内注射,造成大鼠后期出现不同肿胀情况,部分大鼠两后足均出现肿胀现象,个别大鼠出现前肢肿胀;第2次免疫时,选择大鼠右后足进行注射免疫。因此,在实验期间造模大鼠普遍为右后足严重肿胀,其余足不同程度肿胀。在给药前,按炎症评分指数(大鼠四足评分之和)分层随机分组,踝关节肿胀度、足跖肿胀度测量部位为大鼠右后足;给药后,大鼠右后足肿胀消退缓慢,而继发性肿胀消退较快。与模型组比较,厚藤提取物各治疗组大鼠炎症指数评分明显降低,而踝关节肿胀度、足跖肿胀度降低但无显著性差异(P>0.05)。
RA病情发生与多种细胞因子密切相关。在RA模型中,PGE2发挥着关键作用,炎性因子PGE2可以增强单核细胞和中性粒细胞的趋化性,刺激淋巴细胞的增殖和细胞因子的释放[10],PGE2过度表达可使血管舒张,微循环通透性增加,加重渗出与水肿,诱导软骨破坏,从而加重RA炎症反应[11,12]。RF作为一种特异性抗体,由RA产生,RF表达升高,可加重患者器官功能的损伤[13]。CRP最早在肺炎球菌感染病人中发现,属于急性期蛋白,在发生炎症、组织损失时,表达水平迅速上升,在临床上常被用作诊断炎性反应、免疫防御功能的标志物[14,15]。RF和CRP与RA疾病发展密切相关,可作为诊断和判定RA严重程度的指标[16,17]。
4 结论
本研究评价了厚藤提取物对CIA模型大鼠的抗炎作用,结果显示,厚藤提取物对CIA大鼠有减轻肿胀、缓解滑膜炎症状的作用,其对CIA大鼠关节的保护作用可能是通过降低血清中PGE2、RF、CRP表达水平,从而抑制炎症反应,其具体分子作用机制还需深入探究。