‘正午’牡丹微繁殖技术体系的优化*
2021-02-12文书生成仿云
文书生 成仿云 钟 原
(1. 北京林业大学园林学院 牡丹国际研究院 北京 100083; 2.南京林业大学风景园林学院 南京 210037)
牡丹(PaeoniaSect.Moutan)为芍药科(Paeoniaceae)芍药属(Paeonia)落叶灌木,是中国的传统名花和重要的药用植物(Cheng, 2007),近年来,牡丹又被视为一种优质的木本油料资源(Lietal., 2015)。然而,牡丹繁殖主要采用分株和嫁接的方法,繁殖效率低、周期长,难以实现优良品种的规模化生产。微繁殖技术可在短期内大量繁殖苗木,克服了传统繁殖方法的缺陷,因此,建立牡丹微繁殖技术是其种苗规模化生产的必然趋势。
牡丹微繁殖技术研究始于1984年(李玉龙等, 1984),迄今已初步建立了20多个品种的微繁殖技术体系,但在一些关键环节仍存在问题: 1) 已研究报道了鳞芽(萌蘖芽、腋芽、花芽)和幼嫩茎段作为外植体的培养效果(孔祥生等, 1998; 李萍, 2007; 孟清秀等, 2011; 王蒙蒙等, 2018),综合比较发现鳞芽的污染率和诱导表现优于幼嫩茎段,但污染率(20%~60%)仍较高,无法满足高效生产需求; 2) 已通过植物生长调节剂的筛选、培养基调节以及环境条件控制等方面的探索,成功构建了‘正午’、‘乌龙捧盛’、‘锦袍红’牡丹等40多个品种的增殖培养体系,但增殖系数较低、试管苗质量较差(Wenetal., 2020),且目前广泛使用的植物组织培养传统光源——荧光灯,其光效低、能耗大、成本高; 3) 已通过生长素筛选、生根方式改良、培养环境调节等途径,构建了牡丹试管苗两步生根技术体系(Bouzaetal.,1994; Berutoetal., 2007; 文书生等, 2016; Wenetal., 2016a; 2016b; 王新等, 2016; Shangetal., 2017; 王蒙蒙等, 2018),组培苗生根率因品种而异(30%~100%),且生根培养过程需更换培养基、流程复杂、成本高; 4) 移栽成活率低是制约牡丹微繁殖技术应用的又一瓶颈问题,这主要是由于生根试管苗质量差(生长势弱、平均根数少),且基部易产生大量愈伤组织,致使其移栽适应力较低(张颖星, 2008; 邱金梅, 2010; 王新等, 2016)。总之,目前牡丹微繁殖仍存在启动培养污染严重,增殖效率低、能耗高,生根步骤复杂、生根苗质量差,移栽成活率低等突出问题(Wenetal., 2020),如何开展优化研究推进该技术的产业化应用是牡丹良种快繁的迫切需求。
‘正午’牡丹(P.×lemoinei‘High Noon’)是美国著名育种家Sunders于1952年育出的一个亚组间杂种(P.delavayi×P.suffruticosa)(Wister, 1995),花黄色呈荷花型,一年可多次开花,适应性强,生产与应用前景广阔(图1A)。本课题组前期已建立了该品种的微繁殖技术体系(文书生等, 2016; Wenetal., 2016a),但与其他牡丹优良品种的微繁殖一样,该技术产业化应用仍面临上述一系列问题。鉴于此,本研究在已有工作基础上(文书生等, 2016; Wenetal., 2016a),通过对不同外植体启动培养效果的比较、增殖培养阶段LED(light-emitting diodes,发光二极管)光源的应用以及生根方式的改进等,优化了‘正午’牡丹的微繁殖技术体系。研究结果不仅能够为该品种的种苗规模化生产提供技术支撑,还可为其他牡丹优良品种微繁殖技术体系的建立提供参考和借鉴。
1 材料与方法
1.1 初代培养
供试材料为牡丹品种‘正午’,早春取萌蘖芽、腋芽和黄化嫩茎为外植体,取材母株健壮、无病虫害。其中,萌蘖芽和腋芽取自鹫峰国家森林公园牡丹研究基地露地生长的母株,黄化嫩茎取自基地温室盆栽的‘正午’牡丹经暗处理[2012年2—4月,(24±1)℃暗处理]后萌发的嫩茎。按照李萍(2007)构建的方法对材料进行表面灭菌,然后将鳞芽用灭菌的刀和镊子剥除芽鳞、切除幼叶,并将黄化嫩茎切割成含1~2个叶腋的小茎段,再将处理后的外植体接种于初代培养基,培养基为WPM(CaCl2加倍)+BA 0.5 mg·L-1+GA30.2 mg·L-1+蔗糖30.0 g·L-1+琼脂6.0 g·L-1,pH5.8。
培养条件为温度(25±1)℃,光照强度32.4 μmol·m-2s-1(荧光灯),光照周期每天14 h(以下增殖和生根试验若无特殊说明,培养条件与此相同)。培养50天后,统计不同外植体启动培养的污染率、褐化率和存活率,并采用黄化嫩茎培养获得的丛生芽开展后续试验。每个处理接种30个外植体,3次重复。
1.2 增殖培养
继代培养末期切取芽丛上茎长≥1.0 cm的健壮单芽作为试验材料,切除其叶片后接种于增殖培养基,即WPM [3倍Ca(NO3)2·4H2O]+meta-topolin 5 μmol·L-1+GA31.5 μmol·L-1+柠檬酸 0.12 g·L-1+蔗糖30.0 g·L-1+琼脂6.0 g·L-1,pH5.8。其中meta-topolin是一种新型细胞分裂素,本课题组前期研究发现其对‘正午’牡丹试管苗增殖的促进作用与BA相当,且后期生根率和移栽成活率更高(Wenetal., 2016b)。试验分2步: 1)光照强度为30 μmol·m-2s-1,设不同LED红蓝光质配比5组,以荧光灯为对照(表1),筛选最佳LED红光(R)和蓝光(B)光质配比; 2)以试验1)结果为基础(70%R+30%B),设不同LED光照强度处理(30,50,70,90 μmol·m-2s-1),以筛选70%R+30%B LED光质配比条件下的最佳光照强度,从而建立增殖培养的最佳LED光照培养体系。增殖培养继代周期为35天,培养末期统计不同处理的增殖系数(茎长≥1.0 cm芽数)、茎长、叶片数和鲜质量。试验所用LED光源为飞利浦公司生产,红蓝灯珠交错分布,光质均匀,采用LI-1500辐射照度测量仪和LI-190R光合有效辐射传感器(美国LI-COR公司)测定组培架上方的光合有效辐射值,调至试验所需光质和光照强度。每个处理接种18个单芽,重复3次。

表1 LED光处理的光质和光照强度①Tab.1 Qualities and intensities of LED light in treatments
1.3 生根培养
继代培养末期切取芽丛上茎长≥1.0 cm的健壮单芽(保留全部叶片)进行复壮培养20天(图1E)(文书生等, 2016),再将单芽(保留1~2片叶)转接至生根培养(图1F): 1)一步生根: 生根培养基为1/2 MS(CaCl2加倍)+IBA 1.0 mg·L-1+腐胺1.0 mg·L-1+蔗糖30 g·L-1+琼脂6.0 g·L-1(Wenetal., 2016a),pH5.8,培养基中附加不同浓度VB2(0、1、5、10、15 mg·L-1),先置于黑暗条件下培养30天以诱导根原基,再转入光照条件下培养20天促进根的伸长生长。2)两步生根: 分为根诱导和根形成2个阶段,即试管苗先于不含VB2的培养基中暗培养30天(培养基同上述一步生根)以诱导根原基,然后转入根形成培养基1/2 MS(CaCl2加倍)+活性炭 4.0 g·L-1+蔗糖30 g·L-1+琼脂6.0 g·L-1(Wenetal., 2016a),pH6.2,光照培养20天。在上述一步、两步生根法的根诱导阶段(前30天),皆先将试管苗置于4 ℃条件下暗培养8天,然后转入(24±1)℃的条件下暗培养(Berutoetal., 2007)。每个处理接种30株无根试管苗,重复3次。生根培养50天后,统计各处理的生根率、根数和根长,并评价试管苗基部的愈伤组织等级。
1.4 驯化移栽
将生根试管苗置于4 ℃冰箱中低温暗处理30天解除休眠(Bouzaetal.,1992; 1994); 然后,转至室温下瓶内炼苗1周; 分别取80株一步生根(1.0 mg·L-1VB2)与两步生根的试管苗,根据生根质量、茎叶状况以及基部愈伤组织大小将其分为3个质量等级(一级苗: 根数≥2条,茎叶发育良好,无茎尖坏死,基部愈伤组织极少; 二级苗: 根数1~2条,茎发育良好,叶发黄,基部膨大,有轻微愈伤组织; 三级苗: 根数1条,茎上部无叶,基部严重愈伤化,根从愈伤组织发出),分别移栽到8 cm×8 cm×9 cm(长×宽×高)的塑料花盆,基质为经高压灭菌(121 ℃,40 min)的珍珠岩︰蛭石︰草炭土(体积比1∶1∶1)。移栽苗置于人工气候室管理: 温度(20±1)℃,湿度70%,光照强度32.4 μmol·m-2s-1,光照周期每天14 h,移栽60天后,统计移栽成活率。第2年,将组培苗转入温室生长,进行正常的水肥管理。
1.5 数据处理
采用SPSS 18.0软件对试验数据进行One-Way ANOVA 分析并利用LSD法检验差异显著性(P≤0.05),其中生根率和移栽成活率采用反正弦转换后再进行上述分析检验。
2 结果与分析
2.1 外植体类型对初代培养的影响
在启动培养条件下,不同类型外植体的表现存在显著差异(表2)。黄化嫩茎的污染率最低(19.59%),萌蘖芽次之(32.79%),腋芽最高(44.71%)。3种外植体褐化均较轻,其中黄化嫩茎几乎不褐化。黄化嫩茎的存活率最高(80.41%),萌蘖芽次之(64.75%),腋芽最低(52.94%)。因此,与鳞芽外植体(萌蘖芽和腋芽)相比,黄化嫩茎在启动培养中污染率更低、成活率更高,且不发生褐化(图1B、C)。

表2 外植体类型对启动培养的影响①Tab.2 Effects of explant types on initial culture

图1 优化的‘正午’牡丹微繁殖技术Fig. 1 An optimized protocol for the micropropagation of Paeonia × lemoinei ‘High Noon’A:‘正午’牡丹; B: 启动培养10 d后萌动的鳞芽外植体; C: 启动培养10 d后萌动的黄化嫩茎外植体; D: 试管苗于最佳LED光照培养条件下(光质配比70%红光+30%蓝光、光照强度50 μmol·m-2s-1)增殖培养3代获得的丛生芽; E: 复壮培养20 d后的试管苗; F: 根诱导培养的试管苗; G: 一步生根法(IBA 1.0 mg·L-1,VB2 1.0 mg·L-1)获得的生根苗; H: 移栽后于人工气候室生长3个月的组培苗; I: 移栽后第2年于温室正常生长的组培苗。A: Flowering plant of Paeonia × lemoinei ‘High Noon’; B: Scale bud after 10 days of initial culture; C: Etiolated shoot after 10 days of initial culture; D: The shoot cluster after 3 subcultures under the optimal LED illumination(light quality 70% Red+30% Blue, light intensity 50 μmol·m-2s-1); E: Shoots obtained after 20 days of rejuvenation culture; F: Shoots in root induction culture; G: Rooted shoots obtained by one-step rooting method(IBA 1.0 mg·L-1, VB2 1.0 mg·L-1); H: Plantlets grown in artificial climate chamber after three months of ex vitro establishment; I: Plantlets grown in greenhouse after two year of ex vitro establishment.
2.2 LED光照培养体系的建立
2.2.1 红蓝光质配比筛选 适宜红蓝光质配比的LED光源可以显著促进‘正午’牡丹试管苗的生长,但对增殖无显著促进作用(图2、图3)。100%红光(R)处理试管苗的增殖系数和茎长最大,且显著高于荧光灯对照,但其茎叶白化、细长,生长不良; 100%蓝光(B)处理试管苗茎叶深绿、生长正常,但增殖系数以及各项生长指标与荧光灯对照均无显著差异; LED红蓝光质混合处理显著提高了试管苗的茎长和叶片数,但其增殖系数和鲜质量与荧光灯对照无显著差异,其中70% R+30% B处理试管苗的茎长(1.69 cm)和叶片数(8.74)均显著高于对照,且整体生长健壮,因此该处理为‘正午’牡丹增殖培养的最佳LED红蓝光质配比。
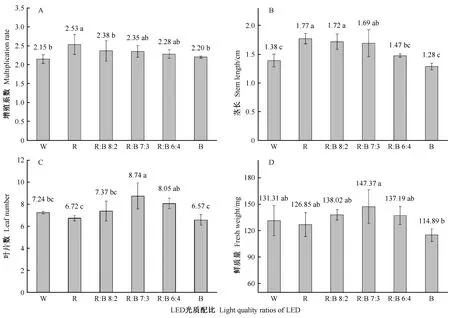
图2 LED光质配比对‘正午’牡丹试管苗增殖和生长的影响Fig. 2 Effects of LED light quality on in vitro shoot multiplication and growth of Paeonia × lemoinei ‘High Noon’数据表示均值±标准差; 不同小写字母表示在P ≤ 0.05水平差异显著; W、R和B分别表示荧光灯、红光和蓝光。The data are means ± standard error; different letters indicate significant differences at P ≤ 0.05; W, R and B represent fluorescent lamp, LED light of red and blue, respectively.

图3 不同红蓝光质配比条件下‘正午’牡丹试管苗的增殖和生长表现Fig. 3 In vitro shoot multiplication and growth of Paeonia × lemoinei ‘High Noon’cultured under different light qualityA: W; B: 100%R; C: 80%R+20%B; D: 70%R+30%B; E: 60%R+40%B; F: 100%B. W、R和B分别表示荧光灯、红光和蓝光。W, R and B represent fluorescent lamp, LED light of red and blue, respectively.
2.2.2 光照强度筛选 在LED光质试验筛选的最佳红蓝光质配比(70% R+30% B)条件下设置不同光照强度处理,结果显示,光照强度对试管苗的增殖和生长均存在显著影响(图4、图5)。增殖系数、叶片数均随着光照强度的增大呈先上升后下降的趋势,当光照强度为50 μmol·m-2s-1时,试管苗的增殖系数和叶片数均达到最大值,且显著高于30 μmol·m-2s-1时; 适当提高光照强度有利于提高试管苗的鲜质量,50~90 μmol·m-2s-1光照强度处理的试管苗鲜质量显著高于30 μmol·m-2s-1; 然而,提高光照强度对茎的伸长生长存在抑制,90 μmol·m-2s-1光照强度处理的试管苗茎长显著低于30 μmol·m-2s-1。因此,在红蓝光质配比为70% R+30% B条件下,‘正午’牡丹增殖培养的最佳光照强度为50 μmol·m-2s-1,在该条件下试管苗继续培养3代增殖和生长状况良好(图1D)。

图4 光照强度对‘正午’牡丹试管苗增殖和生长的影响Fig. 4 Effects of illumination intensity on the in vitro shoot multiplication and growth of Paeonia × lemoinei ‘High Noon’数据为均值±标准误; 不同小写字母表示在P≤0.05水平差异显著。The data are means ± standard error; different letters indicate significant differences at P ≤ 0.05.

图5 不同光照强度条件下‘正午’牡丹试管苗的增殖和生长表现Fig. 5 In vitro shoot multiplication and growth of Paeonia × lemoinei ‘High Noon’cultured under different light intensityA: 30 μmol· m-2 s-1; B: 50 μmol· m-2 s-1; C: 70 μmol· m-2 s-1; D: 90 μmol· m-2 s-1.
2.3 一步生根体系的建立
通过VB2浓度筛选和生根光照条件控制,构建牡丹试管苗一步生根技术(表3)。结果显示,在一步生根法中,不添加VB2处理的试管苗生根率最低(50.64%),根数最少(1.09),根长最短(1.21 cm),且试管苗基部愈伤组织较多(等级2)。1.0~5.0 mg·L-1VB2处理的组培苗的生根率(71.07%~74.23%)和根数(3.17~3.34条)与两步生根法(生根率77.21%,根数2.84条)无显著差异,且试管苗基部愈伤组织极少(等级1)。但是,进一步提高VB2浓度至10~15 mg·L-1会抑制生根,15 mg·L-1VB2处理的试管苗的生根率、根数和根长皆显著低于两步生根法。因此,在生根培养基含1.0 mg·L-1IBA条件下,通过添加1~5 mg·L-1VB2以及培养过程中的光照条件控制(先暗培养30天,再光照培养20天)可以实现牡丹试管苗的一步生根,其生根效果与两步生根法相当,且生根苗基部愈伤组织更少,有利于移栽成活(图1G)。
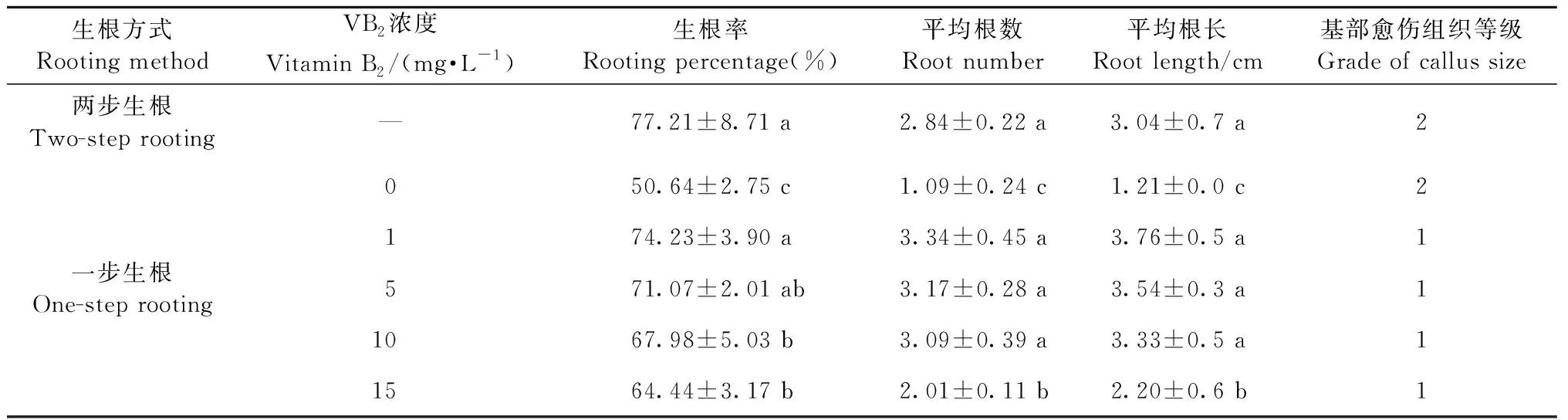
表3 VB2对‘正午’牡丹试管苗生根的影响①Tab.3 Effects of VB2 on the in vitro rooting Paeonia× lemoinei ‘High Noon’
2.4 驯化移栽
分别调查一步和两步生根处理试管苗移栽成活情况,发现试管苗质量与移栽成活率密切相关,一级苗成活率最高,移栽60天后成活率分别为85.00%(一步生根)和82.00%(两步生根),但二、三级苗移栽成活率较低,尤其是三级苗仅10%左右成活,且观察发现茎基部高度膨大的愈伤组织易腐烂导致全株死亡(表4)。比较观察2种生根方法获得的生根苗质量,发现一步生根法获得的生根苗基部愈伤组织较少,生根苗质量更佳,一级苗比例比两步生根法提高了12.5%,且试管苗移栽后可以正常生长(表4; 图1H、I)。

表4 生根方式对‘正午’牡丹试管苗移栽成活率的影响Tab.4 Effects of rooting method on transplanting survival rate of Paeonia× lemoinei ‘High Noon’plantlets
3 讨论
3.1 黄化嫩茎是适宜的牡丹微繁殖外植体
牡丹微繁殖通常以休眠鳞芽为外植体,但最佳取材时间仅限于早春鳞芽萌动前,且灭菌污染率较高(Wenetal., 2020)。本研究比较了黄化嫩茎与2种鳞芽(萌蘖芽、腋芽)的启动培养效果,发现黄化嫩茎污染率较低(19.59%),存活率较高(80.41%),是一种优于鳞芽的外植体来源。然而,孔祥生等(1998)在牡丹‘洛阳红’(P.suffruticosa‘Luoyang Hong’)中得出了完全相反的结论,发现鳞芽外植体灭菌成活率(63.5%~80.0%)显著高于嫩茎(11.7%)。这可能与外植体预处理有关,前人研究采用的是大田植株早春萌发的嫩茎,本研究采用的黄化嫩茎在温室暗处理(黄化)过程中降低了环境污染,且在灭菌环节能够与灭菌剂充分接触从而提高了灭菌效率,而黄化处理可降低外植体灭菌污染率在芍药(P.lactiflora)中也有报道(王吉凤等, 2012)。因此,外植体类型和预处理都是影响牡丹启动培养的关键因素,与萌蘖芽和腋芽相比,黄化嫩茎更适宜用作牡丹微繁殖的外植体。综合来看,采用黄化嫩茎进行离体培养打破了牡丹微繁殖只能在早春取鳞芽外植体的限制,其灭菌染菌率低于鳞芽,在工厂化生产方面具备更高的可行性和生产效率。
3.2 LED光照培养可促进牡丹试管苗的增殖和生长
光是影响植物生长发育最重要的环境因子之一,光质和光照强度对植物的生长发育、形态建成和生理代谢等均有重要调控作用(高荣孚等, 2002)。红光和蓝光是植物生长必需的2种光谱,也是光合色素吸收的主要光谱(Macedoetal., 2011; 马宏等, 2017)。本研究发现单一红光(R)或蓝光(B)无法满足‘正午’牡丹试管苗的增殖培养需求,其中红光有利于试管苗的腋芽萌发和茎的伸长,但100% R处理的试管苗茎叶白化、细长,生长不良,这与在非洲菊(Gerberajamesonii)(孙翊等, 2017)、菊花(Chrysanthemummorifolium)(Diercketal., 2017)等植物中的研究结论一致; 100% B处理试管苗的茎叶深绿、生长正常,但增殖系数和各项生长指标与荧光灯对照均无显著差异,这可能是由于蓝光促进了叶绿素合成的原因(孙翊等, 2017; 项蕾蕾等, 2020)。进一步尝试不同光质配比发现,适宜配比的红蓝复合光(70% R+30% B)能够叠加红蓝单色光的优点,可以显著促进‘正午’牡丹试管苗的生长(叶片数、茎长),但对增殖无显著促进作用。然而,这与牡丹品种‘乌龙捧盛’(P.suffruticosa‘Wulong Pengsheng’)(75% R+25% B)、‘洛阳红’(75% R+25% B)以及‘胡红’(P.suffruticosa‘Hu Hong’)(50% R+50% B)(岳岚, 2008)试管苗的最佳光质配比不一致,说明不同牡丹品种对红蓝光的需求量存在一定差异,LED光源在牡丹微繁殖中的应用需根据品种筛选最佳的红蓝光质配比。此外,光照强度也是影响植物生长发育的重要光照参数,光照强度过强过弱都会抑制光合作用,从而限制植物生长(尚三娟等, 2020)。目前,牡丹增殖培养的常用光照强度为30 μmol·m-2s-1,本研究发现在LED光质配比70%R+30%B条件下,适当提高光照强度可以显著促进试管苗的增殖和生长,其中50 μmol·m-2s-1为最佳处理,其增殖系数(3.79)、叶片数(15.75)和鲜质量(410.21 mg)均显著高于30 μmol·m-2s-1处理的相关指标,这与牡丹‘乌龙捧盛’试管苗的最佳光照强度(闫新房, 2009)一致。
综上所述,与传统荧光灯光源(30 μmol·m-2s-1)相比,适宜的LED光源(光质配比70%R+30%B,光照强度50 μmol·m-2s-1)可以显著促进‘正午’牡丹试管苗的增殖和生长,将增殖系数由2.15提高到3.79,且试管苗生长健壮,从而优化了微繁殖技术的增殖培养环节。然而,目前LED光源在牡丹微繁殖中的应用仍处于技术探索阶段,对于光质和光照强度调控牡丹试管苗增殖和生长的内在机理还有待进一步探索。
3.3 一步直接生根法是牡丹试管苗生根的有效技术
IBA是有效诱导牡丹不定根发生的常用生长素,前人比较了不同生根方式(一步生根法、两步生根法)的生根效果,发现两步生根法生根率较高,即先将试管苗置于含IBA的培养基暗培养以诱导根原基,再转至不含生长素的培养基培养以促进不定根伸长(Bouzaetal., 1994; Berutoetal., 2007)。两步生根法成功的主要原因在于根原基诱导需要生长素刺激,而后续不定根伸长不需要高浓度生长素(王清民等, 2006; 贺丹等, 2011; 尚文倩等, 2021),此时若继续给予高浓度生长素反而会对不定根伸长产生一定的抑制作用,因此两步生根法被广泛应用于核桃(Juglansregia)(裴东等, 2002; 樊靖等, 2009)、柿树(Diospyroskaki)(刘一凤, 2017)以及梨(Pyruscommunis)(苗冉冉等, 2019)等难生根的木本植物中。目前,两步生根法是牡丹试管苗生根的主要方式(文书生等, 2016; Wenetal., 2016a; 2016b; 王新等, 2016; Shangetal., 2017; 王蒙蒙等, 2018),但培养过程需更换培养基,流程复杂、成本高,并不利于生产推广。
有研究发现,IBA和VB2在黑暗条件下性质基本稳定,但在光照条件下均会逐渐分解; 培养基中二者共存时,VB2在光照下的分解速度不受IBA的影响,而IBA在光照下的分解速度却因VB2的存在而加快(Fossardetal., 1974; Drewetal., 1991; 1993)。据此本研究构建了新型牡丹试管苗一步生根技术,即试管苗先于附加IBA 1.0 mg·L-1和VB21.0~5.0 mg·L-1的培养基中暗培养诱导根原基30天,再转至光照下培养20天利用VB2加速分解IBA以促进不定根伸长。该方法所得生根率(71.07%~74.23%)和根数(3.17~3.34条)与两步生根法(生根率77.21%,根数2.84条)无显著差异,这与番木瓜(Caricapapaya)(Drewetal., 1991)中的研究结果一致,说明利用IBA和VB2的光反应特性可以实现牡丹试管苗高效一步生根,这可能是由于VB2可以充当生长素光氧化反应的光受体,继而促进生长素的分解,从而避免了生长素对不定根伸长生长的抑制作用(Galstonetal., 1949a; 1949b; Gorstetal., 1983)。此外,本研究中一步生根法(VB21.0~5.0 mg·L-1)获得的生根苗基部愈伤组织较少,更易于移栽成活,这主要是由于试管苗基部愈伤组织易造成根与茎的维管组织连接不畅(贺丹等, 2011; 贾文庆等, 2013),且移栽后愈伤组织极易腐烂导致植株死亡(张颖星, 2008; 邱金梅, 2010; 王新等, 2016)。本研究建立的一步生根法与前人报道的牡丹一步生根法(Bouzaetal., 1994; Berutoetal., 2007)相比,其通过VB2的使用以及培养过程的光照条件控制大幅提高了生根率和生根质量; 与牡丹两步生根法(文书生等, 2016; Wenetal., 2016a; 2016b; 王新等, 2016; Shangetal., 2017; 王蒙蒙等, 2018)相比,其操作流程简单、生产成本低、移栽成活率高,可以在牡丹微繁殖中推广应用。然而,鉴于不同牡丹品种不定根诱导适宜的IBA浓度存在较大差异,其对应VB2处理浓度也需进行相应调整,本研究报道的IBA和VB2浓度仅供参考。
4 结论
本研究围绕牡丹微繁殖过程中启动、增殖、生根、移栽阶段存在的突出问题,对‘正午’牡丹微繁殖技术进行了优化: 发掘了优于鳞芽的外植体类型——黄化嫩茎,能够有效降低污染、提高启动培养的成活率; 建立了LED光照培养体系(光质配比70%红光+30%蓝光,光照强度50 μmol·m-2s-1),该光照条件显著促进了试管苗的增殖和生长; 通过在生根培养基中添加1.0 mg·L-1IBA和1~5 mg·L-1VB2,结合培养过程光照条件控制(暗培养30天后再光照培养20天),建立了高效的牡丹试管苗一步生根法,在不降低生根率的前提下,提高了生根苗质量与移栽成活率。本研究所建立和优化的‘正午’牡丹微繁殖技术体系,不仅能够促进该品种种苗规模化生产,还可以为其他牡丹品种的微繁殖研究提供参考和借鉴。
