暗紫贝母鲨烯合酶基因的克隆及其组织表达分析
2021-02-12王威威李德鑫李秋娥张富丽周嘉裕
王威威,李德鑫,李秋娥,廖 海,张富丽,周嘉裕*
(1.西南交通大学生命科学与工程学院,四川 成都 610031;2.四川省农业科学院分析测试中心,四川 成都 610066)
【研究意义】暗紫贝母(Fritillariaunibracteata)为百合科多年生草本植物,主产于川西高原地区,为四川名贵道地药材川贝母的基原植物之一。暗紫贝母以其干燥鳞茎入药,味苦,微寒,归肺、心经,具有清热润肺,止咳化痰,镇静平喘,抗炎降压等多种功效,习称为“松贝”[1-2]。暗紫贝母的主要活性成分包括异甾体类生物碱和甾体类生物碱,其中异甾体类生物碱所占比例约为75%[3]。【前人研究进展】高等植物中,异甾体生物碱与甾体类生物碱的生物合成与三萜的生物合成都是通过甲羟戊酸(MVA)途径进行的[4-5]。鲨烯合酶(Squalene synthase,SQS)是MVA途径的一个关键酶,其催化两分子的法尼基焦磷酸 (famesyl diphosphate,FPP)缩合生成鲨烯(squalene),鲨烯(squalene)经过一系列氧化还原反应后,生成异甾类与甾体类生物碱。鲨烯合酶SQS的含量与活性决定了MVA途径后续产物的产量[6-9]。鉴于SQS在MVA途径的关键地位,对植物中鲨烯合酶的研究已成为植物MVA途径关键酶研究的热点。【本研究切入点】目前已经从甘草[8]、山楂[11]、刺五加[10]等多种植物中克隆出SQS的cDNA序列,但暗紫贝母中SQS的相关研究未见报道。实验室前期已获得了暗紫贝母转录组数据,从中发现有8条功能注释为SQS的Unigene。【拟解决的关键问题】本文从中选择ORF长度最长(1230 bp)的SQS Unigene,利用RT-PCR的方法,克隆得到暗紫贝母SQS的ORF序列,并对序列开展生物信息学分析,最后通过Real-time PCR的方法分析SQS在暗紫贝母不同组织中表达水平的差异,从而为深入研究SQS在暗紫贝母生物碱生物合成途径的调控机制提供科学依据,并为体外生物合成川贝母生物碱的研究奠定理论基础。
1 材料与方法
1.1 供试材料
暗紫贝母(Fritillariaunibracteata)完整植株采自青海省西宁市互助县青海绿康生物开发有限公司,经西南交通大学生命科学与工程学院周嘉裕副教授鉴定为暗紫贝母,清水洗净后,滤纸吸干植株表面水分,液氮速冻后保存于-80 ℃冰箱备用。
RNA提取试剂盒、琼脂糖凝胶回收试剂盒购自北京天根生化科技有限公司;反转录试剂盒(Prime-Script RT reagent Kit)、LA酶、pMD19-T载体、DL2000 DNA marker购自TaKaRa公司;DH5α感受态细胞、2×T5 FAST qPCR Mix(SYBR GreenⅠ)试剂盒购自北京擎科生物有限公司;引物合成和基因测序由北京擎科生物有限公司完成。
1.2 试验方法
1.2.1 暗紫贝母各组织RNA的提取 根据RNA提取试剂盒说明书提取暗紫贝母鳞茎、茎、叶、花中的RNA,用1.0%琼脂糖凝胶电泳检测RNA完整性,使用Bio-Tek酶标仪检测其纯度和浓度,并于-80 ℃冰箱保存。
1.2.2 暗紫贝母各组织RNA的逆转录 取三年生成熟期暗紫贝母鳞茎、茎、叶、花中的RNA各1000 ng,根据PrimeScript RT Reagent Kit试剂盒说明书进行逆转录。
1.2.3 PCR扩增cDNA 根据本实验室已有的暗紫贝母转录组数据,得到功能注释为鲨烯合酶基因(SQS)的Unigene,利用ORFfinder(https://www.ncbi.nlm.nih.gov/orffinder/)查找序列的开放阅读框(ORF),并用Primer primier 5.0设计ORF序列特异性引物(表1),以逆转录得到的鳞茎cDNA为模板进行PCR扩增。LA酶PCR体系为50 μL,其中上下游引物各1 μL,10×LA PCR Buffer(Mg2+Plus)5 μL,dNTP Mix 8 μL,模板cDNA 2 μL,LATaq酶0.5 μL,补灭菌ddH2O至50 μL。PCR反应程序:预变性95 ℃,5 min;变性 95 ℃,30 s;退火58 ℃,30 s;延伸 72 ℃,2 min,32个循环72 ℃延伸7 min。取10 μL扩增产物在1.5%琼脂糖凝胶上电泳鉴定。
1.2.4 PCR产物回收及单克隆测序 PCR产物经1.0% 琼脂糖凝胶电泳后,于紫外光下切下目的条带,按照琼脂糖凝胶回收试剂盒说明书进行胶回收,将纯化后的PCR产物与 pMD19-T Vector 16 ℃过夜连接,将重组质粒转化到DH5α感受态细胞中。均匀涂布在含IPTG、X-gal 和Amp的LB平板上。37 ℃培养16 h 左右,随机挑选8个白斑,摇菌培养6~8 h,将PCR扩增验证为阳性的菌液送北京擎科生物有限公司测序。
1.2.5 生物信息学分析 ExPASyProteomics Server (https://web.expasy.org/protparam/)在线分析蛋白质的相对分子质量、等电点、疏水性等基本理化性质。TMHMM Server v.2.0 (http://www.cbs.dtu.dk/services/TMHMM-2.0/)预测蛋白质跨膜结构域。SingnalP 4.1(http://www.cbs.dtu.dk/sevices/signalP/)进行信号肽分析。PSORT(https://www.psort.org/)进行亚细胞定位的预测。NCBI在线分析工具CDD(https://www.ncbi.nlm.nih.gov/Structure/cdd/wrpsb.cgi)分析蛋白质保守结构域。SOPMA (http://npsa-pbil.ibcp.fr/cgi-bin/npsa_automat.pl?page=npsa_sopma.html)分析蛋白质的二级结构,并通过SWISS-MODEL(https://swissmodel.expasy.org/)进行SQS蛋白三级结构同源建模。使用Clustal W进行比对分析,并从GenBank下载醋杆菌等48个物种的SQS氨基酸序列(表2)利用MEGA 7.0构建Neighbor-joining系统发育树,Bootstrap重复次数为 1000次。

表1 引物序列信息
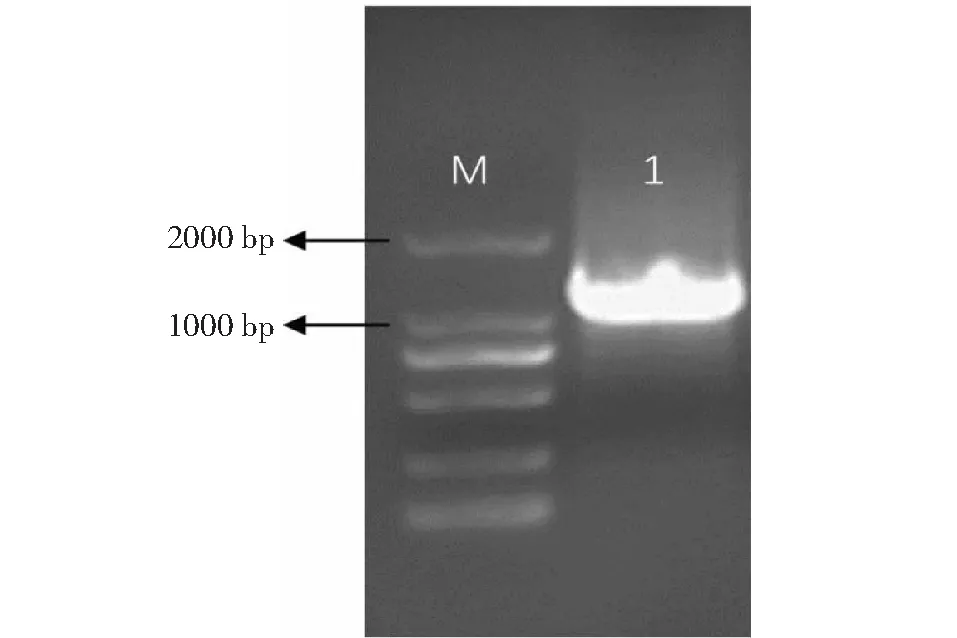
M:DL2000 marker; 1:PCR扩增产物 M: DL2000 marker; 1: PCR product图1 FuSQS的扩增产物Fig.1 Amplification product of FuSQS
1.2.6FuSQS基因在暗紫贝母不同组织中相对表达量分析 以暗紫贝母18S基因为内参,利用Primer primier 5.0软件根据测序结果和18 S基因设计qRT-PCR 扩增引物和内参引物。以逆转录出的暗

表2 不同物种SQS氨基酸序列信息
续表2Continued table 2
紫贝母各组织cDNA为模板,采用2×T5 FAST qPCR Mix(SYBR GreenⅠ)试剂盒在Roche Light Cycler96荧光定量PCR仪中进行PCR 检测,每个样品平行做3次,所得数据按照Cq(2-ΔΔCq)法计算SQS基因的相对表达量。qPCR体系为:2×T5 FAST qPCR Mix 10 μL,上下游引物各0.8 μL,模板cDNA 1 μL,补灭菌ddH2O至20 μL。qPCR反应程序95 ℃预变性,1 min。95 ℃,30 s;56 ℃,40 s;72 ℃,20 s;40个循环,同时绘制熔融曲线。
2 结果与分析
2.1 cDNA扩增结果
参照暗紫贝母转录组数据,设计引物上游引物FuSQS-F、下游引物FuSQS-R,以暗紫贝母鳞茎cDNA为模板进行PCR扩增,结果显示扩增产物长度与预期相符(图1),通过单克隆测序验证获得一条长度为1230 bp暗紫贝母SQS基因ORF核苷酸序列,将其命名为FuSQS,提交GenBank获得注册号MW365404,使用DNAMAN 6.0将所得核苷酸序列与所选转录组SQS Unigene的ORF序列进行比对,二者序列相似度为99.59%,验证了转录组数据的准确性。
2.2 暗紫贝母SQS氨基酸序列生物信息学分析
FuSQS编码蛋白的氨基酸残数为409,理论相对分子质量为46.84 kDa,理论等电点(pI)为6.33,不稳定指数(instability index)为41.36,说明该蛋白为不稳定蛋白,脂肪指数(Aliphatic index)为92.25,总平均疏水性(GRAVY)为-0.099,说明该蛋白为亲水性蛋白。应用SingnalP4.1进行信号肽分析,结果显示该蛋白不含信号肽,说明该蛋白属于非分泌性蛋白。用在线软件PSORT进行亚细胞定位的预测,结果表明该蛋白最有可能定位于内质网膜上。利用TMHMM Server v.2.0预测蛋白质的跨膜结构域,结果表明该蛋白在287~304 aa和386~408 aa存在两个跨膜超螺旋结构域,1~286 aa和409 aa位于内质网膜外,305~386 aa位于内质网膜内。
CDD结果显示该蛋白属于类异戊二烯生物合成超家族Ⅰ类,含有法尼基焦磷酸结合口袋和镁离子结合位点——富含天冬氨酸的区域,并特异性命中三个鲨烯合酶(SQS)的重要结构域:Trans_IPPS_HH、SQS-PSY和ERG9,进一步验证了该蛋白为鲨烯合酶(SQS)。将暗紫贝母SQS氨基酸序列与已报道的智人、葡萄球藻、重楼、青蒿、拟南芥、甘草、红豆杉、烟草、玉米等物种的SQS氨基酸序列进行比对,结果(图2)显示,以上物种氨基酸序列有6个较为保守的区域,结合保守结构域预测结果,发现SQS酶活性中心相关的47VSRSF52、77DTVED81、213DYLED217、R225均高度保守[17],且都落在6个保守区域内。

EgSQS:油棕;PpSQS:宽瓣重楼;FuSQS:暗紫贝母;ZmSQS:玉米;NtSQS:烟草;GgSQS:光果甘草;AaSQS:青蒿;AtSQS:拟南芥;TcSQS:红豆杉;BbSQS:葡萄球藻;HsSQS:智人 EgSQS: Elaeis guineensis; PpSQS: Paris polyphylla var.yunnanensis; FuSQS: Fritillaria unibracteata; ZmSQS: Zea mays; NtSQS: Nicotiana tabacum; GgSQS: Glycyrrhiza glabra; AaSQS: Artemisia annua; AtSQS: Arabidopsis thaliana; TcSQS: Taxus cuspidate; BbSQS: Botryococcus braunii; HsSQS: Homo sapiens图2 FuSQS编码蛋白与部份物种SQS蛋白的序列对比Fig.2 Sequence comparison of FuSQS protein and SQS proteins of some species

图3 FuSQS编码蛋白三级结构预测分析模型Fig.3 Tertiary structure prediction and analysis model of FuSQS encoded protein
利用SOPMA对该蛋白二级结构分析,结果显示该蛋白由409个氨基酸残基组成,在二级结构中α螺旋占 71.15%,β折叠占3.18%,延伸主链占3.42%,无规则卷曲占 22.25%。由此可见,在暗紫贝母SQS蛋白结构中,α螺旋和无规则卷曲是主要构成元件,β折叠和延伸主链可能散布于蛋白质结构中。
由于目前还未成功获得植物中SQS蛋白的三维结构,因此以三维结构已被解析的人类SQS蛋白为模板进行同源建模。经过对比,暗紫贝母SQS与模板3vj9.1.A的序列相似度达49.24%,通过SWISS-MODEL对暗紫贝母SQS进行同源建模从而预测暗紫贝母SQS的三维结构(图3)。预测结果提示,暗紫贝母SQS蛋白为单体球状蛋白,其活性中心主要是由几个α螺旋围绕形成的中央疏水底物结合口袋,用以催化底物,根据SQS蛋白保守结构域的预测结果以及暗紫贝母SQS与人类SQS对比结果可知,暗紫贝母SQS催化活性中心与人SQS的相应区域关键氨基酸残基高度保守,因此可以推测暗紫贝母SQS与人类SQS[15]的催化机制可能十分相同。
2.3 暗紫贝母SQS进化关系分析
通过MEGA 7.0构建系统进化树,结果将49条SQS按不同来源分别聚为细菌、真菌、动物、藻类、裸子植物、单子叶植物以及双子叶植物等7个分化簇(图4)。其中,FuSQS与同为百合科的花贝母聚为一类,并与川泽泻、铁皮石斛、盾叶薯蓣、油棕、宽瓣重楼、虎眼万年青、水稻、玉米聚为单子叶植物这一大类,说明暗紫贝母与这些物种进化关系较近,而与红豆杉等裸子植物、拟南芥等双子叶植物虽同属植物界但进化关系较远,与葡萄球藻等藻类、醋杆菌等细菌、灵芝等真菌、智人等动物的进化关系更为遥远,这一结果与形态学分类一致。
2.4 暗紫贝母SQS基因在暗紫贝母不同组织中相对表达量分析
为研究暗紫贝母SQS基因在暗紫贝母不同组织中的表达量,采用实时荧光定量PCR进行分析,以暗紫贝母鳞茎为对照组,茎、叶、花为实验组,并采用Cq(2-ΔΔCq)法进行数据处理,结果(图5)显示,暗紫贝母SQS基因在不同组织中表达量具有显著差异,在鳞茎中表达量最高,叶中表达量次于花和鳞茎但高于茎,茎中表达量最少。
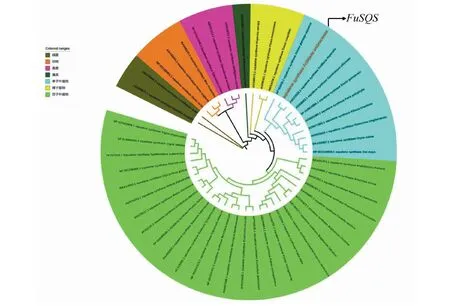
图4 FuSQS与其他物种SQS氨基酸序列对比构建的系统进化树Fig.4 Phylogenetic tree constructed by comparing the amino acid sequence of FuSQS with other species
3 讨 论
本文借助实验室前期所获得的转录组数据成功克隆出FuSQS基因的完整ORF序列,测序结果与转录组数据一致,证实了转录组数据的可信度。对暗紫贝母SQS氨基酸序列的分析结果表明暗紫贝母SQS蛋白由409个氨基酸残基构成,分子量46.84 kDa,是定位于内质网膜上的亲水单体酶,二级结构以α螺旋为主,其活性中心主要是由几个α螺旋围绕形成的中央疏水空腔,其催化机制可能与人类SQS[15]的催化机制可能十分相同。这一结果与已报道的川泽泻[12]、罗汉果[9]、黑老虎[14]、三七等植物的SQS较为相似,说明植物中的SQS蛋白结构保守性较高。该蛋白有两个跨膜结构域(287~304 aa、386~408 aa),是SQS蛋白锚定在内质网膜上的肽段,羧基端跨膜结构域肽段是必需的,若缺失会导致SQS蛋白在细胞中积累[16]。保守结构域分析发现,暗紫贝母SQS蛋白属于类异戊二烯生物合成超家族Ⅰ类,含有底物结合口袋和镁离子结合位点——富含天冬氨酸的区域,其中77DTVED81和213DYLED217这两个富含天冬氨酸的肽段是 SQS与Mg2+的结合位点,主要起结合异戊烯磷酸基团的作用,是催化2分子的法呢基焦磷酸缩合生成鲨烯的关键位点[18],而这两个肽段在不同的物种SQS中高度保守,说明这些位点在SQS蛋白在长期进化中受到强烈的负选择作用约束,为维持SQS的催化作用起到重要作用。
FuSQS与其他48种不同物种的SQS构建系统进化树,得出的系统分类结果与形态学分类结果一致,表明通过SQS氨基酸序列构建的系统进化树,可以较为准确地反映物种之间的亲缘关系。
研究表明植物中的SQS基因表达具有组织特异性,研究发现铁皮石斛[19]SQS基因表达存在组织特异性,根中的表达量远高于茎和叶,蛇足石杉[20]SQS基因在根中表达量高于茎和叶,西洋参[21]SQS基因在须根,叶柄,种皮等14个组织中的表达量也具有显著差异。本研究的qPCR结果表明,暗紫贝母SQS基因在不同组织中表达量具有显著差异,表达量依次为鳞茎>花>叶>茎。鳞茎是暗紫贝母的药用部位,其生物碱含量在暗紫贝母组织中是最高的[22],SQS基因在暗紫贝母鳞茎中的高表达特征,揭示了SQS在暗紫贝母生物碱合成途径中具有重要的调控作用,其表达量的多少会影响后续生物碱产物的产量。后续可以进行对暗紫贝母SQS的过表达特征分析及体外蛋白表达等研究。
4 结 论
本研究根据暗紫贝母转录组数据克隆得到了FuSQS序列,且进行了一系列的生物信息学分析,并对FuSQS基因在暗紫贝母不同组织中的表达水平进行了分析,所得的结果为深入研究SQS在暗紫贝母生物碱生物合成途径的调控机制提供科学依据,并为体外生物合成川贝母生物碱的研究奠定理论基础。
