蕲艾艾粉提取物对多种植物病原真菌的抑制作用
2021-02-11李金鑫陈巧环王蕴涵周佳刘大会苗玉焕
李金鑫,陈巧环,王蕴涵,周佳,刘大会,苗玉焕
湖北中医药大学药学院,武汉 430065
植物源农药取材于植物中的天然活性成分,在自然环境中可被有效降解,利用植物源农药对农作物病虫害进行防治,对环境保护、生态平衡具有重要意义,因此近年来被大力提倡和推广。植物源杀菌剂为植物源农药中的一个重要组成部分,是利用植物中的抗菌物质或诱导产生的植物防卫素而开发出来的新型农药,可以有效杀死或有效抑制病原菌的生长[1]。植物源杀菌剂因其种类繁多,资源丰富,并且无残留,低毒或无毒,不易使病原菌产生抗性,且易于与其他农药混配而日益成为研究的热点[2]。
我国药用植物资源丰富,中药植物中的多种次生代谢产物具有良好的抗菌活性,为植物源杀菌剂的开发提供了庞大的资源库。据统计,我国作为杀菌剂的植物主要集中于楝科、菊科、豆科等30多科[3]。菊科植物艾(ArtemisiaargyiLevl et Van)的干燥叶片,为我国常用中药材,其不仅具有止血、抗肿瘤、保肝、镇痛、抗炎、抗氧化、止咳平喘等多种药理作用[4],此外还被广泛报道具有较强的抑菌活性[5]。
蕲艾为我国著名道地药材,生产艾绒用于艾灸是其主要使用途径。一般情况下,每生产1 kg艾绒需要5~30 kg艾叶,剩余的废弃物包括叶肉组织、叶柄、叶脉和其他细小碎片,俗称艾粉。艾粉富含艾叶中的大量活性物质,包括黄酮类、苯丙素类、萜类等成分[4],却未被充分利用。据初步统计,我国每年产生艾粉超1万t,因艾粉密度小、体积大,且尚未在市场上得到应用;造成其储存占用大量的厂房空间、处理成本升高,成为制约艾叶产业发展的因素之一。因此,亟需一种有效利用艾粉的方法,解决艾产业链中的废弃物处理问题。本研究以蕲艾艾粉为研究对象,探究其提取物对稻瘟病菌、山茶炭疽病菌、烟草蛙眼病菌、齐整小核菌、丝核菌、禾谷镰刀菌、链格孢、层出镰刀菌、茄病镰刀菌共9种植物病原真菌的抑制作用,旨在为植物源杀菌剂的开发、艾叶资源的充分利用提供理论依据。
1 材料与方法
1.1 材 料
1)供试菌种。稻瘟病菌(Magnaporthgrisea)、山茶炭疽病菌(Gloeosporiumtheae-sinensis)、烟草蛙眼病菌(Cercosporanicotianae)、齐整小核菌(Sclerotiumrolfsii)由云南农业大学植物病理重点实验室提供;丝核菌(Rhizoctoniasolani)、禾谷镰刀菌(Fusariumgraminearum)由湖北省农业科学院中药材研究所提供;链格孢(Alternariaalternata)、层出镰刀菌(Fusariumproliferatum)、茄病镰刀菌(Fusariumsolani)由湖北中医药大学中药资源中心实验室提供。
2)材料和试剂。艾粉(干)来自湖北省黄冈市蕲春县的湖北惠春蕲艾健康产业发展有限公司,马铃薯葡萄糖琼脂培养基(青岛高科技工业园海博生物技术有限公司),新绿原酸标准品(DSTDX001501,纯度≥98%)、绿原酸标准品(DST200822-021,纯度≥98%)、隐绿原酸标准品(DSTDY003501,纯度≥98%)均购于德斯特生物科技有限公司,异绿原酸B标准品(RFS-Y06911812012,纯度≥98%)、异绿原酸A标准品(RFS-Y06801911011,纯度≥98%)、异绿原酸C标准品(RFS-Y07011805016,纯度≥98%)均购于成都瑞芬思生物科技有限公司,山奈酚标准品(B21126- 20,纯度≥98%)购于上海源叶生物科技有限公司,棕矢车菊素标准品(PS001167,纯度均≥98%)购于成都普思生物科技股份有限公司,异泽兰黄素标准品(025-83428615,纯度≥98%)购于杭州草本源生物技术有限公司,乙酸乙酯、无水乙醇、石油醚、苯酚、乳酸、甘油、棉兰等试剂均为分析纯。
1.2 蕲艾艾粉5种提取物的制备及其指纹图谱
称取干燥蕲艾艾粉125 g共5份,分别用500 mL水、石油醚、50%乙醇(体积分数)、无水乙醇、乙酸乙酯进行提取,药液比(m/V)为1∶4。提取方法为:在提取容器中充分将药液搅拌均匀,随后将提取容器置于超声仪中超声30 min,冷浸提取24 h,使用双层滤药袋过滤,滤液保存备用;滤渣再次加入相应溶剂500 mL超声30 min后冷浸提取24 h并过滤。合并二次滤液,抽滤后置于恒温水浴锅中挥发至滤液呈浓稠状,于真空干燥箱中真空干燥(30 ℃、20 Pa),得到5种艾粉不同溶剂提取物,低温保存备用。按照以下公式计算提取率。
提取率=(可溶性浸出物的干质量/艾粉质量)×100%
参照卢化等[6]的方法构建蕲艾艾粉不同溶剂提取物的指纹图谱。色谱条件:Agilent Eclipse XDB-C18(4.6 mm×250 mm,5 μm)色谱柱,流动相为乙腈(A) - 0.2%磷酸水溶液(B),梯度洗脱(0~12 min,10%~20% A; 12~25 min,20%~25% A; 25~50 min,25%~65% A; 50~55 min,65%~10% A),流速0.8 mL/min,检测波长330 nm,柱温 30 ℃。称量上述各溶剂提取物0.02 g,溶于1.5 mL 80%甲醇后过0.45 μm滤膜得到供试品溶液。采用艾叶中常见的有效成分新绿原酸、绿原酸、隐绿原酸、异绿原酸B、异绿原酸A、异绿原酸C、山奈酚、棕矢车菊素、异泽兰黄素标准品作为对照。
1.3 蕲艾艾粉提取物的抑菌活性测定
抑菌活性采用菌丝生长速率法[7]进行测定。准确称量各提取物2.0 g,用5 mL乙醇溶解后加到95 mL马铃薯葡萄糖琼脂培养基中,高压蒸汽灭菌锅灭菌(121 ℃,15 min)后制成各提取物含药培养基,以含5%乙醇的马铃薯葡萄糖琼脂培养基为空白对照组(CK)。选取部分病原真菌菌种,用打孔器在病菌纯菌落边缘打孔切取菌饼,分别接种于空白对照培养基和各提取物含药培养基;根据真菌的生长速率,在CK组菌落接近长满培养基时,采用十字交叉法对菌落直径进行测量并计算菌丝生长抑制率,比较不同提取物之间的抑菌效果,筛选艾粉抑菌活性的最强部位。各处理组均进行3次生物学重复。
抑制率=[(空白对照组菌落直径-处理组菌落直径)/
(空白对照组菌落直径-菌饼直径)]×100%
1.4 蕲艾艾粉乙酸乙酯提取物对供试病原菌的毒力测定
准确称取艾粉乙酸乙酯提取物0.25、0.50、0.75、1.00、1.25 g,按照本文材料与方法“1.3”的方法配置成含药量分别为2.5、5.0、7.5、10.0、12.5 g/L的培养基,并选取稻瘟病菌等9种病原菌为供试菌种,按照本文材料与方法“1.3”的方法测定菌丝生长抑制率,绘制浓度-抑制率曲线,计算艾粉乙酸乙酯提取物对各病原真菌的毒力方程和EC50值。各处理组3次生物学重复。
1.5 菌落形态和菌丝生长的观察
观察材料与方法“1.4”中空白组和高剂量处理组(12.5 g/L)的菌落形态发育情况,并拍照保存记录。用无菌针挑取各菌落菌丝少量,置于载玻片上,棉兰染液(苯酚20 mL、乳酸20 mL、甘油40 mL、棉兰0.05 g、超纯水20 mL)染色后制片。置于荧光倒置显微镜下观察菌丝形态。
1.6 数据分析
利用 Excel 2010和SPSS 24.0软件对数据进行统计分析,采用单因素方差分析法(One-way ANOVA)分析不同处理组的差异显著性。
2 结果与分析
2.1 蕲艾艾粉不同溶剂可溶性浸出物的提取率及其指纹图谱比较
5种不同溶剂提取艾粉中活性成分的结果见表1。从表1可以看出,极性溶剂(乙酸乙酯、乙醇、水)相对于非极性溶剂(石油醚)具有更高的提取率。极性溶剂中,乙酸乙酯和乙醇提取率相似,提取物性状也较为接近;50%乙醇兼容水溶性成分和醇溶性成分,提取率最高,其次为水提物的提取率。说明极性溶剂更有利于艾粉粗提物的提取,且水溶性成分总量多于醇溶性成分。

表1 5种不同溶剂对蕲艾艾粉的提取率 Table 1 The extraction yields of A. argyi powder by five different solvents
蕲艾艾粉不同溶剂提取物指纹图谱结果表明不同溶剂提取物之间的成分及其含量差异较大。水提物中的成分主要集中在极性较强部位,基本前15 min出峰,12.5 min时具有1个高含量成分峰。50%乙醇提取物包含水溶性成分和醇溶性成分,所含成分种类多于其他提取物,其中异绿原酸类成分含量高于无水乙醇提取物,但山奈酚、棕矢车菊素、异泽兰黄素等黄酮类成分较无水乙醇提取物低。无水乙醇提取物和乙酸乙酯提取物指纹图谱较为相似,主要成分集中在靠后时间段出峰,包括山奈酚、棕矢车菊素、异泽兰黄素等成分,但无水乙醇提取物在20~25 min处,较乙酸乙酯提取物多3种异绿原酸类成分。石油醚提取物有效成分种类较少,在此指纹图谱测定条件下,仅在44 min左右检测到1个有效成分峰,为异泽兰黄素,且含量较低(图1)。
2.2 蕲艾艾粉提取物对几种植物病原真菌的离体抑菌活性
为初步筛选蕲艾艾粉抑制真菌活性最强的极性部位,使用高质量浓度(20 g/L)的各溶剂提取物进行离体抑菌试验,结果如表2所示。不同的提取溶剂对同一种病原真菌表现为不同程度的抑制或促进作用,且具有显著差异性。除去个别例外,如石油醚对稻瘟病菌具有较高的抑制率(达到81.17%)、对丝核菌具有一定的促进作用等,整体而言,5种溶剂提取物的抑菌活性为:乙酸乙酯>无水乙醇>50%乙醇>石油醚>水。这5种提取物对同一病原菌具有不同的抑菌活性,且不同病原菌对艾粉提取物的抑菌活性具有不同的敏感性,综合表2中数据可得,艾粉乙酸乙酯提取物相较于其他溶剂提取物,对植物病原真菌具有更强的抑制作用。
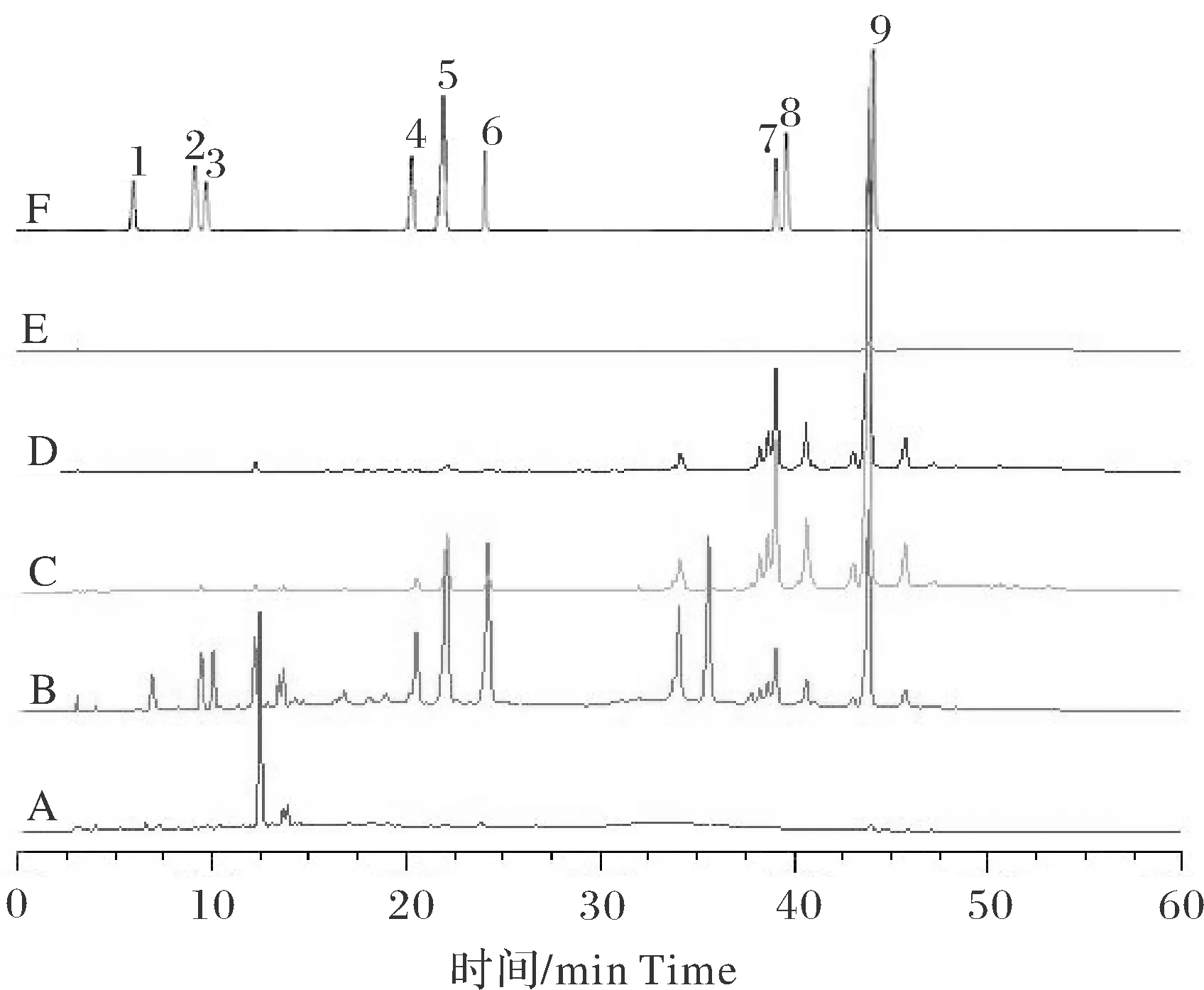
A:水提取物 Water extrac; B:50%醇提取物 50% ethanol extract; C:无水乙醇提取物 Pure ethanol extract; D:乙酸乙酯提取物 Ethyl acetate extract; E:石油醚提取物 Petroleum ether extract; F:标准品 Standard; 1:新绿原酸 Neochlorogenic acid;2:绿原酸 Chlorogenic acid; 3:隐绿原酸 Cryptochlorogenic acid; 4:异绿原酸 B Isochlorogenic acid B; 5:异绿原酸 A Isochlorogenic acid A; 6:异绿原酸C Isochlorogenic acid C; 7:山奈酚 Kaempferol; 8:棕矢车菊素 Jaceosidin; 9:异泽兰黄素 Eupatilin.
表2 艾粉不同溶剂提取物对植物病原真菌的抑制作用 Table 2 Inhibitory effects of different solvent extracts of A. argyi powder on plant pathogens )
2.3 蕲艾艾粉乙酸乙酯提取物对植物病原真菌的毒力
蕲艾艾粉乙酸乙酯提取物对植物病原真菌的抑制作用存在明显的量效关系,提取物浓度越高,抑制活性越强。较低质量浓度(2.5 g/L)处理下,齐整小核菌对其最为敏感,抑制率达到63.76%;随着处理质量浓度的增高,稻瘟病菌、山茶炭疽病菌的受抑制程度显著高于其他病原菌,12.5 g/L时抑制率分别达到91.67%、87.09%。低质量浓度艾粉乙酸乙酯提取物处理下,链格孢、烟草蛙眼病菌受抑制程度较弱,随着处理质量浓度的升高,菌丝生长受抑制程度加强,处理质量浓度为12.5 g/L时,抑制率分别达到78.59%、77.78%。通过浓度梯度法求取艾粉乙酸乙酯提取物对各供试病原菌的毒力回归方程和EC50值,结果见表3。线性模拟方程表明艾粉对齐整小核菌的抑制效果最为明显,毒力方程为Y=0.0234X+0.596,相关性系数0.974 4,EC50值为1.63 g/L;其次,对稻瘟病菌、山茶炭疽病菌、链格孢和烟草蛙眼病菌也具有较强的抑制作用,EC50值分别为2.88、3.38、5.73、5.77 g/L;对丝核菌、层出镰刀菌、茄病镰刀菌、禾谷镰刀菌的抑制作用相对较弱。

表3 不同质量浓度乙酸乙酯提取物对供试病原真菌的毒力回归方程和EC50值 Table 3 Virulence equation and EC50 value of ethyl acetate extracts at different concentrations on pathogenic fungi
2.4 蕲艾艾粉乙酸乙酯提取物对植物病原真菌菌落形态的影响
蕲艾艾粉乙酸乙酯提取物对敏感性较强的菌种(如稻瘟病、山茶炭疽病菌)能够直接抑制其菌丝的萌发生长,使之不产生菌落(图2A、2B);或者菌丝萌发但生长受到强烈抑制(如烟草蛙眼病菌、齐整小核菌),菌落极小(图2E、2I)。对于敏感性相对较弱的菌种,虽然菌丝仍然可以生长但其菌落形态发生明显变化,如层出镰刀菌的菌落由白色转变为粉红色(图2F);此外,互隔交链孢霉菌落颜色也由深黑色变为黄棕色(图2C),推测其可能的原因是提取物影响到真菌的生长发育过程、导致次生代谢产物出现较大差异。

A:稻瘟病菌 M. grisea; B:山茶炭疽病菌 G. theae-sinensis; C:链格孢A. alternata; D:丝核菌 R. solani; E:烟草蛙眼病菌 C. nicotianae; F:层出镰刀菌 F. proliferatum; G:茄病镰刀菌 F. solani; H:禾谷镰刀菌 F. graminearum; I:齐整小核菌 S. rolfsii.
2.5 蕲艾艾粉乙酸乙酯提取物对几种典型致病菌菌丝生长的影响
菌丝显微结构观察发现,相较于空白对照,不同病原菌提取物处理后其显微结构会发生不同的异常变化,变化主要包括4种类型,如层出镰刀菌的分生孢子数量明显减小(图3A),表明其繁殖过程受到抑制;丝核菌的菌丝体出现明显皱缩,部分连接处发生断裂(图3B),齐整小核菌的菌丝较空白对照更为细弱,且生长杂乱(图3C),表明其生长过程受到抑制;链格孢的膜透性发生改变,处理组菌丝体更易被棉兰染液染成蓝色(图3D),表明其正常的生命进程受到影响。

A:层出镰刀菌 F. proliferatum; B:丝核菌 R. solani; C:齐整小核菌 S. rolfsii; D:链格孢A. alternata.
3 讨 论
明确可高效提取植物抑菌活性成分的溶剂,对鉴定主要抑菌物质、深入开发植物源杀菌剂具有指导意义。如杨春等[8]通过石油醚、乙酸乙酯、丙酮和水对锦灯笼进行浸提,发现锦灯笼乙酸乙酯提取物相较于其他提取溶剂具有更强的抑制效果;太行菊乙醇提取液抑菌效果好于水提液,其中80%乙醇提取液抑菌效果最显著[9]。本研究发现,艾粉不同溶剂提取物的抑菌效应强弱为乙酸乙酯>无水乙醇>50%乙醇>石油醚>水,表明艾粉抑制植物病原真菌的活性成分主要为酯溶性成分和醇溶性成分。目前艾叶挥发油被广泛报道具有良好的抑菌活性,但挥发油提取率通常较低,为0.75~1.75 mL/100 g[10],艾粉乙酸乙酯提取物的提取率可达7.49%,具备大量开发为植物源杀菌剂的潜能。
本研究在确定乙酸乙酯为提取艾粉抗真菌活性成分的理想溶剂后,通过浓度梯度法测定了艾粉乙酸乙酯提取物对9种供试病原菌的抑制活性。结果显示,艾粉乙酸乙酯提取物对9种植物病原菌的生长均具有抑制作用,其中齐整小核菌受抑制最为明显,稻瘟病菌、山茶炭疽病菌、链格孢、烟草蛙眼病菌次之,丝核菌、层出镰刀菌、茄病镰刀菌、禾谷镰刀菌受抑制程度相对较弱。此外,病原菌正常的菌落发育和菌丝生长在艾粉处理条件下均出现明显异常。表明艾粉提取物对齐整小核菌导致的白绢病[11]、稻瘟病菌导致的稻瘟病、山茶炭疽病菌导致的山茶炭疽病、链格孢导致的叶斑病[12]、烟草蛙眼病菌导致的烟草蛙眼病可能具有良好的防治效果,对丝核菌导致的纹枯病和镰刀菌属真菌导致的根腐病也可能具有一定的抑制作用,是一种抑菌作用较强且具有广谱抗真菌活性的天然杀菌剂。笔者所在课题组在田间种植菊花的试验中,发现菊花根腐病的致病菌主要包括齐整小核菌、茄病镰刀菌等多种致病菌[13],而田间施撒艾粉0.1 kg/m2和0.2 kg/m2时根腐病发病率可分别下降42.77%和68.49%[13-14]。此外,艾粉乙酸乙酯提取物还能明显抑制黄萎病菌对棉花的侵染,棉花伤根处理(浸泡于黄萎病菌孢子液中)后种植,土壤中拌入乙酸乙酯提取物后可有效降低棉花黄萎病的发病指数,当施用量达到2.00 g/kg(提取物含量/土壤)时,可以完全阻断黄萎病菌对棉花的侵染[15]。艾粉及其乙酸乙酯提取物在作为天然杀菌剂应用的过程中,均表现出良好的活性,具备进一步开发成商用植物源杀菌剂的潜力。艾粉中主要含有萜类、黄酮、苯丙素、芳香酸(醛)、甾体及脂肪酸等化学成分[16],而杂环类植物源杀菌活性成分主要是生物碱类、黄酮类、香豆素类等化合物[17],艾粉乙酸乙酯提取物中抑菌活性成分的鉴定还有待进一步深入研究。
