薏苡仁油对卵巢癌SKOV3细胞凋亡的作用及机制研究
2021-02-11蔡国青王运萍
徐 佳,魏 莉,蔡国青,郭 倩,王运萍,杨 红
(空军军医大学西京医院妇产科,陕西 西安 710032)
卵巢癌是妇科恶性程度较高的肿瘤,其发病率位于妇科肿瘤第二位[1]。由于卵巢癌早期病变不易发现,晚期病例缺乏有效的治疗手段,其致死率在妇科肿瘤中居于首位,对女性的生命健康造成严重威胁。目前卵巢癌的治疗包括手术切除,辅助以化疗、放疗以及靶向治疗等综合方案[2-3]。大多数晚期卵巢癌患者对基于铂类的化疗方案产生耐药,并导致肿瘤复发。因此,寻找安全有效治疗卵巢癌的药物对于提高患者疗效具有重要的意义。薏苡仁油是从薏苡仁的种核中提取的天然成分,含有多种活性物质,如脂类、多糖类、木脂素类、酚类和腺苷等。薏苡仁在传统医学具有利水除湿等作用,而经现代医学发现其具有抗感染、提高免疫力、镇痛以及抗肿瘤等多种药理作用,目前多在胃癌、结肠癌、胰腺癌等领域研究[4]。然而,薏苡仁油对卵巢癌的研究较少且机制尚不清楚。本研究通过以卵巢癌SKOV3细胞为模型,探讨薏苡仁油对其可能的影响及作用机制,为薏苡仁油的临床应用提出理论依据。
1材料与方法
1.1试剂和仪器
噻唑兰(methyl thiazolyl tetrazolium,MTT)试剂(USA,Amresco公司 );IP组织细胞裂解液(上海碧云天);Rabbit Anti-Bax、Bcl-2、Caspase 3、Caspase 8、Caspase 9、P53(USA,cell signaling);辣根过氧化物酶标记山羊抗兔、抗大鼠的第二抗体(USA.Santa Cruz);聚偏二氟乙烯膜(polyvinylidene fluoride,PVDF)(USA.Millipore);半干转膜仪(USA.Bio-Red);MD-100全自动生化仪(USA.MD)。卵巢癌细胞SKOV3源自空军军医大学妇产科实验室,薏苡仁油空军军医大学药剂科实验室赠送。
1.2实验药物的配制
将薏苡仁油化学成分提取物溶解于二甲基亚砜中,根据前期试验,配制终浓度为5μg/mL,经0.45nm滤膜过滤除菌备用。
1.3细胞培养
将人卵巢癌SKOV3细胞常规复苏,接种于含10%新生牛血清,10×104U/L青霉素和100mg/L链霉素得RPMI-1640培养液中,置于37℃,体积分数5% CO2饱和湿度的培养箱中培养。所有细胞株从液氮中取出后进行复苏,置入培养箱中进行培养,待细胞铺满培养瓶中约80%时进行传代,所有细胞常规传代2次,取生长状态良好无污染的细胞株进行后续实验。
1.4 MTT法检测薏苡仁油对SKOV3细胞活性的影响
取生长状态良好的对数生长期SKOV3细胞,胰酶消化后,离心,重悬,细胞计数板计数,调整细胞浓度至5×103个细胞/mL的细胞悬液,接种于96孔板过夜。对照组加入完全培养基,实验组分别加入含有不同浓度薏苡仁油的培养基,终浓度分别为50μg/mL、100μg/mL、200μg/mL、400μg/mL、500μg/mL,每组设6个复孔,分别培养24、48、72h后,加入20μL的5mg/mL的MTT继续培养4h,吸弃培养液,每孔加入150μL的DMSO,酶标仪490nm检测各孔的吸光度(A)值。
1.5 Hoechst33342/PI、AO/EB荧光染色
取细胞浓度为5×103个细胞/mL的细胞悬液,接种于24孔板中,待细胞贴壁汇集80%时,分为对照组和实验组,实验组采用3个不同浓度薏苡仁油进行处理(50μg/mL、100μg/mL、200μg/mL)。继续培养48h,细胞进行Hoechst33342/PI、AO/EB荧光染色。①Hoechst33342/PI染色:向细胞中加入用0.01mol磷酸盐缓冲溶液(phosphate buffered solution,PBS)的Hoechst 33342,终浓度为10μg/mL,37℃反应10min;继续加入用0.01mol PBS溶解的PI,使它的终浓度为10μg/mL,4℃反应20min;直接加入4%多聚甲醛固定液,与培养液按1∶3混合,固定细胞10min;弃上清,50%甘油封片,荧光显微镜下检测并获取照片。②AO/EB荧光染色:向细胞中加入用0.01mol PBS溶解的AO、EB,终浓度为50μg/mL,37℃染色10min;PBS洗脱2次,每次3min。50%甘油封片,荧光显微镜下检测并获取照片。
1.6 DNA琼脂糖凝胶电泳检测
取对生长的细胞接种于培养瓶后收集细胞,1 000r/min离心10min,取沉淀加核裂解液(0.121g Tris,Nacl 0.8766g,EDTA 0.372,SDS 4g,溶至100mL去离子水中,临用前加入蛋白酶K 100μg/mL)1mL,37℃裂解过夜,次日从水浴中取出,加1mL饱和酚抽提,6 000r/min离心5min,取上清液加1mL氯仿:异戊醇(24∶1)抽提,6 000r/min离心5min,取上清加50μL 3mmol/L乙酸钠和2mL冷冻无水乙醇,置液氮中冰冻10min,取出12 000r/min离心10min,弃除上清,沉淀室温放置30min晾干,加50μL TE缓冲液、5μl RNase,37℃水浴30min,加适量上样缓冲液行1.5%琼脂糖电泳检测DNA降解条带。
1.7流式细胞仪检测凋亡
细胞接种于6孔板中,按1.5项下分组实验,实验结束,弃上清,用0.25% Trg消化,分别收集各组细胞于EP管中,以0.1mmol/L PBS(pH7.4)液洗涤1次,离心1 000r/min,5min,弃上清液。用190μL结合缓冲液悬浮细胞,加入5μL Annexin-V-FATC,混匀,避光室温作用10min。再加10μL PI,混匀,避光室温作用10min。补充结合液300μL,1h内上流式细胞仪检测。
1.8细胞总蛋白的提取与测定
蛋白提取:分别取1.7项下各实验组细胞,用磷酸盐缓冲液洗涤两次,吸干后多余水分,加IP组织细胞裂解液,按试剂盒说明书项下制备,混匀,4℃静置30min;然后离心15min,取上清与BCA试剂混合,37℃ 30min,置酶标仪570nm波长处测定组织、细胞吸光度值(A值),按公式计算出总蛋白含量。
1.9蛋白质印迹法分析细胞凋亡相关蛋白的表达
取30mg细胞总蛋白经10% SDS-PAGE凝胶电泳,转移至PVDF膜上,以10%脱脂奶粉封闭后,分别与Caspase 3 (cell signaling,USA,1∶1 000)、Caspase 8(cell signaling,USA,1∶1 000)、Caspase9(cell signaling,USA,1∶1 000)、Bax(cell signaling,USA,1∶1 000)、Bcl-2(cell signaling,USA,1∶1 000)、GAPDH(cell signaling,USA;1∶1 000),4℃孵育过夜,洗涤后再加第二抗体山羊抗兔HRP标记IgG(Santa Cruz,Biotechnology,USA,1∶3 000),37℃杂交70min,化学发光、显影、压片。胶片结果采用Gel-pro Analyzer(Bio-Rad)成像系统进行图像和数据处理,每项检测均采用不同样本重复3次。
1.10 统计学方法
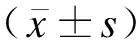
2 结果
2.1 不同浓度薏苡仁油对卵巢癌SKOV3细胞的影响
MTT试验显示不同浓度薏苡仁油(50μg/mL、100μg/mL、200μg/mL、400μg/mL、500μg/mL)分别作用于SKOV3细胞,与对照组比较,薏苡仁油50μg/mL、100μg/mL、200μg/mL作用于SKOV3细胞24h、48h、72h存活率比较差异无统计学意义(t值0.563~1.027,P>0.05)。与对照组相比,400μg/mL和500μg/mL薏苡仁油浓度可在处理后24h、48h和72h显著降低SKOV3细胞存活率(t值4.635~5.231,P<0.05),其作用随着时间的延长而增加,提示高浓度薏苡仁油对SKOV3细胞具有杀伤作用。因此,观察薏苡仁油对SKOV3细胞的凋亡较好浓度选择应为50μg/mL、100μg/mL、200μg/mL,作用时间在48h较好,见表1。
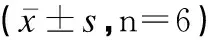
表1 薏苡仁油对不同时间段卵巢癌细胞株SKOV3存活率的影响Table 1 Effect of Coix seed oil on the survival rate of SKOV3 ovarian cancer cells in different
2.2 不同浓度薏苡仁油对卵巢癌SKOV3细胞形态的影响
Hoechst33342/PI染色后,通过荧光显微镜可以观察,对照组细胞呈均匀的蓝色荧光,经薏苡仁油50μg/mL、100μg/mL、200μg/mL作用48h后,随着浓度的增加,凋亡细胞增多,细胞膜与细胞核呈浓缩、致密的强蓝色荧光,出现凋亡小体,表明薏苡仁油可诱导卵巢癌SKOV3细胞凋亡,见图1。AO/EB染色后,通过荧光显微镜可以观察,对照组细胞呈均匀的绿色荧光,经薏苡仁油50μg/mL、100μg/mL、200μg/mL作用48h后,随着浓度的增加,凋亡细胞增多,细胞膜与细胞核呈浓缩、致密的亮黄色荧光,出现凋亡小体,表明薏苡仁油可诱导卵巢癌SKOV3细胞凋亡,见图2。
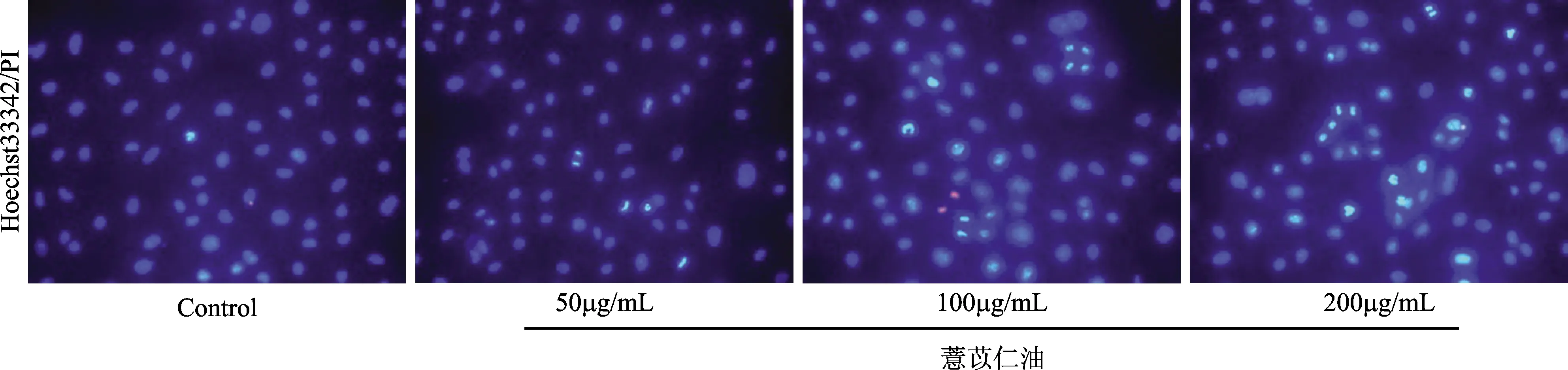
图1 Hoechst33342/PI染色薏苡仁油促进卵巢癌细胞株SKOV3的凋亡Fig.1 Hoechst33342/PI staining of Coix seed oil promoted apoptosis in SKOV3 ovarian cancer cells
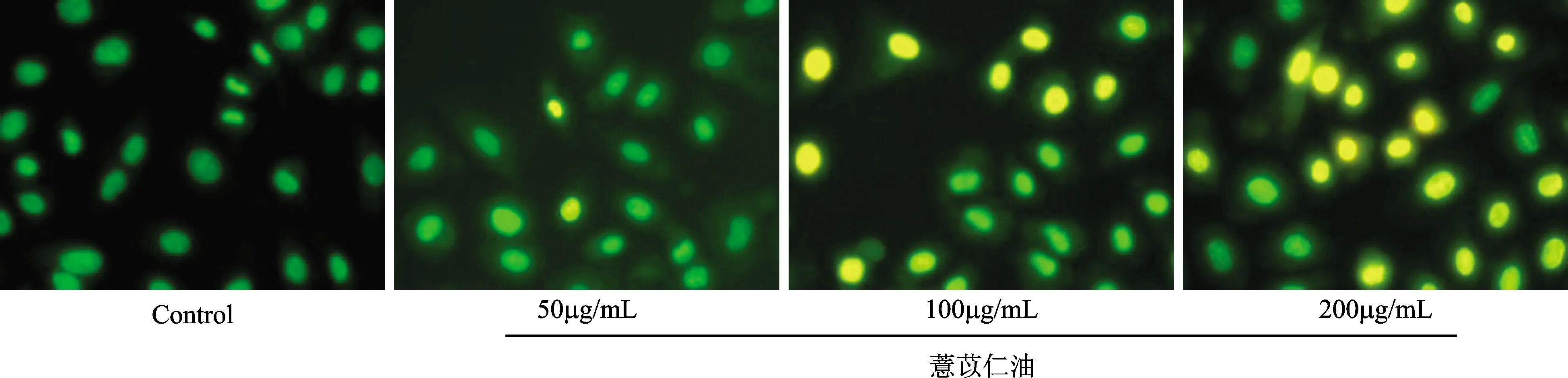
图2 AO/EB染色薏苡仁油促进卵巢癌细胞株SKOV3的凋亡Fig.2 AO/EB staining of Coix seed oil promoted apoptosis in SKOV3 ovarian cancer cells
2.3 DNA琼脂糖凝胶电泳检测卵巢癌SKOV3凋亡的影响
薏苡仁油50μg/mL、100μg/mL、200μg/mL作用于SKOV3细胞48h后,经DNA琼脂糖凝胶电泳后,凋亡细胞的DNA降解形成具有凋亡特征的梯形条带,该条带随着薏苡仁油浓度的增高而增多,而对照组无梯形条带。
2.4 不同浓度薏苡仁油对卵巢癌SKOV3凋亡的影响
不同浓度50μg/mL、100μg/mL、200μg/mL组薏苡仁油作用于SKOV3细胞48h后,与对照组相比较,细胞凋亡均显著增多(t值分别为2.536、3.012、4.908,均P<0.05),其中200μg/mL组细胞总凋亡率高达(27.10±5.42)%,见图4和表2。

图3 SKOV3细胞凋亡DNA凝胶电泳图Fig.3 DNA gel electrophoresis of apoptosis in SKOV3 ovarian cancer cells
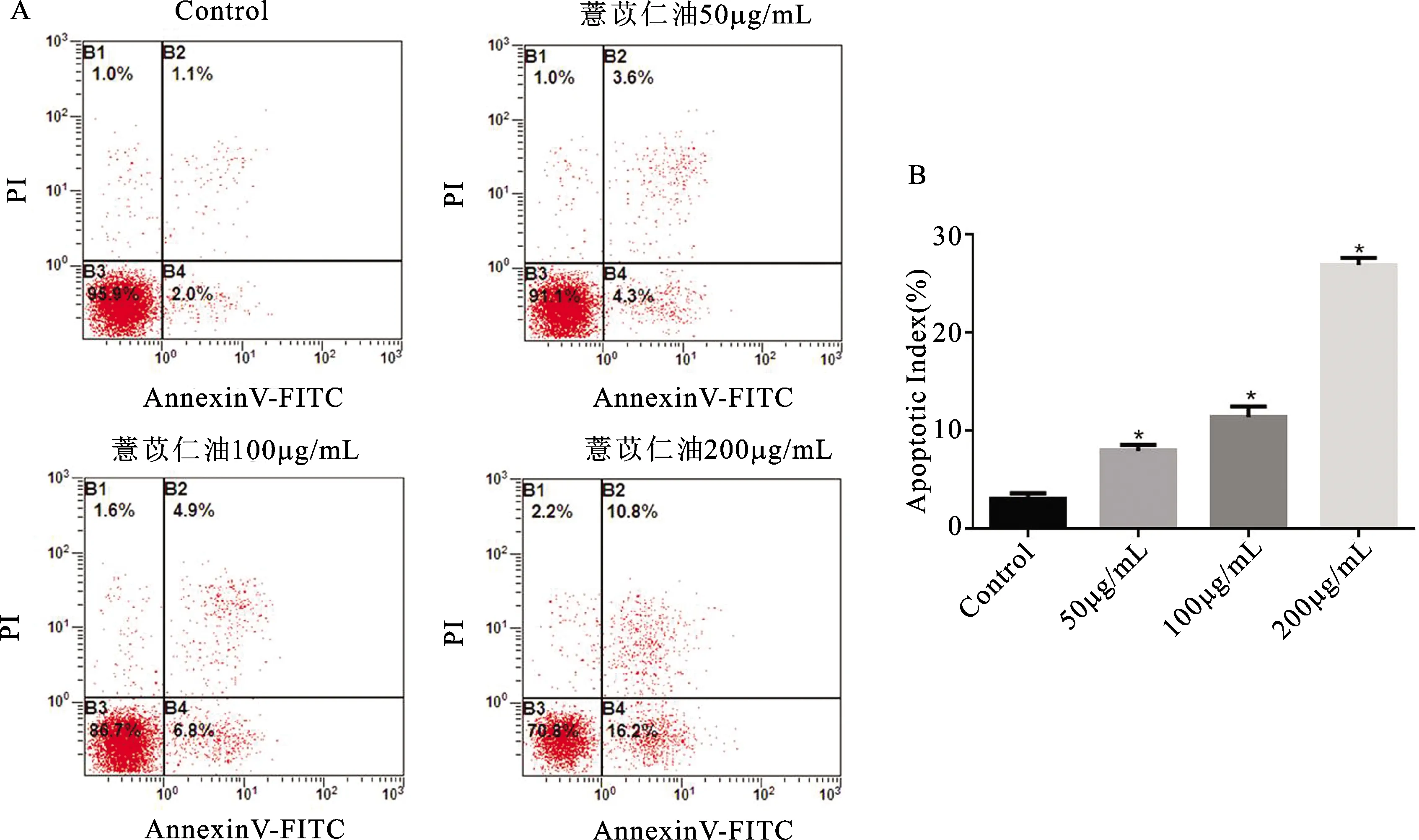
A:流式细胞图显示结果;B:流式细胞术检测定量结果。与对照组比较,*P<0.05。图4 流式细胞术检测不同浓度薏苡仁油对SKOV3细胞凋亡的影响A: flow cytometry results; B: quantitative results detected by flow cytometry.Comparison with control group,*P<0.05Fig.4 Effects of Coix seed oil at different concentrations on apoptosis in SKOV3 cells detected by flow cytometry
表2 不同浓度薏苡仁油对卵巢癌细胞株SKOV3凋亡的影响Table 2 Effects of Coix seed oil at different concentrations on apoptosis in SKOV3 ovarian cancer
2.5 薏苡仁油对卵巢癌SKOV3细胞凋亡基因表达的影响
不同浓度50μg/mL、100μg/mL、200μg/mL组薏苡仁油作用于SKOV3细胞48h后,与对照组相比较,各浓度组Bax、Caspase 3、Caspase 8、Caspase 9蛋白表达均显著增高(t值2.436~5.709,P<0.05),Bcl-2蛋白表达显著下降(t值2.357~4.304,P<0.05),差异均具有统计学意义,见图5。
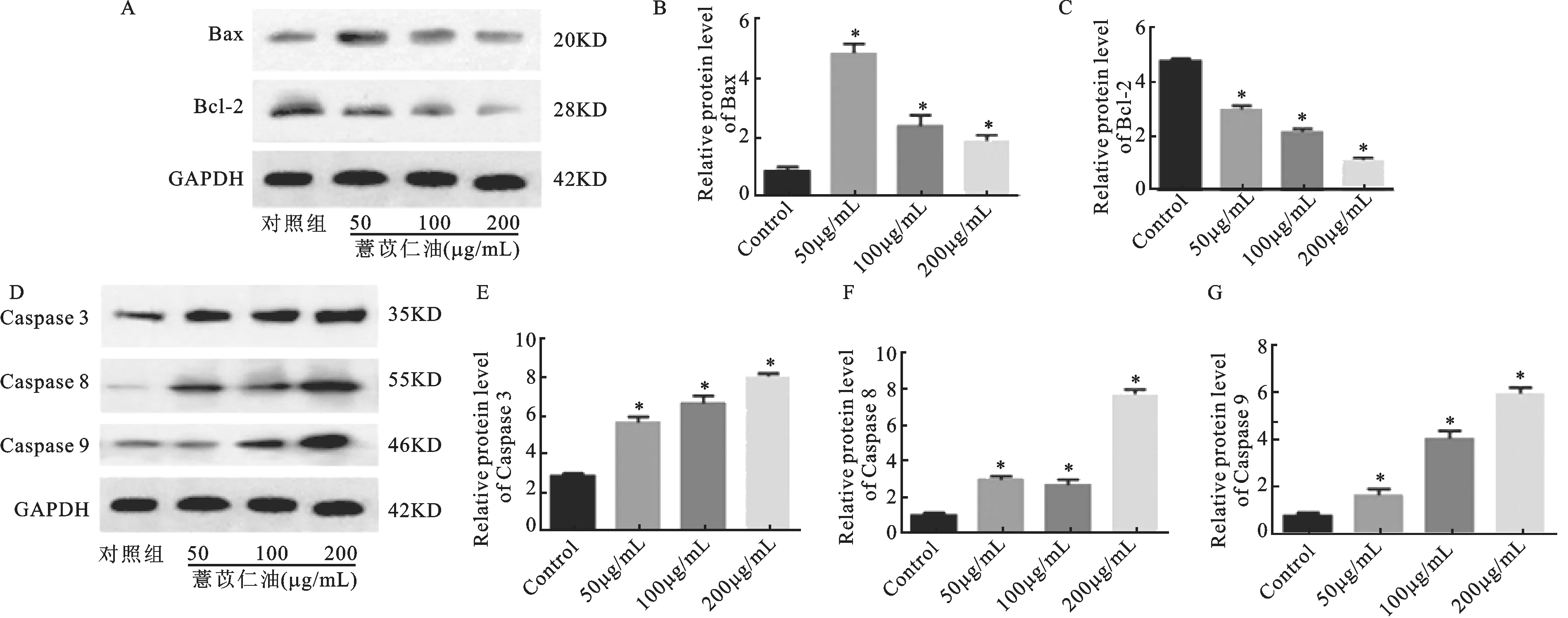
A和D:Western blotting检测结果;B:Bax蛋白相对表达量;C:Bcl-2蛋白相对表达量;E:Caspase 3蛋白相对表达量;F:Caspase 8蛋白相对表达量;G:Caspase 9蛋白相对表达量。与对照组比较,*P<0.05图5 不同浓度薏苡仁油对SKOV3细胞凋亡基因表达的影响A and D:Western blotting detection results;B:relative expression level of Bax protein;C:relative expression level of Bcl-2 protein; E:relative expression level of Caspase 3 protein; F:relative expression level of Caspase 8 protein; G:relative expression of Caspase 9 protein.Comparison with the control group,*P<0.05Fig.5 Effects of Coix seed oil at different concentrations on expression of apoptosis gene in SKOV3 cells
3讨论
3.1 薏苡仁油对肿瘤细胞的影响
卵巢癌早期病变不易发现,晚期缺乏有效的治疗手段,其致死率居妇科恶性肿瘤首位。对于大多数晚期卵巢癌患者,化疗是卵巢癌术后辅助治疗的重要手段,但是化疗耐药性的产生是导致卵巢癌治疗失败的重要原因,故寻找有效的抗癌药物,对提高卵巢癌患者的生存率具有重要意义[5]。薏苡仁油具有广谱的药理活性,如抗肿瘤、抗炎、慢性溃疡、免疫调节、肺水肿等,是具有广阔前景的抗肿瘤药物,目前对薏苡仁油的研究集中在其对于消化系统肿瘤、泌尿系统肿瘤抑制细胞增殖和凋亡的方面。本研究以卵巢癌SKOV3细胞作为研究模型,探讨薏苡仁油对SKOV3细胞的作用及其机制。MTT实验发现随着薏苡仁油作用时间的延长能够显著降低SKOV3细胞存活率,其机制可能与促进卵巢癌SKOV3细胞凋亡或抑制卵巢癌细胞的生长、增殖、转移有关。
3.2 薏苡仁油对卵巢癌SKOV3细胞凋亡的作用
细胞凋亡是通过激活细胞内在的“自杀”机制,导致细胞程序性死亡的方式之一,涉及到多基因表达、激活并受严格调控,细胞凋亡受到抑制会引发肿瘤的形成、转移及其耐药性的产生等。在此基础上,多项研究发现薏苡仁油可通过不同信号通路抑制肿瘤细胞增殖并诱导其凋亡,如在肝癌、食管癌、结肠癌等肿瘤中均有明显的抗癌作用[6]。因此,为了进一步观察薏苡仁油体外诱导SKOV3细胞凋亡,本研究通过Hoechst33342/PI染色和AO/EB染色,发现经不同浓度的薏苡仁油作用后,SKOV3细胞中凋亡细胞增多。进一步通过DNA Ladder检测,可见具有凋亡特征的梯形条带。不同浓度50μg/mL、100μg/mL、200μg/mL组薏苡仁油作用于SKOV3细胞48h后,与对照组相比较,细胞凋亡均显著增多(P<0.05),其中200μg/mL组细胞总凋亡率高达(27.10±5.42)%,以上结果均证实薏苡仁油具有诱导SKOV3细胞凋亡的作用,随着薏苡仁油浓度的增加,细胞凋亡更为明显。
3.3 薏苡仁油对卵巢癌SKOV3细胞凋亡的机制
细胞凋亡有多种途径,Bcl-2家族和Caspase家族是细胞凋亡中的重要组成部分。Bcl-2家族是线粒体凋亡途径的中心环节,包括促凋亡基因和抑制凋亡基因。其中当Bax蛋白以同源二聚体存在时,易于诱发细胞凋亡,Bcl-2可以和Bax等分子形成异源二聚体,从而抑制细胞凋亡[7]。Caspase家族中目前认为细胞凋亡的起始者分别是Caspase 2、8、9、10等,执行者Caspase 多为Caspase 3、6、7等。其中关键分子分别为Caspase 8与Caspase 3[8]。本研究发现,与对照组相比较,50μg/mL、100μg/mL、200μg/mL组薏苡仁油浓度作用于SKOV3细胞48h后,各浓度组Bax、Caspase 3、Caspase 8、Caspase 9蛋白表达均显著增高(P<0.05),Bcl-2蛋白表达显著下降(P<0.05)。通过进一步western blotting实验结果显示随着薏苡仁油的浓度升高,Caspase 3和Caspase 9蛋白表达量均逐渐增加,推测可能与Bcl-2升高在线粒体膜上形成通道蛋白,使线粒体跨膜电位下降,激活Caspase家族酶联反应,从而诱发SKOV3细胞凋亡有关。同时,薏苡仁油Caspase 3的活化进一步促进了Bcl-2/Bax的比值增高,诱发线粒体的凋亡途径[9]。
综上所述,薏苡仁油显著抑制卵巢癌SKOV3细胞的增殖并促进其凋亡,可能与Bcl-2表达降低、Bax和Caspase蛋白表达升高有关。薏苡仁油通过促进凋亡蛋白表达抑制卵巢癌细胞的增殖、浸润与转移,本研究结果将为卵巢癌治疗提供新的方向。
