滇黄精愈伤组织诱导研究
2021-02-11匡双便曾文波田迎秋张月娇高丽芳杨本恒
匡双便 ,张 铁 ,曾文波 ,田迎秋 ,张月娇 ,高丽芳 ,杨本恒
(1.文山学院 三七医药学院,云南 文山 663099;2.文山学院 文山州生物资源开发研究中心,云南 文山 663099;3.文山学院 文山三七研究院,云南 文山 663099)
滇黄精(Polygonatum kingianumColl. et Hemsl.)首载于《植物名实图考》[1],为百合科黄精属多年生草本植物,又名节节高、仙人饭(云南),为中药黄精的3个基原品种(黄精、滇黄精、多花黄精)之一[2],主要分布在云南,是滇西北高海拔地区适生、常见药用植物类群[3],我国广西、贵州、四川部分地区以及国外越南和缅甸也有分布[4-5]。滇黄精是我国传统补益类中药材[6],是集药用价值、食用价值、保健和观赏于一身的植物,经济价值较高,具有广阔的市场开发前景。滇黄精药用和食用部位为根状茎,滇黄精化学成分多样,含有黄精多糖、甾体皂苷、类黄酮等活性物质,还含有生物碱、木脂素类化合物、蒽醌类化合物及多种人体必需的氨基酸和微量元素[7-9],药理活性广泛,具有多种生物活性和保健功能,对滇黄精的各种成分进行提取、分离后,可研制成增强机体免疫功能、抗衰老、降血糖、降血脂、抗疲劳、耐缺氧等作用的功能性药品和保健食品,在临床上用于治疗糖尿病、冠心病、高脂血症、肺结核、淋巴结核、白细胞减少、腹泻、便秘、失眠等多种疾病。另外,滇黄精含有多种天然美容活性成分,具有抗衰老、防辐射、抗炎、抗菌、生发乌发、固齿等美容功能[10]。
近年来,随着经济的发展,生活水平的不断提高,人们越来越重视健康养生,对滇黄精的多种功能也进行了深入的研究,以滇黄精为原料的各种功能的保健食品、药品不断被研制出来,滇黄精的市场需求量急剧上升,人们去山上采挖量剧增,滇黄精野生资源越来越少。滇黄精是云南的道地药材之一,具有比较显著的资源优势,市场开发潜力巨大。因此,开展人工栽培,对缓解野生滇黄精资源采集压力、保持野生滇黄精种质资源的多样性以满足市场的需求具有重大意义。滇黄精有两种传统繁殖方法,一种是通过种子进行繁殖,另一种是通过营养器官进行繁殖。在自然条件下,黄精种子难以收集,播种育苗周期长,从播种到成苗需要1年的时间,且存在出苗率低和后代性状分化严重等问题。根状茎繁殖则存在需要大量黄精繁殖材料、繁殖率低和多次繁殖容易积累病毒以及品种退化等风险。因此,这两种繁殖方法均不利于滇黄精规模化种植。组织培养既能实现快速大量繁殖,又能较好地保持母本优良性状,而且不受季节、环境、取材等因素的制约,是实现滇黄精工厂化育苗和加快良种推广应用的关键技术。
前人对滇黄精的组织培养研究较多,滇黄精的根状茎、叶、花药、嫩芽、种子均可作为外植体[8-11]。但不同的研究人员所选用激素的种类、剂量和组合不一样,并且研究结果也不尽相同。因此,本研究以无菌组培苗的不同器官组织为材料,采用正交试验的方法对愈伤组织诱导培养基进行优化,以提高愈伤组织诱导率及其品质,为滇黄精种苗快速繁育提供依据。
1 材料与方法
1.1 试验材料
以文山学院生物资源开发研究中心实验室保存的滇黄精无菌组培苗作为材料,选用长势良好、大小近似的滇黄精组培苗的嫩叶、叶柄、根状茎进行培养。
1.2 试验方法
1.2.1 培养基配制
以MS培养基为基本培养基,并添加2,4-D、6-BA和KT 等植物生长调节剂,激素质量浓度设置见表1,试验采用L9(33)正交设计。培养基中添加的蔗糖浓度为30 g/L,卡拉胶6.5 g/L,pH调至5.8。

表1 愈伤诱导培养基中6-BA、 KT 和 2,4-D浓度的L9 (33)因素水平
1.2.2 接种方法
选取大小一致、优质的滇黄精组培苗,在超净工作台中将根状茎和叶片切成0.5 cm× 0.5 cm小块、叶柄切成0.6 cm长的小段,分别接种于不同配方的培养基中进行愈伤组织诱导,每组培养基接10瓶,每瓶接种5个外植体,重复3次。每隔15 d观察并记录一次生长情况,并清除污染的材料,培养45 d之后统计愈伤组织数、长势情况等。
愈伤组织诱导率/%=(形成愈伤组织数/接种数)×100%。
1.2.3 培养条件
前4周为暗培养,之后进行光暗交替培养,光照强度为2 500 Lx,光照时间为10 h/d,培养温度为(25±1) ℃。
1.3 统计分析
数据采用Excel和SPSS18.0软件进行相关处理及显著性方差分析。
2 结果与分析
从表2可以得出,在本试验设置的激素浓度中,叶片没有长出愈伤组织,培养15 d后有的有不规则的卷曲(见图1),处理A1B3C3和A2B1C2即MS+6-BA 0.5mg/L+KT 0.5mg/L+2,4-D 1.5mg/L和MS+6-BA 1mg/L+2,4-D 1mg/L培养45 d后叶片仍然是绿色的,和刚接进去时颜色相差不大,其余处理都不同程度地发黄或者褐变;叶柄有部分长出愈伤,但长愈伤的数量不多,有的在培养过程中有一头膨大的,有两头膨大的(见图2);根状茎基本都长出愈伤,CK中没有添加激素诱导出部分愈伤,并且大多数长芽和长根,有激素的处理只长芽,没有长根(见图3~图4)。

表2 不同植物生长调节剂组合对根状茎、叶柄、叶片愈伤组织诱导结果比较
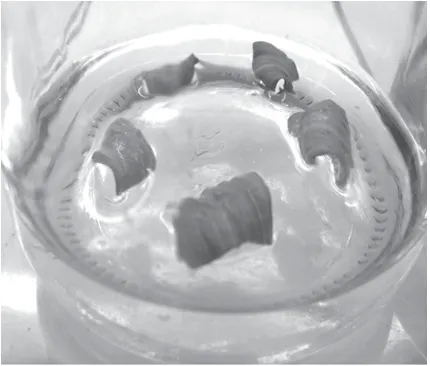
图 1 嫩叶培养15 d后出现不规则卷曲

图 2 叶柄长出愈伤及膨大现象
图 3 添加激素的根状茎长芽不长根
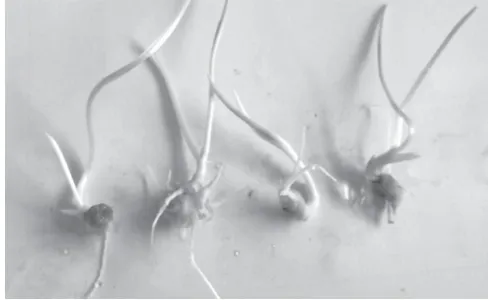
图 4 CK没有添加激素根状茎长芽并且长根
经过培养15 d,滇黄精叶柄开始长出愈伤,并且随时间的延长,愈伤组织进一步增多。45 d后统计各处理的愈伤生长情况并进行评价,结果见表3。直观分析结果显示,影响滇黄精叶柄愈伤组织因素的主次顺序为:B(KT) > C(2,4-D) > A(6-BA),滇黄精叶柄愈伤组织诱导最好的为A3B2C1,即MS+6-BA 1.5 mg/L+ KT 0.25 mg/L+2,4-D 0.5 mg/L,诱导率达28.9%,且愈伤组织质量最好。A3B2C1愈伤诱导率与其余处理差异性显著,其次为A1B2C2和A2B1C2愈伤组织诱导率为17.8%,显著高于对照,其他处理水平与CK相比差异不显著。

表3 植物生长调节剂对滇黄精叶柄愈伤组织诱导的影响
经过培养15 d,滇黄精根状茎开始长出愈伤,并且随时间的延长,愈伤组织进一步增多。45 d后统计各处理的愈伤生长情况进行评价,结果见表4。直观分析结果显示,影响滇黄精块根愈伤组织因素的主次顺序为:B(KT) > C(2,4-D) > A(6-BA),滇黄精块根愈伤组织诱导最好的为A2B1C2,即MS+6-BA 1.5 mg/L+ 2,4-D 1 mg/L,诱导率达93.3%,且愈伤组织质量最好(见图5);其次为A1B3C3即MS+6-BA 0.5 mg/L+ KT 0.5 mg/L+2,4-D 1.5 mg/L诱导率达88.9%,并且与对照相比差异都非常显著。

表4 植物生长调节剂对滇黄精根状茎愈伤组织诱导的影响

图 5 培养基A2B1C2根状茎愈伤组织
3 讨论与结论
有研究表明,滇黄精的根状茎、叶、花药、根茎、嫩芽、种子均可作为外植体[11-14],但诱导出愈伤组织的难易程度不同。李莺等研究发现,黄精根茎及地上嫩茎较叶片更容易诱导产生愈伤组织,而叶片不适宜诱导愈伤组织[15];裴莉昕等的研究表明,黄精嫩叶为诱导愈伤组织的最佳外植体[16];杨玉红的研究则表明,叶片和地上茎没有诱导出愈伤组织,只有根状茎诱导产生了愈伤组织[17]。本研究中以滇黄精无菌组培苗的根状茎、叶柄和嫩叶作为外植体进行愈伤组织诱导,诱导愈伤组织的最佳的外植体为根状茎,其次为叶柄,嫩叶没有诱导出愈伤组织,研究结果和李莺和杨玉红等人的结果相似。
有研究表明,6-BA对黄精愈伤组织生长有显著效果,2,4 -D、NAA 和KT 效果不显著:林海和郝慧敏的研究表明,培养基MS +6-BA 1.0 mg/L +NAA 0.25 mg/L +KT 3 mg/L +2,4-D 0.25 mg/L为诱导黄精愈伤组织的最适合的培养基[18];杨红玉则发现MS +2,4-D 3.0 mg/L+ 6-BA 1.0 mg/L + NAA 0.5 mg/L + KT 0.25 mg/L为诱导黄精愈伤组织的最适培养基[17];万学锋等认为6-BA比其他细胞分裂素更有利于多花黄精的分化[19]。叶心雨等的研究表明,KT对多花黄精愈伤组织的诱导有显著影响,6-BA对多花黄精愈伤组织的诱导作用不显著,但6-BA与2,4-D等生长调节剂配合使用有一定的促进效果[20]。徐红梅将多花黄精茎尖切片在MS+BA1 mg/L + 2,4-D 0.5 mg/L培养基下诱导产生愈伤组织,愈伤组织分化后产生新植株[21]。陈松树等[22]以多花黄精的叶片为外植体,得出愈伤组织诱导最适培养基为:MS+6-BA 3.0 mg/L+NAA 4.0 mg/L+蔗糖20 g/L。本研究中根状茎和叶柄诱导愈伤组织的最适培养基与前人的研究结果存在较大差异,且不同器官最适合的配方也不同,由于不同种类的外植体基因型、生长环境、分化程度、生理状态、内源激素含量等差异,可能导致愈伤组织诱导所需植物生长调节剂种类、浓度及组合存在较大差异,且后续的器官发生对同一植物生长调节剂的反应是不同的。
本研究结果表明:诱导出愈率依次为根状茎>叶柄>叶片;激素因素的主次顺序为:B(KT) > C(2,4-D) > A(6-BA);最适宜滇黄精根状茎愈伤组织诱导的培养基为:MS+6-BA 1.5 mg/L+2,4-D 1mg/L,诱导率达93.3%,且愈伤组织质量最好;滇黄精叶柄愈伤组织诱导最适宜的培养基为MS+2,4-D 0.5 mg/L+6-BA 1.5 mg/L+ KT 0.25mg/L,诱导率达28.9%,且愈伤组织质量最好。
