体外循环在经导管主动脉瓣置换术中的应用策略
2021-02-10任培军程兆云杨雷一李建朝
任培军 王 圣 程兆云 杨雷一 李建朝
经导管主动脉瓣置换术(transcatheter aortic valve implantation,TAVI)因创伤小、无须胸骨切开、无须心脏停搏成为传统外科手术禁忌或高危、预期寿命大于1年、症状性钙化性重度主动脉瓣狭窄或关闭不全患者的首选治疗方法,在老年钙化性主动脉瓣病变患者中的应用越来越广泛[1~3]。经导管主动脉瓣置换术术中可能出现严重出血、室颤、心脏结构及传导系统损伤、主动脉根部或瓣环撕裂、瓣周漏或瓣膜错位、冠状动脉堵塞或缺血、外周血管损伤、心包填塞等危及生命的意外或并发症[4~6]。体外循环(cardiopulmonary bypass,CPB)是体外生命支持的重要手段,应用在经导管主动脉瓣置换术中可为患者保驾护航,特别是发生意外情况或并发症时,在挽救患者生命中发挥重要作用[6,7]。现回顾性分析我院经导管主动脉瓣置换术中应用体外循环的病例情况及经验,探讨体外循环在经导管主动脉瓣置换术中的应用策略。
1.资料和方法
1.1 一般资料 本研究收集2018年1月至2021年1月在我院行经导管主动脉瓣置换术的高龄老年退行性主动脉瓣病变患者96例,所有患者术前完成检查,包括心脏超声、胸腹主动脉及冠状动脉全程血管扫描成像、头颅核磁共振脑血管成像及肺功能、动态心电图等,经多学科心脏团队讨论制定手术方案及应急预案。入选标准[7]:①老年性退行性主动脉瓣钙化狭窄或关闭不全,或主动脉瓣重度反流;②患者有明显症状,如胸痛、呼吸困难或晕厥史等,NYHA心功能分级≥Ⅱ级;③STS死亡率评分<20%、EuroSCORE<40%,且预期生存期超过1年;④患者传统外科手术风险为禁忌或高危(预期术后30d内死亡或发生不可逆合并症风险大于50%,STS评分≥8分)。其中6例在体外循环辅助下完成手术:男性2例,女性4例,年龄70~84岁,平均(75.6±5.2)岁;均为极重度主动脉瓣狭窄,开口面积0.29~0.58cm2,平均(0.39±0.10)cm2,跨瓣压差69~106mmHg,平均(85.6±12.7)mmHg;合并主动脉瓣二瓣化畸形2例;心功能NYHA分级Ⅱ~Ⅳ级。
1.2 手术过程 所有患者入杂交手术室(见图1),均采用全身麻醉,气管插管,右侧颈内静脉置管用作深静脉置管及临时心内起搏器植入入路,左桡动脉有创血压监测,置入经食道超声(Transesophageal echocardiography,TEE)探头。常规监测脑电双频指数(Bispectral index,BIS)监测及近红外光谱监测(Near infrared spectroscopy,NIRS),安置体外除颤电极。
图1 杂交手术室,体外循环机器及管道位置
病例1,女性,73岁,以“活动后胸闷气短2年余,加重伴头晕7天”为主诉入院。经胸心脏超声:左室射血分数LVEF 49%,主动脉瓣二瓣化畸形,开口面积0.58cm2,瓣上流速4.8m/s,平均跨瓣压差69mmHg。术前诊断:①心脏瓣膜病:主动脉瓣重度狭窄伴轻度关闭不全,二尖瓣中度关闭不全,三尖瓣中度关闭不全;②轻度肺动脉高压;③高血压2级;④冠心病,PCI术后;⑤NYHA心功能Ⅱ级。2018年6月12日,行经导管主动脉瓣置换术手术,体外循环干备。瓣膜释放顺利,超声及造影示瓣膜位置良好,退出鞘管后突发血压下降,由112/68mmHg快速下降至62/35mmHg,此时中心静脉压由8mmH2O下降至3mmH2O,麻醉医生由中心静脉快速补液,同时行外周血管造影,提示髂动脉破裂。迅速启动紧急体外循环,体外循环人员快速预充排气,麻醉医生维持血压,外科医生迅速游离左侧股动静脉并插管,12min后体外循环开始,行髂动脉修补术。体外循环转流时间175min,共输注浓缩红细胞1000ml。患者入重症监护室后3d未醒,行头颅CT检查并神经内科会诊考虑缺血缺氧性脑病,家属放弃治疗自动出院。
病例2,女性,84岁,以“活动后心前区疼痛1年,加重伴胸闷气短1月”为主诉入院。术前经胸超声:LVEF36%,主动脉瓣开口面积0.46cm2,瓣上流速4.9m/s,平均跨瓣压差72mmHg。术前诊断:①心脏瓣膜病:主动脉瓣重度狭窄伴轻-中度关闭不全,二尖瓣中度关闭不全,三尖瓣重度关闭不全;②中度肺动脉高压;③心律失常:持续性心房颤动;④冠心病,CABG术后;⑤心功能Ⅲ~Ⅳ级;⑥慢性肾功能不全。2019年1月16日行经导管主动脉瓣置换术手术,体外循环湿备,管道未上台。术前游离双侧股动静脉备用,未预置股动静脉荷包。瓣膜释放停起搏后室颤,除颤3次无效,双人交替持续有效心脏按压,平均压维持在65mmHg以上,紧急启动体外循环辅助,8min后开始体外循环。体外循环辅助60min,调整停机困难,TEE提示心室壁收缩功能普遍减低,转ECMO辅助。转入重症监护室,ECMO辅助15d,心脏超声提示心肌收缩力差,ECMO减流量无法维持循环。家属放弃治疗自动出院。
病例3,男性,71岁,以“活动后心慌、气短半年,加重1周”为主诉入院,经胸心脏超声示:LVEF38%,主动脉瓣开口面积0.42cm2,瓣上流速5.2m/s,平均跨瓣压差78mmHg。术前诊断:①心脏瓣膜病:主动脉瓣重度狭窄,二尖瓣中度关闭不全,三尖瓣中度关闭不全;②中度肺动脉高压;③心功能Ⅲ级;④慢性肾功能不全;⑤慢性阻塞性肺疾病。2019年8月2日行经导管主动脉瓣置换术手术,术前游离双侧股动静脉,预置荷包缝线,体外循环湿备,管道上台,球囊前扩停起搏后血压缓慢上升至75/46mmHg,给予血管活性药物调整后血压118/72mmHg,稳定后再次起搏释放瓣膜,停起搏后出现室颤,除颤3次,未复律,紧急股动静脉插管进行体外循环转流,造影及TEE均提示大量瓣周漏,再次球囊后扩,重复造影瓣周漏未减少,心脏团队商议后决定转胸骨上段小切口主动脉瓣置换术,术后经食道超声未见瓣周漏。转重症监护室,术后15d顺利出院。
病例4与病例5,均为女性,分别为70岁与84岁,经胸心脏超声示:LVEF 26%与20%,主动脉瓣开口面积0.38cm2与0.29cm2,瓣上流速4.6m/s与5.1m/s,平均跨瓣压差93mmHg与106mmHg。NYHA心功能分级均为Ⅳ级。心脏团队讨论后决定2020年9月10日行体外循环辅助下经导管主动脉瓣置换术手术。先以低流量(1.0~1.5L/min)辅助开始,导丝跨瓣的过程中减少体外循环引流,保持左心室射血并促进导丝通过狭窄的主动脉瓣,在快速起搏时尽量降低流量,引空心脏,以减少室颤发生,待人工瓣膜释放满意、位置及功能良好后缓慢调整降低辅助流量,逐渐停止体外循环。体外循环转流时间分别为40min与51min。患者均顺利出院。
病例6,男性,75岁,以“活动后胸闷3月余”为主诉入院,经胸心脏超声示:LVEF40%,主动脉瓣开口面积0.5cm2,瓣上流速4.8m/s,平均跨瓣压差88mmHg。术前诊断:①心脏瓣膜病:主动脉瓣重度狭窄伴中度关闭不全,二尖瓣中度关闭不全,三尖瓣轻度关闭不全;②心律失常:频发室性早搏;③心功能Ⅱ级;③慢性阻塞性肺疾病;④慢性肾功能不全。2021年5月10日行经导管主动脉瓣置换术手术。体外循环湿备,管道上台,股动静脉置管并与体外循环管道连接好,管道钳暂时钳夹管道。导丝跨瓣及球囊前扩张顺利,释放瓣膜后出现瓣膜滑脱至左心室,心脏团队快速商讨后行主动脉瓣置换术,遂快速松开管道钳进行体外循环转流,正中开胸,阻断升主动脉,心脏停搏,取出滑脱的主动脉瓣并行主动脉瓣置换术。体外循环转流时间111min,阻断70min。患者顺利出院。
2.结果
经导管主动脉瓣置换术手术中应用体外循环6例,应用比例为6.25%,2例为预防性应用,4例为挽救性应用,其中死亡2例(33.33%)。96例患者围术期共死亡4例,总体死亡率为4.16%,其中转正中开胸外科主动脉瓣置换2例,EC
MO辅助1例。体外循环准备时间、体外循环转流时间、主动脉阻断时间、呼吸机辅助时间、ICU停留时间、术后住院时间及转归等情况,见表1。
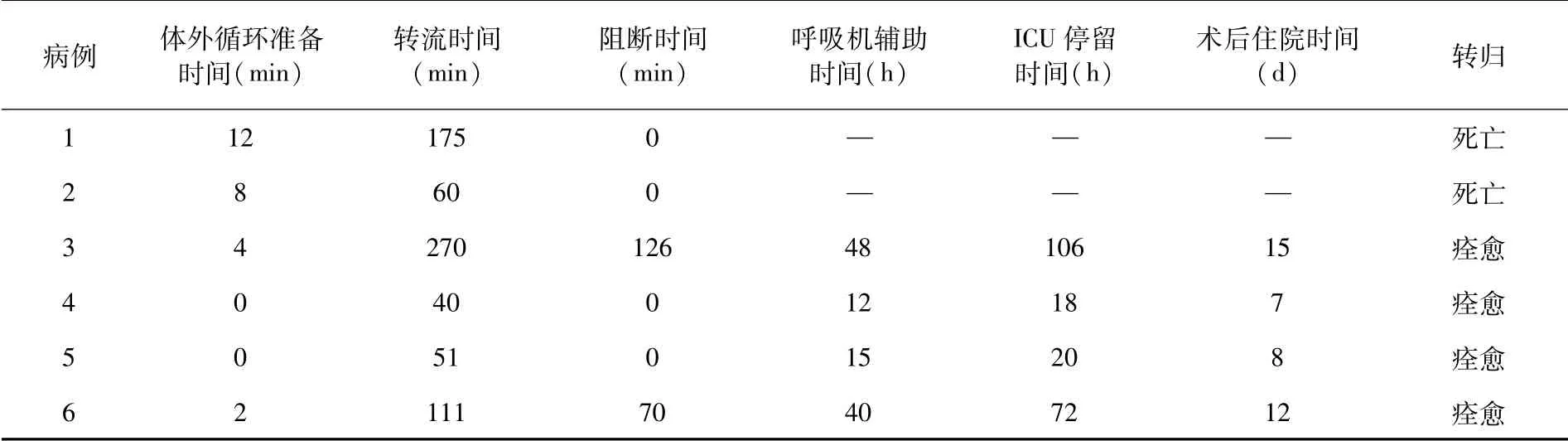
表1 6例患者术中体外循环及术后情况
3.讨论
经导管主动脉瓣置换术提高了高危老年钙化性主动脉瓣病变患者的生存率,作为微创介入手术,与冠状动脉支架植入术相似,有中转外科开胸手术的风险。一项荟萃分析显示不同心脏中心经导管主动脉瓣置换术患者围术期死亡率为0.9%~16.9%[8,9],一旦中转挽救性体外循环其危险性及围术期死亡率显著增高。欧洲经导管主动脉瓣置换术注册登记研究显示[10],27760例接受经导管主动脉瓣置换术手术的患者,中转体外循环下主动脉瓣置换术的比例为0.76%,其意外及并发症更难预测、更凶险,死亡率高达34.6%,术后72h与1年死亡率分别为46%与78%。我院中转体外循环患者手术死亡率为33.3%,远高于围术期总体死亡率4.16%。
从以下方面改进可减少经导管主动脉瓣置换术风险并降低挽救性体外循环并发症及死亡率[11~14]:①完善的经导管主动脉瓣置换术手术方案及应急预案。对于低左心室射血分数、小左心室腔、频发室性心律失常等高危患者术中的球囊扩张及强制性快速心室起搏等操作对血流动力学影响较大,可能导致循环崩溃或恶性心律失常。建议对于冠状动脉开口较低或严重肺动脉高压患者,应将体外循环管道置于手术台上,以节省发生并发症的救治时间;对于左室功能明显下降(LVEF<25%)或房室瓣严重返流的患者,可预防性股动脉插管而不启动体外循环,一旦发生血流动力学不稳定(大剂量血管活性药难以维持),只需松开管道钳夹钳,即可在1s内启动心肺机;左室功能较差(LVEF≤20%)、心源性休克和右室扩张的右心衰失代偿的患者可在体外循环转流下行经导管主动脉瓣置换术手术。②预防性体外循环辅助下经导管主动脉瓣置换术可提高手术成功率。对于挽救性紧急体外循环,缺乏协调、不必要的延迟复苏和整体混乱等对救治时效的影响很大,模拟训练就显得尤为重要。一旦紧急启动体外循环,需要心脏团队成员快速反应,最大限度减少应答时间,各司其职。在这种紧张的环境下团队合作和协调、消除团队成员角色的混乱、固定一名指挥人员、限制房间里的人数有助于将混乱保持在最低限度,团队成员保持清晰、简洁的沟通,保证挽救性体外循环可以在5min内快速启动。上述2例死亡病例的突出特点是均为我们团队救治的初期病例、紧急中转体外循环,团队经验相对不足,体外循环转流准备时间偏长。③管道上台后,提前调整好体外循环机器及台上管道位置,C臂前后移动过程中保证管道不绷紧、拉扯,防止插管及管道脱落等重大体外循环意外发生(见图1)。一旦出现除颤无效的室颤,应在保证有效心肺复苏的同时立即按照紧急体外循环流程迅速启动体外循环,辅助循环时鼻咽温降至35℃左右,同时应用冰帽及颈部包裹冰块实现脑部迅速降温,平均灌注压力维持在65mmHg以上,红细胞比容24%以上。
对于机械辅助下经导管主动脉瓣置换术,建议首选体外循环。体外循环与ECMO比较其优势在于:外科医生对体外循环操作流程相对娴熟,针对突发情况可快速做出分析及给予应对措施,体外循环可迅速中转外科正中开胸行主动脉瓣置换术,灵活性大。若体外循环停机困难可转为ECMO辅助,费用低;一旦术中出现突发情况,建议尽早启动体外循环。
