细胞穿膜肽M918偶联抗体的表达纯化及其内吞效率研究
2021-02-10李雪李俊敏张雷李杉
李雪 李俊敏 张雷 李杉
(华南理工大学生物科学与工程学院,广州 510006)
细胞穿膜肽(cell-penetrating peptides,CPPs)是一类由5-30个氨基酸组成可以穿透生物膜的短肽。CPPs可携带各种外源物质将其递送到细胞内[1-2],与其他递送方式相比,这种有效的转运系统不受细胞类型的影响,能够与生物活性蛋白融合表达,具有较低的细胞毒性且在完成外源物质的递送后可降解[3],近年来,在药物递送系统中得到广泛的应用[4]。穿膜肽M918衍生自抑癌蛋白p14ARF,由22个氨基 酸(MVTVLFRRLRLRIRRACGPPRVRV) 组 成,其中含有7个带正电荷的氨基酸,属于阳离子CPP。M918在高浓度条件下仍不具有细胞毒性,并且可以有效的将大分子外源物质(蛋白质和肽核酸)以共价结合物或非共价复合物的形式递送到动植物细胞中[5]。与大多数CPP相似,M918的穿膜机制主要为能量依赖的内吞机制,尤其是巨胞饮作用,不同的是M918的内吞不依赖于细胞表面的糖胺聚糖[6]。
近年来,靶向治疗受到越来越多的关注。单链抗体(single chain antibody,scFv)分子量低(约28 kD),结构简单,易于合成,免疫原性低,广泛的应用于靶向递送载体[7]。然而,由于大多数抗癌抗体及其衍生物在肿瘤组织中的渗透性较差,其递送效率受到严重的限制[8],因此需要寻找一种新的靶向递送至肿瘤组织的方法。
在本研究中,将穿膜肽M918与靶向人表皮生长因子受体2(human epidermal growth factor receptor-2,HER2)的scFv偶联,经过纯化得到重组蛋白M918-scFv,通过微量热泳动(microscale thermophoresis,MST)技术和流式细胞仪检测M918-scFv与HER2抗原的亲和能力及内吞效率。旨在探索一种靶向递送的新思路。
1 材料与方法
1.1 材料
1.1.1 实验材料 PET-28b质粒由本实验室保存,PET-28b-scFv-EGFP质粒由本实验室构建、保存。穿膜肽M918基因序列由广州天一辉远基因科技有限公司合成。分子克隆所用的菌株为大肠杆菌DH5α感受态(TreliefTM5α Chemically Competent Cell,擎科生物科技有限公司,中国),表达重组蛋白所用的菌株为大肠杆菌BL21(DE3)感受态(BL21(DE3)Chemically Competent Cell,天根生化科技有限公司,中国)。HER2阳性乳腺癌细胞SK-BR-3,BT474及HER2阴性乳腺癌细胞MCF-7购于中科院上海细胞库。
1.1.2 主要仪器 Fusion Solo S化学发光成像系统(Vilber,法国);BioLogic LP低压层析仪(BIO-RAD,美 国 );T100TMThermal Cycler PCR仪(BIO-RAD,美国);SK-ⅡD超声波细胞破碎仪(宁波欧蓝,中国);Accuri C6 plus 分析型流式细胞仪(BD,美国);MO NT.115相互作用分析仪(Nano Temper,德国);激光共聚焦显微镜(ZEISS,美国)。
1.2 方法
1.2.1 重组PET-28b-M918-scFv-EGFP质粒的构建 根据M918和scFv-EGFP的基因序列,用Premier 5软件设计基因扩增所需的引物(表1),由广州天一辉远基因科技有限公司合成。利用overlap PCR技术将基因片段M918与scFv-EGFP连接,以获得M918-scFv-EGFP基因片段。PCR产物回收后,用限制性核酸内切酶Nde Ⅰ和Hind Ⅲ分别双酶切PET-28b质粒和纯化回收后的M918-scFv-EGFP基因,酶切产物回收后用T4连接酶进行连接,并将连接产物用化学转化法转化到大肠杆菌DH5α感受态中,在卡那霉素抗性(终浓度为50 μg/mL)的LB固体培养基上培养过夜。挑选阳性转化子用通用引物进行菌落PCR鉴定并送天一辉远基因公司测序进行更进一步的验证,保存测序结果与目的基因比对正确的质粒并命名为PET-28b-M918-scFv-EGFP。

表1 扩增M918-scFv基因片段所需引物Table 1 Primers used to amplify M918-scFv
1.2.2 重组蛋白M918-scFv的表达、纯化 将上一步中测序结果正确的PET-28b-M918-scFv-EGFP质粒转化到大肠杆菌BL21(DE3)感受态细胞中,并接种于卡那抗性的LB液体培养基中,37℃ 220 r/min培养过夜作为种子液。按1∶100的比例转接种子液并培养至OD600≈1.5,向各组培养液中分别加入终浓度为300、500、800、1 000 μmol/L的异丙基硫代半乳糖苷(Isopropyl β-D-Thiogalactoside,IPTG)诱导蛋白表达,16℃ 130 r/min诱导过夜。比较在IPTG浓度不同时,重组蛋白M918-scFv-EGFP的表达情况,筛选出诱导M918-scFv-EGFP表达的最适IPTG浓度。用筛选出的最适IPTG浓度诱导重组蛋白大量表达,诱导结束后4℃ 6 700 r/min离心20 min 收集菌体,菌体沉淀可于-20℃保存。
用镍亲和层析纯化重组蛋白M918-scFv-EGFP。向收集到的菌体中加入适量的裂解缓冲液(500 mmol/L NaCl,20 mmol/L磷酸钠,20 mmol/L咪唑和2%(V/V)Tween-20,pH 6.8)充分重悬菌体,冰上超声破碎菌体(变幅杆Φ6、功率50%,超声1 s开、1 s关,40 min)。超声破碎结束后,4℃ 6 700 r/min离心30 min收集上清。将上清加载到预先用结合缓冲液(500 mmol/L NaCl,20 mmol/L磷酸钠,20 mmol/L咪唑,pH 6.8)平衡好的Ni-NTA(Cytiva)上,缓慢梯度洗脱(20 mmol/L磷酸钠,0.5-1 mol/L NaCl,20-500 mmol/L咪唑,pH 6.8)目的蛋白。用SDS-PAGE检测纯化后的蛋白。纯化得到的蛋白经1×PBS透析和PEG-20000浓缩后,用BSA试剂盒测定蛋白浓度,Western Blot对获得的蛋白进行进一步的鉴定。
1.2.3 细胞培养 SK-BR-3和MCF-7细胞均置于含1%青链霉素混合液和10%胎牛血清的DEME高糖培养基中,BT474细胞置于含1%青链霉素混合液和10%胎牛血清的1640培养基中,在5% CO2,37℃的细胞培养箱中培养。待细胞增殖到适宜密度后进行扩大培养并进行试验。
1.2.4 HER2抗原结合实验 用Monolith NT.115仪通过MST技术评估纯化得到的scFv和M918-scFv与HER2抗原的结合能力。因为重组蛋白本身带有绿色荧光蛋白,因此仪器可根据GFP的荧光信号,检测抗原与重组蛋白scFv、M918-scFv结合后热泳信号的变化。用MST缓冲液(20 mmol/L 磷酸钠,50%(m/V)BSA,0.05%(V/V)Tween-20,pH 7.4) 配置100 nmol/L的scFv和M918-scFv溶液。将HER2抗原从400 nmol/L开始进行半倍稀释成16个梯度,与等体积的重组蛋白混合均匀并转移至毛细管中。将毛细管置于仪器中,在蓝光激发,LED power 20%的条件下进行测试。
1.2.5 内吞效率检测 用流式细胞仪检测细胞表面平均荧光强度(mean fluorescence intensity,MFI)。将处于对数生长期的细胞,以5×105个/mL的密度接种于6孔板中,各接种两板。37℃ 5% CO2培养24 h。分别向每孔中加入60 μg重组蛋白scFv和M918-scFv,并设置未加蛋白的孔做空白对照,4℃培养1 h。培养结束后,用提前预冷的1×PBS清洗。清洗结束后,各取一板细胞用流式细胞仪检测其细胞表明MFI,另一组细胞37℃继续培养2 h。培养结束后,用流式细胞仪检测其表面MFI,即可根据公式计算出重组蛋白的内吞效率[9]。
内吞(%)=(4℃表面总 MFI-37℃表面总MFI)/(4℃表面总 MFI)×100 %
用激光共聚焦显微镜观察M918-scFv的内吞。将3种细胞按5×103个/mL的密度接种在激光共聚焦皿中 37℃培养 24 h。加入 500 μL 5 μg/mL 的Hoechst 33342室温孵育30 min,孵育结束后用提前预热的培养基洗3次。再用过量的scFv和M918-scFv处理细胞,4、37℃孵育结束后,用激光共聚焦观察细胞。
1.2.6 数据分析 所有数据均进行3次独立重复实验,结果以平均值和标准偏差表示。用软件GraphPad Prism 7.0分析数据,使用软件中单边t检验,检验实验不同组之间的显著性差异,其中P<0.05认为差异有统计学意义,P<0.01认为差异有显著统计学意义。
2 结果
2.1 PET-28b-M918-scFv-EGFP表达载体的构建
通过overlap PCR将穿膜肽M918基因片段与scFv基因片段连接,琼脂糖凝胶电泳结果如图1-A所示,目的片段在1 500 bp处,与M918-scFv分子量(约1.58 kb)大小相符,说明目的基因M918-scFv扩增成功。经双酶切、连接、转化后挑选适量个数的阳性转化子做菌落PCR,以验证载体构建结果。如图1-B所示,菌落PCR片段与预期值相符,测序结果与目的基因序列一致,说明PET-28b-M918-scFv-EGFP表达载体构建成功。

图1 重组质粒PET-28b-M918-scFv-EGFP的构建Fig.1 Construction of recombinant plasmid PET-28b-M918-scFv-EGFP
2.2 M918-scFv蛋白的纯化
用Western Blot检测(anti-His tag 抗体)优化诱导剂浓度结果如图2-A 所示,重组蛋白M918-scFv在上清和沉淀中均有表达,随着IPTG浓度的增加,目的蛋白的总表达量也会相应的提高,但上清中目的蛋白的含量呈先升高后降低的趋势,当IPTG浓度为800 μmol/L时,目的蛋白在上清中的表达量最高。
用筛选出的最适IPTG浓度诱导重组蛋白大量表达,并通过Ni-NTA进行纯化。在梯度洗脱过程中,在20% Buffer B洗脱时有目的蛋白(分子量约为57 kD)被洗脱下来,40% Buffer B洗脱时目的蛋白被大量洗脱,但此时杂蛋白较多。随着洗脱的继续进行,杂蛋白含量逐渐减少,此时目的蛋白纯度较高(图2-B)。

图2 重组蛋白M918-scFv-EGFP的纯化Fig.2 Purification of recombinant protein M918-scFv
将收集的60% Buffer B至100% Buffer B洗脱的重组蛋白,在含20%(V/V)丙三醇的1×PBS中透析24 h,用PEG-20000和超滤管浓缩蛋白,结果如图3所示。用BCA试剂盒测定重组蛋白M918-scFv的浓度为537.6 μg/mL;用软件Image J进行灰度值分析,蛋白纯度为90.5%,符合后续生物学活性验证标准。

图3 Western Blot鉴定纯化后的重组蛋白M918-scFFig.3 Identification of the purified recombinant protein M918-scFv by Western Blot
2.3 scFv、M918-scFv与HER2抗原的相互作用
scFv和M918-scFv与HER2抗原的结合解离常数Kd拟合曲线如图所示4,HER2抗原与scFv、M918-scFv的 Kd值 分 别 为(8.26±2.51)×10-9mol/L和(8.41±1.58)×10-9mol/L,且信噪比均大于5。scFv和CPP-scFv的Kd值都在10-9这一数量级,说明M918-scFv偶联穿膜肽后并不会影响scFv与Her2抗原的结合,M918-scFv保留了scFv特异性靶向HER2的能力。
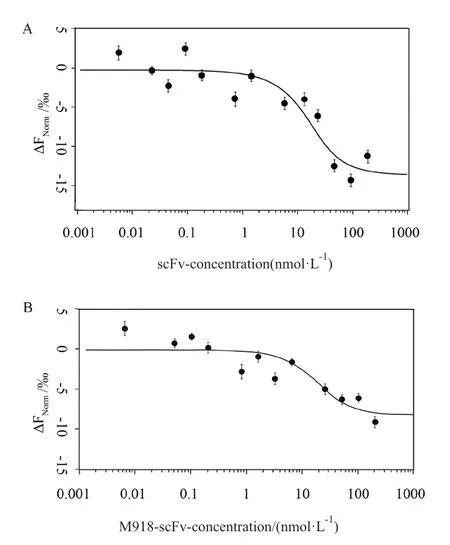
图4 scFv(A)和M918-scFv(B)与HER2抗原的结合曲线Fig 4 Binding curve of scFv(A)and M918-scFv(B)to HER2 antigen
2.4 scFv、M918-scFv的内吞效率
用流式细胞仪定量计算重组蛋白的内吞效率,在4℃条件下培养细胞,细胞处于禁止外源物质内化进入状态,重组蛋白附着在细胞表面,而当在37℃条件培养细胞时,细胞处于允许外源物质内化进入细胞状态,重组蛋白可通过抗原抗体相互作用和穿膜肽的穿膜特性进入细胞内。因此细胞表面结合重组蛋白的内吞效率可通过37℃样品相对于4℃对照样品的MFI降低水平得到[10]。实验结果如图5所示,HER2阳性细胞与重组蛋白scFv、M918-scFv经过4℃孵育,再转移至37℃培养后,细胞表面的MFI均有一定程度的降低(图5-A、B),其中M918-scFv的效果更显著,在SK-BR-3和BT474中其内吞效率分别是scFv的1.8倍和1.5倍(图5-D)。而在HER2阴性细胞MCF-7中,由于细胞表面缺少HER2抗原,因此重组蛋白scFv、M918-scFv处理后细胞表面的MFI没有明显的变化。说明scFv、M918-scFv都是通过HER2特异性结合来结合细胞的,且通过偶联穿膜肽可以提高scFv的内吞。

图5 流式细胞仪检测scFv、M918-scFv在不同细胞系中的内吞效率Fig.5 Uptake studies of scFv and M918-scFv into different cell lines detected by flow cytometry
激光共聚焦显微镜观察结果与流式细胞仪检测结果相同。如图6所示,在HER2阳性细胞SKBR-3和BT474中,4℃孵育后,重组蛋白在细胞周围有明显的聚集;37℃孵育后,观察到明显的内吞,重组蛋白均匀的分布在细胞质中。在MCF-7细胞中,则观察不到重组蛋白的聚集。

图6 激光共聚焦显微镜观察scFv、M918-scFv在SKBR-3(A)、BT474(B)、MCF-7(C)中的内吞Fig.6 Uptake studies of scFv,M918-scFv into SK-BR-3(A),BT474(B) and MCF-7(C)cells observed by confocal laser scanning microscopy
3 讨论
CPPs自发现以来,就在药物递送领域得到了广泛的关注和应用。然而CPPs不受细胞类型的影响,未经修饰的CPP作为药物递送载体存在靶向性差,靶细胞摄取率低等问题,单凭CPPs无法使药物定向蓄积,使作用于靶细胞或靶组织的药物浓度减少,对正常组织损伤较大,限制了其作为药物载体的应用[11-12]。抗体能特异性识别肿瘤细胞靶分子,可将一定量的抑癌药物富集到肿瘤组织中,具有特异性高、性质均一及针对特定靶点定向制备等优点。由于单克隆抗体本身存在着筛选周期长,筛选效率低等问题,使其成为治疗的瓶颈[13]。scFv和传统的抗体相比具有显著的优势,即保持了原抗体的结合位点,又降低了一般异源性抗体的免疫反应,易于进行分子改造等优点[14]。
为此本研究利用抗体的靶向性及CPP的穿膜性能,使用基因工程手段将穿膜肽M918与靶向HER2的scFv偶联,构建了原核表达质粒。scFv是由全抗的重链可变区和轻链可变区组成的,不含Fc段。在蛋白表达过程中很容易形成“包涵体”沉淀表达[15]。低温诱导可降低目的蛋白的合成速率,从而增加目的蛋白的可溶性。诱导剂IPTG的浓度也会影响目的蛋白的溶解性。因此通过实验优化了融合蛋白上清表达的最适IPTG浓度,使重组蛋白主要在上清中表达并纯化了重组蛋白M918-scFv,获得的蛋白浓度及纯度均符合生物学验证标准。
MST实验结果表明穿膜肽与scFv偶联,不会影响抗体与抗原的相互作用。流式细胞仪及激光共聚焦实验结果表明偶联M918后,重组蛋白仍通过HER2特异性结合来结合细胞使重组蛋白M918-scFv获得了scFv的靶向性,解决了穿膜肽靶向性差的问题。同时在穿膜肽M918的作用下,提高了scFv在HER2阳性细胞中的内吞效率,重组蛋白M918-scFv兼具了穿膜肽的穿膜效率。与许多传统的穿膜肽相比,M918含有7个带正电的氨基酸,同时具有很低的两亲性,内吞不依赖于细胞表面的糖胺聚糖,因此更容易内化到细胞内,并且M918在递送蛋白质等大分子物质时表现出最佳的传递特性[16]。因此融合蛋白M918-scFv表现出良好的内吞效率。
4 结论
本研究将穿膜肽M918与靶向HER2的scFv偶联,成功的表达并纯化出重组蛋白M918-scFv。与单独的scFv相比,重组蛋白M918-scFv不仅表现出M918肽的穿膜特性,内吞效率显著提高,同时还保留了scFv的靶向性,重组蛋白能够靶向递送至HER2阳性乳腺癌细胞中。
