泛素E3连接酶CHIP和E4B互换U-box结构域突变体的构建及泛素化活性验证
2021-02-10范宇宸陆瑶刘香男赵博
范宇宸 陆瑶 刘香男 赵博
(上海交通大学药学院,上海 200240)
泛素化是由包括泛素活化酶E1、泛素结合酶E2和泛素连接酶E3在内的一系列酶催化下发生的级联反应,是真核细胞蛋白质翻译后修饰的重要过程[1]。其中,E3识别并介导底物的泛素化,是参与泛素化的关键酶之一。E3根据结构和功能的不同主要分为RING家族、HECT家族、U-box家族和CRL家族[2]。作为U-box家族泛素连接酶的主要活性区域,U-box结构域的功能主要是与泛素结合酶E2相互作用,并将泛素Ub传递至底物蛋白上[3]。因此,U-box结构域对于该家族E3的活性至关重要。CHIP(carboxyl terminus of Hsc70/Hsp70-interacting protein)和E4B(ubiquitination factor E4B)是U-box家族泛素连接酶的2个重要成员,它们共同参与了内质网蛋白质量控制[4]。不同的是,CHIP是分子伴侣依赖型的泛素连接酶,通过N末端的TPR结构域与分子伴侣Hsc70/Hsp70相互作用介导底物的泛素化[5];而E4B不仅具有E3的活性,还能够充当E4,发挥延伸泛素链的功能[6],因此它们一直是U-box家族泛素连接酶研究的热点。
U-box结构域的活性与其氨基酸序列和空间结构的完整性密切相关。研究表明,发生在CHIP的U-box结构域的突变E301Q,使CHIP泛素化其底物的活性下降[7]。而通过改造E4B的U-box结构域的部分氨基酸序列,增强其与E2的亲和力,能够增强E4B的活性[8]。亦有报道表明,CHIP的U-box结构域完整序列保留的情况下,它的N末端融合一个异源性蛋白能够特异性靶向底物蛋白,同时U-box结构域依旧能传递泛素,这种融合蛋白称为嵌合泛素连接酶[9]。由此可见,U-box结构域的序列及空间结构若得以完整保留,其活性有可能得到部分保留。CHIP和E4B的U-box结构域氨基酸序列并不相似,先前的研究筛选得到的它们的潜在底物中,却有多种共同底物[10]。为了进一步研究U-box结构域对CHIP和E4B活性的影响,我们通过互换CHIP和E4B的U-box结构域,验证构建得到的突变体对CHIP和E4B各自底物和二者共同底物的泛素化活性。因此,基于前期研究成果,我们选取了筛选得到的CHIP的潜在底物RCC2、E4B的潜在底物NIPSNAP1、二者潜在共同底物CDC37和文献报道的CHIP和E4B的共同底物p53[11]为实验底物进行验证,旨在为进一步研究CHIP和E4B的E3活性及其U-box结构域的作用奠定实验基础。
1 材料与方法
1.1 材料
HEK-293T细胞购自中国科学院细胞库;胎牛血清、DMEM培养基、opti-MEM减血清培养基购自Gibco公司;大肠杆菌DH5α感受态细胞菌种由本实验室保存并制备;pLVX-IRES-mCherry、pLVX-3′flag-IRES-mCherry、pcDNA-NIPSNAP1、pcDNACDC37、pLVX-E4B、pLVX-CHIP等质粒由本实验室保存;高保真KOD酶购自东洋纺上海有限公司;限制酶、T4 DNA连接酶购自Thermo Fisher公司;琼脂糖凝胶回收试剂盒、质粒小提试剂盒购自天根生化科技公司;引物合成及质粒测序由生工生物公司完成;anti-flag抗体、anti-CHIP抗体、anti-E4B抗体和anti-GAPDH抗体购自Abcam公司。
1.2 方法
1.2.1 HEK-293T细胞的复苏和培养 从液氮罐中取出冻存的HEK-293T细胞株,迅速置入37℃水浴中,并轻轻摇晃冻存管使其在1 min内融化。加入适量完全培养基800 r/min离心2 min,再使用4 mL完全培养基重悬细胞,置于6 cm细胞培养皿中,37℃、5%CO2条件下培养。定期观察细胞状态,进行传代培养。
1.2.2 底物质粒pLVX-RCC2-IRES-mCherry、pLVX-p53-IRES-mCherry的构建
1.2.2.1 底物基因RCC2和p53的PCR扩增 根据NCBI数据库调取的RCC2和p53底物的全长CDS序列设计引物,并在RCC2基因上下游分别插入Nde I、Not I两个酶切位点,在p53基因上下游分别插入EcoR I、BamH I两个酶切位点,并在p53基因3′端引入flag标签序列。引物序列如下:
RCC2-F:TACCTTCATATGCCCAGGAAGAAGGCGGC;RCC2-R:ATCTTAAAGCGGCCGCGAGGGT TCGGGGGTTGTATT;p53-F:GCGGCGGAATTCATGGAGGAGCCGCAGTCA;p53-R:ACAGTAGGATCCTCACTTATCGTCGTCATCCTTGTAATCGTCTGAGTCAGGCCCTTC
根据KOD酶说明书设计PCR反应体系进行扩增。
1.2.2.2 载体与底物基因连接 应用Nde I、Not I两种限制酶酶切pLVX-3′flag-IRES-mCherry载体质粒和RCC2底物基因,应用EcoR I、BamH I两种限制酶酶切pLVX-IRES-mCherry载体质粒和p53底物基因。载体经琼脂糖凝胶电泳回收,底物基因经柱回收,根据底物基因与载体摩尔比7∶1计算各自用量,使用T4 DNA连接酶室温连接1.5 h。取5 μL酶连产物加入30 μL DH5α感受态细胞,冰敷30 min,42℃热激90 s,再冰敷2 min。用1 mL LB液体培养基37℃,220 r/min复苏1 h,后将菌液涂布于氨苄抗性的LB平板上,37℃倒置培养过夜。次日各挑取4个单克隆小摇,提质粒后测序鉴定质粒是否构建成功。
1.2.3 Overlap PCR构建CHIP及E4B互换U-box结构域的突变体
1.2.3.1 目的片段的扩增 根据overlap PCR的技术要求设计引物,分别将CHIP A片段(CHIP基因1-675 bp)和CHIP B片段(CHIP的U-box基因676-909 bp)、E4B A片段(E4B基因1-3 678 bp)、E4B B片段(E4B的U-box基因3 679-3 906 bp)的基因序列进行扩增。引物序列为:
CHIP A-F:TTACTGGAATTCATGAAGGGCAAGGAGGAG;CHIP A-R:TCGCTTCTTCCTCTTGACGCTCCTG;CHIP B-F:TCGCTTCTTCGACGCTCCTGATGAG;CHIP B-R:ATTATTGGATCCTTAAGCGTAGTCTGGGACGTCGTATGGGTAGTGATCGCTG;E4B A-F:TCTAGTGAATTCATGGAGGAGCTGAGC;E4B A-R:GCTGTAGTCGATTTCGACATCCCCG;E4B B-F:GCTGTAGTCGGACATCCCCGACTAC;E4BB-R:ATTATTGGATCCTCAAGCGTAGTCTGGGACGTCGTATGGGTAGTAGTCCTCCA
根据KOD酶说明书设计PCR反应体系进行扩增。
1.2.3.2 全长突变体基因的融合 将1.2.3.1中4条片段的PCR产物分别经琼脂糖凝胶电泳回收,根据A、B片段摩尔比1∶1计算overlap PCR的各自模板用量,进行PCR反应。前8个循环体系中不加引物,A、B片段互为模板融合成全长的突变体序列,第9个循环起体系中加入A片段上游引物及B片段下游引物扩增全长序列。
1.2.3.3 全长突变体基因与载体的连接 应用EcoR I、BamH I两种限制酶酶切pLVX-IRES-mCherry载体质粒和全长突变体目的基因。后续回收、连接及鉴定方法如1.2.2.2所述。
1.2.4 质粒转染HEK-293T细胞 取生长状态良好的HEK-293T细胞,胰酶消化后用新鲜培养基重悬细胞,计数,以2.2×106个的数量接种于6 cm细胞培养皿,培养过夜。移除培养基,无菌PBS洗涤细胞两遍,加入适量opti-MEM减血清培养基。取无菌EP管两支,一支加入质粒,另一支加入质粒质量3倍体积的PEI,分别用250 μL opti-MEM将质粒和PEI制备为均匀的溶液,室温静置5 min,后将PEI加入质粒中,轻轻混匀,室温静置20 min,随后将PEI-质粒混合物加入预先更换培养基的细胞中,过夜培养12 h后更换为含血清的DMEM培养基。
1.2.5 底物、CHIP和E4B及其突变体在细胞中的表达检测 1.2.4中细胞转染44 h后,将培养基替换为含10 μmol/L MG132的培养基,37℃、5% CO2继续培养4 h。取出培养皿,弃去培养基,4℃预冷的PBS洗细胞2遍,每皿加入400 μL 含蛋白酶抑制剂和去泛素化酶抑制剂的RIPA裂解液,冰上裂解5 min。使用细胞刮刀刮取裂解后的细胞至EP管中,置于摇床冰上继续裂解30 min,随后4℃ 12 000 r/min离心15 min,取上清即为总蛋白。BCA法对总蛋白浓度定量,根据浓度将样品总蛋白浓度调整到一致水平,取适量裂解液煮样,10%分离胶SDS-PAGE电泳分离,转膜,封闭。由于4个底物上都带有flag标签,因此使用anti-flag抗体(1∶1 000)检测底物表达量。由于anti-CHIP和anti-E4B两种抗体所识别的抗原分别为CHIP和E4B的前100个氨基酸残基所组成的肽链,而两种突变体前100个氨基酸残基与各自的野生型E3相同,因此使用anti-CHIP抗体(1∶10 000)和anti-E4B抗体(1∶5 000)检测CHIP、E4B及其突变体的表达量。anti-GAPDH抗体(1∶10 000)检测内参蛋白表达量。
1.2.6 免疫共沉淀验证CHIP和E4B及其突变体对底物的泛素化情况 取1.2.5中所获得的细胞裂解液,向1 mg总蛋白中加入6 μL anti-flag抗体偶联的proteinG beads,摇床上4℃结合6 h,随后4℃ 9 000 r/min离心1 min,弃上清,PBS-T洗beads 6-8次。40 μL PBS 重悬 beads,加入 10 μL 还原性 5× 蛋白上样缓冲液,99℃煮样10 min,取上清上样,6%分离胶SDS-PAGE电泳分离,转膜,封闭,anti-Ub抗体(1∶5 000)检测底物上结合的Ub水平,反映泛素化情况。
2 结果
2.1 pLVX-RCC2-IRES-mCherry、pLVX-p53-IRES-mCherry质粒的构建
以HEK-293T细胞总RNA反转录得到的cDNA为模板,经PCR反应扩增得到的条带分子量符合理论值,RCC2目的基因全长1 569 bp,位于1.5 kb marker附近;p53 目的基因全长1 182 bp,位于1 kb marker附近(图1-A、B)。目的基因与载体经酶切酶连后转化涂板,分别挑取了4个阳性克隆小摇提取质粒,琼脂糖凝胶电泳显示质粒质量良好,与空载体质粒相比,电泳速率较慢(图1-C),提示目的基因可能成功连接,经测序后序列正确,2个底物质粒均构建成功。
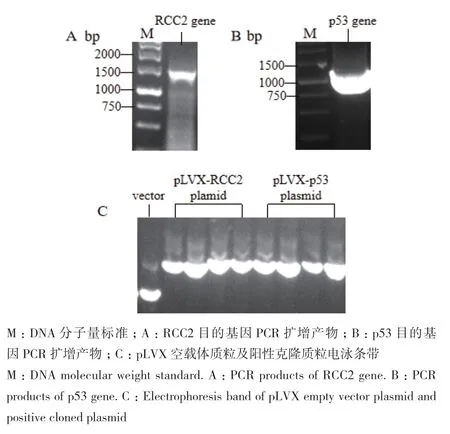
图1 RCC2、p53底物质粒克隆及构建Fig.1 Plasmid cloning and construction of substrate RCC2 and p53
2.2 互换U-box的突变体pLVX-C+E-IRES-mCherry、pLVX-E+C-IRES-mCherry质粒的构建
以实验室保存的pLVX-CHIP-IRES-mCherry、pLVX-E4B-IRES-mCherry质粒为模板,经PCR反应扩增分别得到CHIP的A片段CA和B片段CB,E4B的A片段EA和B片段EB。琼脂糖凝胶电泳显示,CA位于750 bp marker附近、CB位于250 bp marker附近,EA位于2 000 bp marker以上,EB位于250 bp marker附近,均符合其理论大小(图2-A)。
随后分别以CA和EB、EA和CB为模板,经overlap PCR融合、扩增,得到CHIP A片段与E4B B片段的融合基因,命名为C+E(CHIP基因1 bp-675 bp序列的3′端融合E4B基因第3 679-3 906 bp的U-box序列);得到E4B A片段与CHIP B片段的融合基因,命名为E+C(E4B基因1-3 678 bp序列的3′端融合CHIP基因第676-909 bp的U-box序列)。经琼脂糖凝胶电泳鉴定,C+E条带位于1 kb marker附近(图 2-B),E+C条带位于 4 kb marker附近(图 2-C),均符合其理论大小。后经酶切、酶连、转化、测序确 认 pLVX-C+E-IRES-mCherry、pLVX-E+C-IRES-mCherry两种质粒构建成功。

图2 融合基因C+E及E+C的PCR结果Fig.2 PCR results of fusion genes C+E and E+C
2.3 底物、CHIP和E4B及其突变体在HEK-293T细胞中的表达
根据实验需要,分别转染底物pLVX-RCC2表达质粒(图3-A)、pcDNA-NIPSNAP1表达质粒(图3-B)、pLVX-p53表达质粒(图3-C)和pcDNA-CDC37表达质粒(图3-D)。收集细胞样品,经Western blot,pLVX-RCC2表达质粒、pcDNA-NIPSNAP1表达质粒、pLVX-p53表达质粒和pcDNA-CDC37表达质粒在HEK-293T细胞中均能正常表达,具有较高的表达量。分别与4种底物共转染的pLVX-CHIP表达质粒、pLVX-C+E表达质粒、pLVX-E4B表达质粒和pLVX-E+C表达质粒均能够正常表达,且与HEK-293T组相比有过表达趋势。

图3 底物、CHIP和E4B及其突变体的细胞内表达结果Fig.3 Intracellular expression results of substrates,CHIP,E4B and their mutants
2.4 CHIP和E4B及其突变体对底物泛素化的影响
底物RCC2的免疫共沉淀实验结果表明,与HEK-293T组相比,过表达CHIP能够增强RCC2的泛素化,其Ub拖尾条带更深(图4-A)。同时,过表达E4B不能增强RCC2的泛素化。过表达C+E能够一定程度上增强RCC2的泛素化,但其程度不及野生型CHIP。过表达E4B或E+C则无增强泛素化的作用(图4-A)。与RCC2类似,底物NIPSNAP1的免疫共沉淀实验结果表明,与HEK-293T组相比,过表达E4B能够增强NIPSNAP1的泛素化,过表达E+C亦能增强其泛素化,但其程度不及野生型E4B。过表达CHIP或C+E则无增强泛素化的作用(图4-B)。这2个底物的实验结果证明了,RCC2是CHIP的底物,NIPSNAP1是E4B的底物。同时,CHIP和E4B互换U-box结构域后对各自底物依旧保留了一定程度的泛素化活性。
对于底物p53和CDC37,与HEK-293T组相比,过表达CHIP或E4B均能够增强p53和CDC37的泛素化。同时,过表达C+E能够一定程度上增强p53和CDC37的泛素化,但其程度不及野生型的CHIP。而过表达E+C几乎不能增强p53和CDC37的泛素化(图4-C、D)。这2个底物的实验结果证实了文献报道的p53是CHIP和E4B的共同底物,同时证明了CDC37是CHIP和E4B的共同底物。与上述类似,CHIP换上E4B的U-box结构域后对CHIP和E4B的共同底物保留了部分的泛素化活性,但不同的是,E4B换上CHIP的U-box结构域后则几乎失去了泛素化共同底物的活性。

图4 底物RCC2、NIPSNAP1、p53、CDC37的免疫共沉淀实验结果Fig.4 Co-immunoprecipitation experiment results of substrate RCC2,NIPSNAP1,p53 and CDC37
3 讨论
泛素-蛋白酶体系统通过泛素化降解胞内蛋白起到调节细胞功能的重要作用。该系统调节包括细胞周期、基因转录和翻译、细胞凋亡、细胞代谢等在内的一系列重要细胞生命活动[12]。泛素连接酶作为泛素化过程的重要参与者,在调节其特异性底物的降解及其他信号的转导方面具有关键的作用。其中,U-box家族泛素连接酶CHIP和E4B及其底物在疾病发生过程中的作用越来越受到关注。例如,CHIP 在肺癌[13]、三阴性乳腺癌[14]等中呈现为抑癌蛋白,CHIP的过表达伴随其促癌底物的降解抑制了肿瘤细胞的生长。在脊髓小脑共济失调患者中,CHIP的U-box结构域存在突变,导致了其E3活性改变,从而加速了疾病进展[15]。也有的研究将CHIP的U-box结构域嵌合至Grb2蛋白C末端,靶向酪氨酸激酶BCR-ABL的泛素化,成为了慢性粒细胞白血病治疗的潜在新手段[16]。而E4B则在肝癌[17]等癌症中表现为促癌蛋白。在乳腺癌中,E4B促癌的可能机制是由于它对p53的泛素化降解[18]。因此,对CHIP和E4B的U-box结构域的功能进行深入研究有助于进一步阐明部分疾病的发病机理,从而开发新的治疗方法。
基于以上理论基础,本研究通过将CHIP和E4B的U-box结构域互换,分别对突变体泛素化CHIP和E4B各自底物和共同底物的活性进行考察,发现CHIP突变体C+E、E4B突变体E+C都保留了一定的活性,同时,E+C对二者共同底物的泛素化活性基本丧失了。有报道表明,E4B可以作为E4发挥链延长的功能,而不直接作为E3将底物泛素化,但具体发挥E4功能的区域尚不明确[19]。因此,可能在互换U-box结构域时对全长E4B蛋白的结构产生了影响,丧失了E4的活性,因而表现为部分底物泛素化活性的减弱。未来,一方面,结合涉及CHIP的U-box结构域的嵌合泛素连接酶技术,深入研究突变体C+E泛素化CHIP底物的活性;另一方面,利用免疫共沉淀技术,研究突变体C+E和E+C与底物的相互作用,进一步阐明U-box结构域对CHIP和E4B活性的作用。
4 结论
本研究基于泛素连接酶CHIP及E4B的底物,为研究U-box结构域对CHIP和E4B活性的影响,成功构建了2个互换U-box结构域的CHIP及E4B突变体C+E和E+C。经HEK-293T细胞内泛素化反应检测底物泛素化情况,最终确定CHIP突变体C+E能够部分保留泛素化CHIP底物的活性,E4B突变体E+C只在泛素化E4B底物时保留了部分泛素化活性,而在泛素化共同底物时活性丧失。
