基于重组毕赤酵母的草鱼C型溶菌酶生物合成及其抑菌活性
2021-02-10杨悦陶妍谢晶钱韻芳
杨悦 陶妍 谢晶 钱韻芳
(上海海洋大学食品学院,上海 201306)
溶菌酶是抗菌肽的一种类型,它存在于绝大多数生物的机体中,在内源性免疫系统中具有非常重要的作用。根据溶菌酶的氨基酸序列、化学性质和生物学活性,可以将动物界的溶菌酶划分为3种:C型溶菌酶(chicken-type)、G型溶菌酶(goose-type)和I型溶菌酶(invertebrate-type)[1];其中C型溶菌酶的分布最为广泛,它不仅存在于哺乳动物和禽类等温血动物中,也存在于鱼类和贝类冷血动物中[2]。迄今为止,最典型的C型溶菌酶是母鸡的鸡蛋清溶菌酶(hen egg white lysozyme,HEWL);对于它的结构分析表明它含有两个结构域,Glu35和Asp52两个高度保守的残基形成了它的活性位点[3]。由于HEWL能够裂解细菌细胞壁肽聚糖的N-乙酰胞壁酸与N-乙酰氨基葡萄糖之间的β-1,4糖苷键,它对革兰氏阳性细菌的抗菌作用已在许多报道中得到了证实,是食品工业中目前唯一被允许使用的溶菌酶[4-5]。与HEWL相比,水产生物来源C型溶菌酶的表达则极其受水域环境中病原微生物的影响。有研究表明:当斜带石斑鱼(Epinephelus coioides)处于溶藻弧菌(Vibrio alginolyticus)污染的环境中24 h,其头肾中C型溶菌酶基因的转录水平增高4.6倍[6];哲罗鱼(Hucho taimen)在含有鲁氏耶尔森氏菌(Yersinia ruckeri)的水域环境中生活24 h后,其肝脏中C型溶菌酶基因的mRNA水平是对照组的7.2倍[7];马尼拉蛤仔(Venerupis philippinarum)在被鳗弧菌(Vibrio anguillarum)侵染12 h后,其体内的两种C型溶菌酶mRNA的表达均显著上调[8]。由此可以确认C型溶菌酶在鱼贝等水产生物抵御病原微生物侵染的过程中发挥了重要的作用,也因此具有成为水产养殖绿色饲料添加剂或天然抗菌剂的开发利用价值。
目前已有不少利用重组DNA技术制备水产生物C型溶菌酶的研究报道。有学者在大肠杆菌(Escherichia coli)中表达了日本对虾(Marsupenaeus japonicus)的重组C型溶菌酶,但是重组蛋白存在于包涵体沉淀中,必须对其进行纯化复性处理,才显示抗革兰氏阴性细菌的活性[9];此外,来源于奥利亚罗非鱼(Oreochromis aureus)的C型溶菌酶也在大肠杆菌中被成功表达,重组蛋白也是以包涵体形式存在,需要对其进行变性溶解和透析复性,才具有溶菌活性[10]。由此可见,大肠杆菌原核表达系统具有一定的局限性,它无法对多肽链进行翻译后的加工,大多数情况下表达产物为不溶性且无活性的包涵体[11]。相比之下,在毕赤酵母细胞中表达的重组蛋白可以实现多肽链的正确折叠以及翻译后的其他必要修饰,并将表达产物分泌至胞外而便于纯化,因此被认为是首选的基因工程菌[12]。近几年来,我们一直致力于基于毕赤酵母表达系统的鱼贝类重组抗菌肽的生物合成,已经成功实现斑点叉尾鮰(Ictaluru punctatus)、三疣梭子蟹(Portunus trituberculatus)和鲤鱼(Cyprinus carpio)C型溶菌酶在毕赤酵母中的重组DNA表达[13-15],3种重组C型溶菌酶均显示了良好的抗菌活性。
草鱼(Ctenopharyngodon idella)是我国淡水鱼养殖中的四大家鱼之一,也是其中个体最大的鱼种。由于近年来对水产动物蛋白质的需求量不断增长,草鱼的养殖规模也逐年增大,在2017年其养殖量就占淡水养殖产品的18.40%[16];这种高密度养殖必然为病原微生物的交叉感染提供了适宜的环境,但近年来的草鱼产量仍居高不下,2019年的数据显示其养殖量仍占18.36%[17];其原因除了广泛使用抗生素外,主要归咎于草鱼自身拥有超强的抵御病原微生物侵染的能力,而这种能力得益于其自身完善的免疫系统。已有研究表明:在草鱼的多个免疫器官中均有C型溶菌酶的表达,且这种表达会明显受到环境病原微生物刺激的影响。例如:当草鱼被嗜水气单胞菌(Aeromonas hydrophila)感染72 h后,在其鳃部中C型溶菌酶基因的转录水平是对照组的5.4倍[18];当草鱼被维氏气单胞菌(Aeromonas veronii)感染12 h后,其肝脏和脾脏中的C型溶菌酶基因的转录水平分别提高7.5倍和27倍[19]。因此,可以确定C型溶菌酶在草鱼内源性免疫机制中的作用举足轻重,它具有成为水产养殖绿色饲料添加剂或天然抗菌剂的应用前景。据此,本研究拟通过构建重组毕赤酵母菌株实现草鱼C型溶菌酶的生物合成,并对重组菌株产物的结构及生物学活性进行考察,旨在为鱼类来源C型溶菌酶的大规模制备奠定良好基础。
1 材料与方法
1.1 材料
1.1.1 实验动物、菌株和载体 鲜活草鱼来源于上海市古棕路农贸市场;大肠杆菌DH5α:天根生物科技有限公司(北京);pMD19-T simple克隆载体:TaKaRa公司(日本);毕赤酵母X-33和表达载体pPICZαA:Invitrogen公司(美国);用于抑菌试验的细菌:金黄色葡萄球菌(Staphylococcus aureus,ATCC 6538)、 枯 草 芽 孢 杆 菌(Bacillus subtilis,ATCC 6633)、 单 增 李 斯 特 菌(Listeria monocytogenes,ATCC 19115)、蜡样芽孢杆菌(Bacillus cereus,ATCC 14579)、 沙 门 氏 菌(Salmonella,ATCC 14028)、 铜 绿 假 单 胞 菌(Pseudomonas aeruginosa,ATCC 27853)、副溶血性弧菌(Vibrio parahaemolyticus,ATCC 17802)、大肠杆菌(Escherichia coli,ATCC 10305)。
1.1.2 主要试剂和设备 RNA提取试剂盒RNAiso Plus、Taq DNA 聚合酶、T4 DNA 连接酶和限制性内 切 酶(Sac I、Xho I和 Xba I):TaKaRa公 司 ;FastKing第一链cDNA合成试剂盒、DNA割胶回收试剂盒、质粒提取试剂盒、酵母 DNA 提取试剂盒、BCA蛋白质浓度测定试剂盒和DNA 分子量标准:天根生物科技有限公司;超低蛋白质分子量标准和彩虹预染蛋白质分子量标准:中科瑞泰生物科技有限公司(北京);Western blot试剂盒:康为世纪生物科技有限公司(北京);用于培养细菌和毕赤酵母的所有培养基配方(LB、YPD、MM、MD、BMG、BMM)见毕赤酵母表达系统手册(Invitrogen公司)。PCR仪、Gene Pulser XcellTM电穿孔系统、聚丙烯酰氨凝胶电泳仪和ProfiniaTM蛋白质纯化仪:BIO-RAD公司(美国);切向回流超滤器:赛多利斯公司(德国)。PCR引物的合成:上海生工生物工程有限公司。
1.2 方法
1.2.1 目的基因的RT-PCR克隆及其相关位点的添加 取草鱼头肾,使用“RNAiso Plus试剂盒”提取其总RNA;使用“FastKing第一链cDNA合成试剂盒”合成第一链cDNA。PCR引物的设计参考已有的草鱼C型溶菌酶的基因序列(GenBank No. EU835654)(表1)。第一次PCR为扩增草鱼C型溶菌酶的全长cDNA,反应体系:第一链cDNA 0.2 μL、引物CF 和 CR(10 μmol/L) 各 0.8 μL、10×Taq Buffer 2 μL、dNTP(2.5 μmol/L each)1.6 μL、Taq DNA 聚合酶(2.5 U/μL)0.2 μL,总 20 μL ;反应条件 :94℃3 min ;94℃ 40 s,56.2℃ 30 s,72℃ 1 min(30 个循环);72℃ 5 min。第二次PCR为将6×His标签和Xba I位点及终止密码子分别添加在5′端和3′端,反应体系和条件:模板为第一次PCR产物、引物为CP1和CP2,退火温度为55.9℃,其他同第一次PCR。第三次PCR为将Xho I位点和Kex 2信号肽酶切割位点添加在5′端,反应体系和条件:模板为第二次PCR产物、引物为CP3和CP2,退火温度为55.8℃,其他同第一次PCR;此次PCR扩增的产物即目的基因“Cilyc”。将“Cilyc”插入“pMD19-T”克隆载体后转化大肠杆菌DH5α细胞,经37℃培养后挑选阳性克隆交由上海生工生物工程有限公司做DNA测序。使用ExPASy软件(http://web.expasy.org/compute.pi/)预测重组Cilyc的分子量;使用SWISS MODEL建模服务器(https://swissmodel.expasy.org/)和PyMOL软件对重组Cilyc的三维结构进行预测。
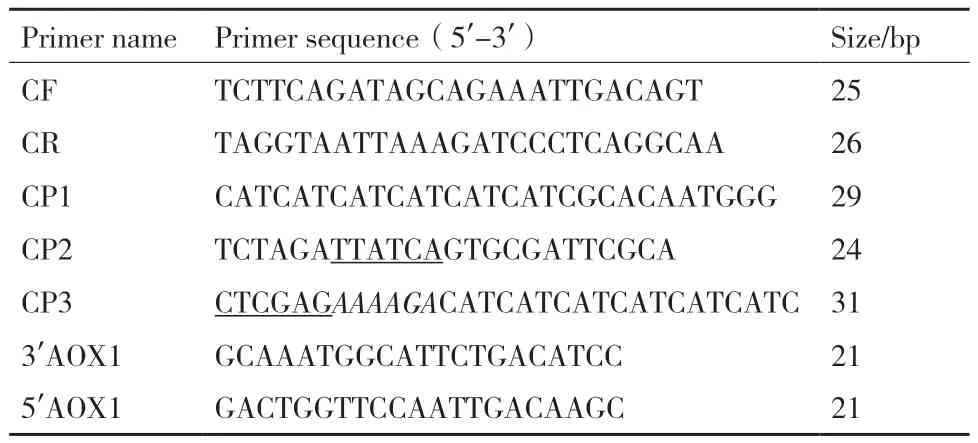
表1 引物序列Table 1 Primer sequences
1.2.2 重组毕赤酵母菌株X-33/pPICZαA-CilyC的构建及筛选 对重组克隆质粒“pMD-19T-CilyC”和表达载体“pPICZαA”同时进行Xho I和Xba I双酶切后,将片段“CilyC”与 pPICZαA按3∶7(V/V)混合,于16℃经T4DNA连接酶作用1 h;此混合液与大肠杆菌DH5α细胞经热激处理后于37℃培养至菌落产生,再通过PCR、Xho I和Xba I双酶切及DNA测序验证重组表达载体“pPICZαA- CilyC”。
pPICZαA-CilyC经Sac I酶切后与毕赤酵母X-33感受态细胞按1∶8(V/V)混合,于电转杯中在如下条件下进行转化反应:2 000 V、25 μF、200 Ω、电击5 ms;加入1 mL山梨醇(1 mol/L)静置2 h后再加入1 mL YPD培养基,于摇床中培养1.5 h(29℃、250 r/min);培养液离心后将其菌体涂于YPD平板上(含100 μg/mL博来霉素),29℃培养48 h。另外,同上构建重组菌株“X-33/pPICZαA”作为阴性对照。从YPD平板上挑选优势菌株分别接种于MD、MM和含1 000 μg/mL博来霉素的YPD平板上,于29℃培养48 h后进一步筛选优势菌株(含高拷贝目的基因、甲醇利用快速型),并对其进行基因组DNA的PCR鉴定,以验证重组菌株“X-33/pPICZαA-CilyC”,引物为 3′AOX1 和 5′AOX1(表 1)。
1.2.3 重组蛋白质的诱导表达及其纯化鉴定 将入选重组菌株先接种于5 mL YPD培养基中,于摇床(29℃、250 r/min)培养18 h后从中取500 μL转接于50 mL BMG培养基中,在同样条件下再培养24 h;取培养液离心后的菌体重新悬浮于50 mL BMM培养基中,于摇床(29℃、250 r/min)培养24 h后加入1%甲醇开始重组蛋白质的诱导表达;同时,以重组菌株“X-33/pPICZαA”作为阴性对照同上进行诱导表达。对摇床培养96 h后的培养液进行离心(4℃、12 000 r/min、10 min),其上清用于Tricine-SDS-PAGE分析(5%浓缩胶、18%分离胶、0.1 mol/L Tricine、0.1%SDS)。在以上预表达的基础上,挑选一个重组菌株进行进一步的甲醇浓度(0、0.5、1、1.5、2、2.5、3%)和表达时间(0、24、48、72、96、120 h)的优化试验。使用BCA试剂盒和Excel 2018分别测定蛋白质浓度和进行数据分析。
在确定最佳表达条件后,对该重组菌株进行1 L的发酵培养;使用切向回流超滤器对培养液上清进行浓缩后,通过ProfiniaTM蛋白质纯化仪对其进行镍离子亲和层析的纯化。纯化产物用于Western blot分析:将纯化产物电转至PVDF膜上后,按试剂盒说明书依次添加一抗(鼠单克隆抗体)和二抗(山羊抗小鼠lgG);经洗膜后使用HRP-DAB试剂盒进行显色。另一方面,将纯化产物交由上海中科新生命生物科技有限公司进行LC-MS/MS质谱分析。
1.2.4 重组蛋白质的抑菌活性测定 将金色葡萄球菌、枯草芽孢杆菌、单增李斯特菌、蜡样芽孢杆菌、沙门氏菌、铜绿假单胞菌、副溶血性弧菌和大肠杆菌于37℃培养至OD600=0.5,用LB培养基将其稀释100倍后分别取1 μL与100 μL的X-33/pPICZαA-CilyC的培养液上清混合,于37℃孵育2 h;从中取30 μL涂于LB平板后再于37℃培养12 h,以考察菌落长势。同时,将X-33/pPICZαA的培养液上清与细菌混合作为阴性对照。
另一方面,将上述经平板涂布法检验后有良好抑菌活性的细菌于37℃培养至对数生长期,再用LB培养基将其稀释至106CFU/mL;用PBS将纯化的重组CilyC配制成40、60、80、120、160、240、320、480、640、960、1 280 μg/mL 的溶液;按 1∶100(V/V)将细菌悬浮液与重组CilyC溶液混合于96孔板中,于37℃孵育24 h后测定OD600吸光值。另外,用PBS替代重组CilyC溶液作为阴性对照。抑菌率(%)=(阴性对照组吸光值-试验组吸光值)/(阴性对照组吸光值)×100%;使抑菌率≥95%的重组CilyC浓度被视为最小抑菌浓度(minimum inhibitory concentration,MIC)[20]。在测定不同浓度 CilyC 的抑制率时,每个浓度均设置3个重复,以保证数据的可信度。
2 结果
2.1 目的基因CilyC的扩增结果及其编码的CilyC蛋白的三维结构
三次PCR分别扩增得到524、411 和423 bp的cDNA片段,最后一次PCR扩增的片段经DNA测序显示(图1):相关酶切位点、6×His标签和终止密码子均已正确添加,该片段即为添加了所有必需位点的编码草鱼C型溶菌酶成熟肽(除去信号肽)的目的基因“CilyC”。除去添加的位点或序列,381 bp的cDNA编码了由127个氨基酸残基组成的草鱼C型溶菌酶成熟肽,内含8个保守的半胱氨酸残基和2个活性位点的残基。经 ExPASy 软件预测,CilyC蛋白的分子量为14.5 kD。

图1 目的基因CilyC的核苷酸及其推断的氨基酸序列Fig. 1 Nucleotide and deduced amino acid sequences of the target gene CilyC
图2是通过SWISS MODEL建模服务器和PyMOL软件获得的CilyC蛋白的三维结构,可以发现:它含有的构象元素包括α螺旋、β折叠和无规卷曲;8个半胱氨酸残基在形成Cys12-Cys130(绿色)、Cys36-Cys118(黄色)、Cys80-Cys98(红色)和Cys69-Cys84(蓝色)4对二硫键时,每对二硫键的2个半胱氨酸残基在空间上将α螺旋与无规卷曲缔结在一起,这样的配对方式使重组CilyC蛋白形成了一个稳定的椭球状空间结构,也更有利于赋予其生物学功能;另外,Glu41和Asp57两个残基在空间上形成了一个明显的活性位点。

图2 CilyC蛋白的三维结构Fig.2 Three-dimensional structure of the CilyC protein
2.2 重组毕赤酵母菌株X-33/pPICZαA-CilyC的筛选
使用通用引物 3′AOX1 和 5′AOX1 对 9 株重组大肠杆菌“DH5α/pPICZαA-CilyC”的菌落PCR鉴定发现:1-4号、7-9号菌株均在900 bp处有明显条带(图3-A),与理论分子量927 bp相符;以2号菌株为代表对其进行DNA测序,结果显示CilyC插入pPICZαA的正确位点。另一方面,对pPICZαA-CilyC进行Xho I 和Xba I双酶切处理,结果如图3-B所示:在略高于400 bp处显示1个浅条带,与423 bp的预期分子量相符,由此判断重组表达载体“pPICZαACilyC”已成功构建。

图3 重组表达载体pPICZαA-CilyC的菌落PCR(A)和双酶切鉴定(B)Fig. 3 Identification of recombinant expression vector pPICZαA-CilyC by colony PCR(A)and restriction endonuclease digestion(B)
通过MD、MM和含1 000 μg/mL博来霉素的YPD平板筛选到8株优势重组毕赤酵母菌株“X-33/pPICZαA-CilyC”;使用引物 3′AOX1 和 5′AOX1 对它们的基因组DNA进行PCR扩增,结果如图4所示:2号、4-8号重组菌株均在700-1 000 bp处显示明显的扩增条带,符合预期分子量927 bp。由此可以确认X-33/pPICZαA-CilyC已成功构建。
2.3 重组CilyC的诱导表达及其条件优化
选择图4中的5、6、8号重组菌株进行预表达,表达条件为:29℃、250 r/min、1.0%甲醇、96 h。经Tricine-SDS-PAGE分析显示(图5):这3株重组菌株的培养液上清均在略高于14.4 kD处有明显蛋白质条带,与CilyC的理论分子量14.5 kD相符,但阴性对照X-33/pPICZαA的培养液上清未显示任何条带。由此初步推断,目的蛋白CilyC已成功表达。

图4 重组毕赤酵母菌株基因组DNA的PCR鉴定Fig. 4 PCR identification for the genome DNA of recombinant P. pastoris strain

图5 重组菌株预表达产物的Tricine-SDS-PAGE分析Fig. 5 Tricine-SDS-PAGE analysis for pre-expressed products of the recombinant strains
进一步选择8号菌株进行甲醇浓度和表达时间的优化,由图6-A可见:当甲醇浓度为1.0%-2.5%时,在略高于14.4 kD处都显示了较明显的蛋白质条带,而对应总蛋白质浓度最高(0.63 mg/mL)的甲醇浓度为1.0%,因此选择此浓度作为以下实验的条件。图6-B显示了诱导表达时间对重组蛋白质表达的影响,可以发现当表达时间为96 h时蛋白质条带最深,对应的总蛋白质浓度也最高(0.61 mg/mL),而继续延长表达时间并无明显效果,因此以96 h为最适表达时间。

图6 甲醇浓度(A)和表达时间(B)对重组菌株表达产物的影响Fig. 6 Effects of methanol concentration(A)and expression time(B)on the expression products of the recombinant strain
2.4 表达产物的纯化及其鉴定
1 L发酵培养液经浓缩后通过镍离子亲和层析获得纯化的蛋白质,由Tricine-SDS-PAGE显示为近15 kD处的单一蛋白质条带(图7-A),符合重组CilyC的分子量(14.5 kD);通过测定蛋白质浓度后估算其表达量为13.7 mg/L。由Western blot分析显示的条带与电泳条带一致(图7-B),由此初步推测该纯化蛋白质为重组CilyC。进一步的LCMS/MS测定捕捉到11个肽段,它们与推断的相应位置的理论氨基酸序列完全一致,其中两个最长的肽段显示的分别是N端起45-61位的氨基酸序列(TADVGKDYGIFQINSFK)和72-94位的氨基酸序列(NLCNLPCSDLLKDDLKPSVECAK)(图 8),由此确定纯化蛋白质即为预期的重组CilyC。

图7 纯化蛋白质的Tricine-SDS-PAGE(A)和Western blot(B)分析Fig. 7 Tricine-SDS-PAGE(A)and Western blot(B)analysis for the purified protein
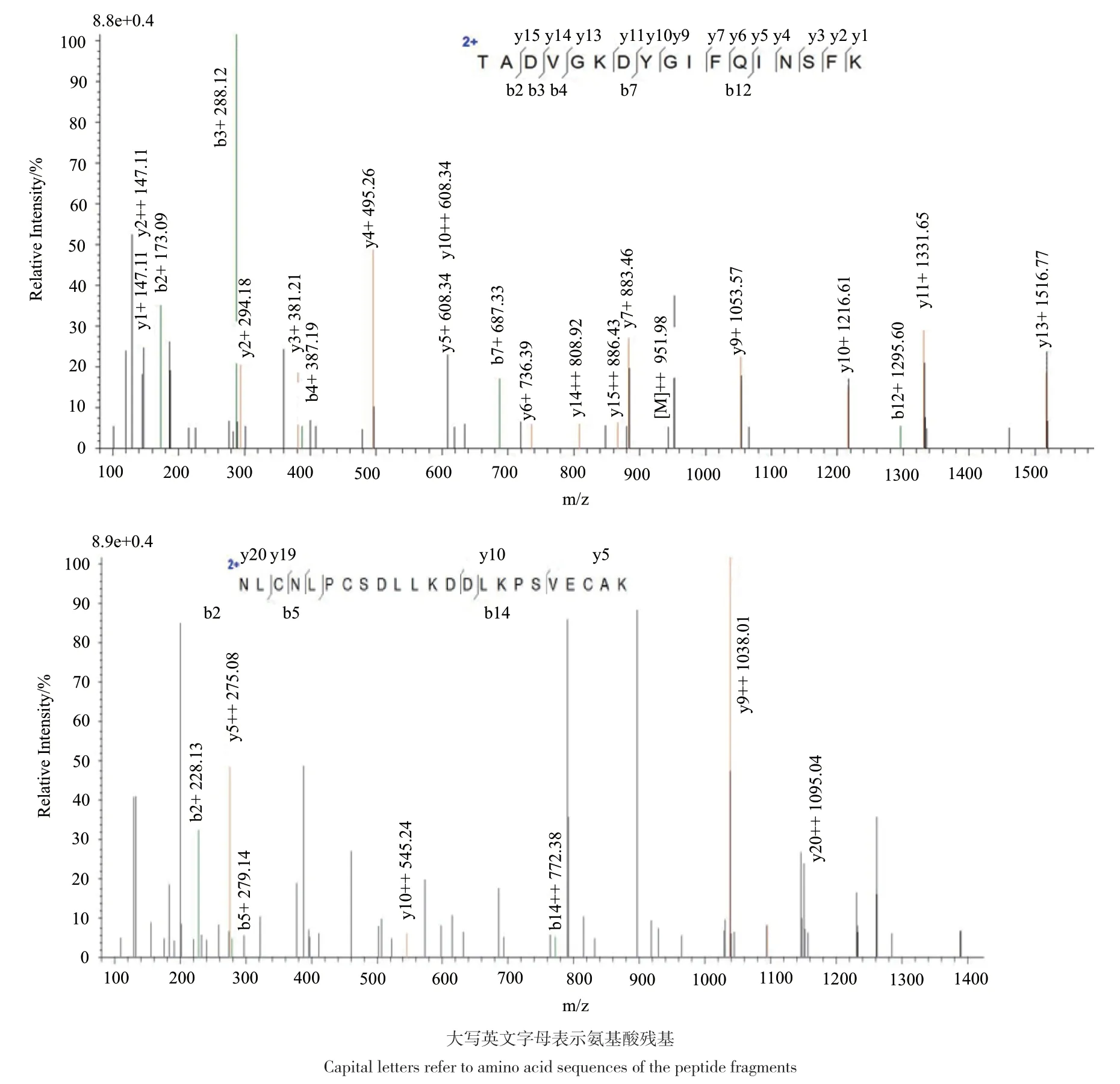
图8 纯化蛋白质的LC-MS/MS质谱分析Fig. 8 LC-MS/MS analysis for the purified protein
2.5 重组CilyC的抑菌活性
X-33/pPICZαA-CilyC的培养液上清与8种细菌作用后,由平板涂布法结果显示(图9):其对革兰氏阳性的金黄色葡萄球菌、枯草芽孢杆菌、单增李斯特菌和蜡样芽孢杆菌以及革兰氏阴性的沙门氏菌和铜绿假单胞菌具有明显的抑菌活性;但对于革兰氏阴性的副溶血性弧菌和大肠杆菌无明显的抑菌效果。另外,表2显示了纯化的重组CilyC对上述显示抑菌活性的6种细菌的最小抑菌浓度(MIC),可以发现对于金色葡萄球菌的MIC最低(60 μg/mL),对于铜绿假单胞菌的MIC最高(120 μg/mL),对于其他4种细菌的MIC均为80 μg/mL。

表2 重组CilyC对受试菌株的最小抑菌浓度Table 2 Minimum inhibitory concentration(MIC)of the recombinant CilyC against different test bacteria

图9 重组菌株培养液上清对革兰氏阳性和阴性细菌的抑菌活性Fig. 9 Antibacterial activities of the recombinant strain culture supernatant against Gram-positive and Gram-negative bacteria
3 讨论
本研究通过构建重组毕赤酵母菌株X-33/pPICZαA-CilyC,首次实现了基于重组毕赤酵母的草鱼C型溶菌酶生物合成。通过PCR扩增到目的基因“CilyC”后,对其编码的重组CilyC蛋白的三维结构预测显示:一级结构中相距甚远的8个半胱氨酸残基形成的4对二硫键将6个α螺旋、3个β折叠和无规卷曲等二级结构单元缔结在一起,使重组CilyC形成了一个紧密椭球状的空间结构,这样稳定的结构确保了其拥有生物学活性的结构基础;进一步的抑菌试验也证实了这一推论。就实际生产时的成本和操作简单化而论,不可能对培养液上清进行纯化处理;则培养液上清是否具有抑菌活性显得至关重要。本研究通过平板涂布法证明含重组CilyC的培养液上清对于4种革兰氏阳性细菌和两种革兰氏阴性细菌具有明显的抑菌活性,与基于最小抑菌浓度(MIC)测定法的纯化重组CilyC的抑菌试验结果是一致的;这就意味着重组菌株 X-33/pPICZαA-CilyC的培养液上清可直接作为生产天然抗菌剂的原液而无需对其进行繁琐的纯化处理,符合大规模生产的需要。上述抑菌效果与我们之前报道的来自三疣梭子蟹和鲤鱼的C型溶菌酶的抑菌效果相似[14-15]。而来自鸡蛋清的C型溶菌酶仅对革兰氏阳性细菌具有强大的抑菌活性,由此可以初步确定水产生物来源的C型溶菌酶具有更为广泛的抑菌谱。但本研究获得的重组CilyC对于革兰氏阴性的副溶血性弧菌和大肠杆菌并未显示明显的抑菌活性,曾有学者报道了大菱鲆(Scophthalmus maximus)C型溶菌酶对革兰氏阳性细菌的抑菌活性高于革兰氏阴性细菌[3]。以往的研究已经明确溶菌酶的作用机理是破坏细菌细胞壁中N-乙酰胞壁酸与N-乙酰氨基葡萄糖之间的β-1,4糖苷键;而革兰氏阴性细菌细胞壁的肽聚糖层比革兰氏阳性细菌的薄得多,且还被一层外膜包围[21],因此可能会阻碍溶菌酶的进入。已有研究表明:通过融合蛋白的方法可以改善溶菌酶的体外抗菌活性和抗菌谱,Lu等[22]将人溶菌酶(Hly)与天蚕素(Mdc)在大肠杆菌中进行融合表达,证明重组Hly-Mdc的抑菌谱明显变广;Zhao等[23]在毕赤酵母中表达了人溶菌酶(Hly)与parasin I(从鲶鱼皮肤中分离到的一种抗菌肽)的融合蛋白,发现重组Hly-parasin I弥补了人溶菌酶对大肠杆菌无抑菌活性的缺陷。据此,后续研究将致力于构建含草鱼C型溶菌酶与其他小分子抗菌肽融合表达载体的重组毕赤酵母菌株。
通常,基于多拷贝表达菌株的产生是一种提高毕赤酵母产重组蛋白产量的常规技术,但在电转过程中产生基因高拷贝数的频率较低,因此需要在大量的菌落中筛选基因量高或产物表达量高的重组菌株[24]。本研究在筛选高拷贝重组毕赤酵母菌株时,用于评估目的基因CilyC高拷贝数的标准为重组菌株在含1 000 μg/mL博来霉素培养基上的良好生长能力;经该标准筛选到的优良菌株产重组CilyC的量为13.7 mg/L,较之前基于重组毕赤酵母表达的斑点叉尾鮰C型溶菌酶的产量高了近5倍[13]。然而,有学者报道,他们通过使用经密码子优化后的人C型溶菌酶6(LYZL6)的cDNA,在30 L发酵罐中进行125 h高密度发酵,最终重组LYZL6的产量高达331 mg/L[25]。由此推断,重组CilyC产量较低的原因之一可能源于目的基因“CilyC”为天然cDNA,经Graphical Codon Usage Analyser(http://www.guca.schoedl.de/)检测,CilyC中存在7个毕赤酵母的低频密码子;另一方面,摇瓶发酵本身通氧量难以控制、流体状态相对较差,这些缺陷也会大大影响发酵的效果。因此,如何对编码草鱼C型溶菌酶的cDNA进行密码子优化,并在本研究的基础上先通过小型发酵罐探索大规模发酵培养的条件也是后续研究中必需解决的问题。
4 结论
本研究构建了产草鱼C型溶菌酶CilyC的重组毕赤酵母菌株X-33/pPICZαA-CilyC,对该菌株的最适诱导表达条件为:29℃、250 r/min、1.0%甲醇浓度、96 h,在此条件下获得产量为13.7 mg/L的重组CilyC。基于平板涂布法和最小抑菌浓度(MIC)测定法的抑菌试验结果表明:重组CilyC具有明显的抗革兰氏阳性的金黄色葡萄球菌、枯草芽孢杆菌、单增李斯特菌和蜡样芽孢杆菌以及革兰氏阴性的沙门氏菌和铜绿假单胞菌的生物学活性。
