组织蛋白酶L生物学功能的研究进展
2021-02-07赵国春裴志花李晓涵
赵国春,裴志花,李晓涵
(1. 吉林农业大学,吉林 长春 130118;2. 动物生产及产品质量安全教育部重点实验室,吉林 长春 130118)
组织蛋白酶(cathepsin)在1920年由Lanner首次发现,它广泛存在于动物各种组织细胞内,在维持动物正常生命活动中扮演着重要角色。根据酶的催化机制,组织蛋白酶分为以下4大类:金属蛋白酶、丝氨酸蛋白酶、天冬氨酸蛋白酶和半胱氨酸蛋白酶。除此之外,还有谷氨酸蛋白酶、苏氨酸蛋白酶和一些尚未进行分类的蛋白酶。根据组织蛋白酶代表底物还可以分为L、B1、D、E、F、FG、GF、G、H、S等几大类,如表1。
1973年,人们首次提出CTSL,Etsushiro等通过Sephadex或蔗糖梯度凝胶层析法分离纯化猪肾中的2种不同的组织蛋白酶A,在纯化过程中将组织蛋白酶A分为不同分子量大小的片段,分别命名为CTSL(分子量较大的组织蛋白酶A)和组织蛋白酶S(分子量较小的组织蛋白酶A)。在随后十多年里,科学家又从大鼠肝脏、兔骨骼肌、人肝脏中分离纯化出CTSL,并且证明人CTSL与大鼠和兔CTSL相似。近年来,随着分子生物学的发展以及先进的分析仪器的出现,国内外学者对于CTSL的研究逐步深入,发现它与肿瘤、心肌病以及吸虫病等密切相关,是近年来饱受关注的一类靶标蛋白酶。但是,我国对CTSL的相关生理特性研究相对较少。本文就CTSL的结构与功能、生物合成途径、生物学效应以及在人体和畜牧生产中的应用进行综述,为CTSL的深入研究提供理论依据。
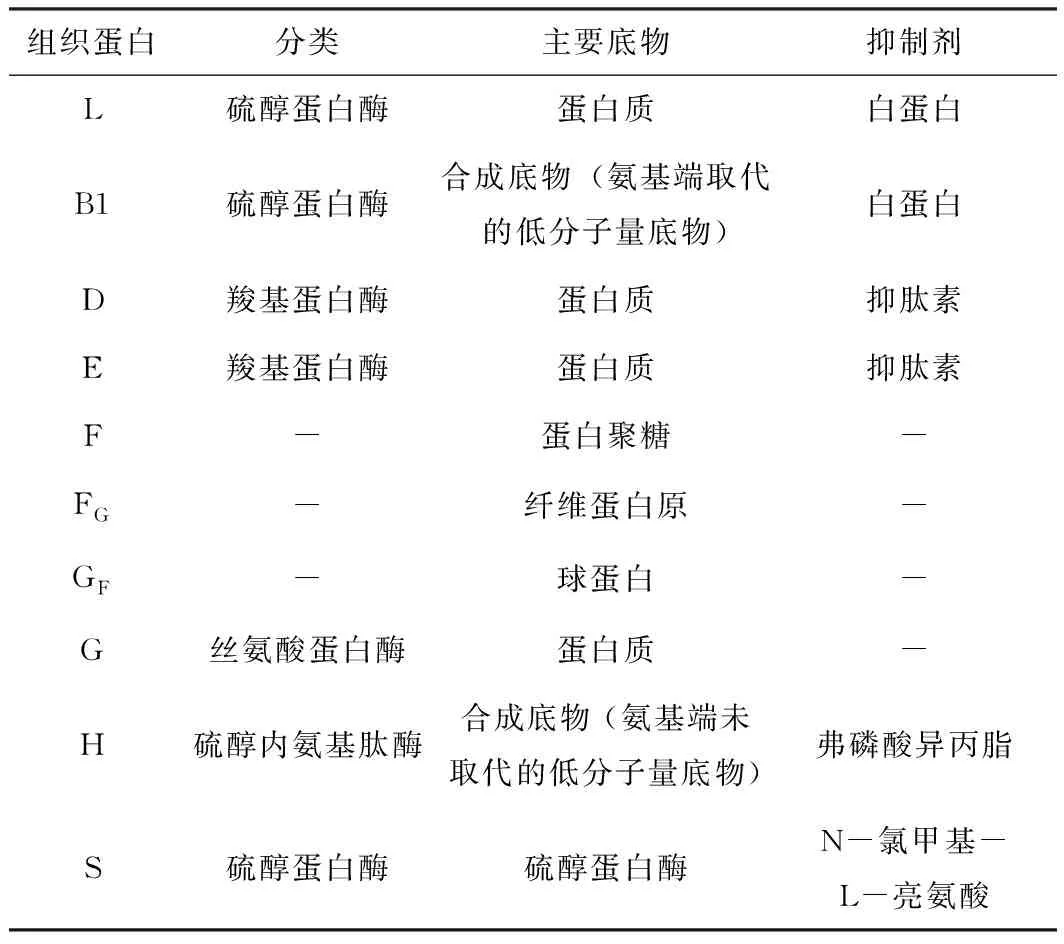
表1 根据代表底物对组织蛋白酶进行分类[1]
1 CTSL的结构
CTSL前体的起始由两部分组成:N-末端球状结构域和C-末端延伸结构。N-末端球状结构域与成熟结构域的组氨酸(His140)至天冬氨酸(Asp155)的环相互作用,C-末端延伸结构位于活性位点裂隙中。CTSL结构与木瓜蛋白酶类具相似的折叠,在成熟CTSL的220个残基中,183个Cα原子可与木瓜蛋白酶相应Cα原子重叠。CTSL的结构中包含2个域,左(L-)和右(R-),L结构域是α螺旋,而R结构域形成β桶状折叠,这些结构域在“V”形活性位点裂口顶部分开,α螺旋保守残基半胱氨酸25(Cys25)和β桶状折叠的组氨酸163(His163)处于V形裂隙的中部,在该结构域中,Cys25残基突变为丝氨酸以消除其活性,每个结构域,最终形成酶的催化位点[2]。CTSL的4个活性结合位点分别为S′、S1、S2、S3。CTSL的S′区域类似于木瓜蛋白酶的S′区域,呈现为浅凹陷状而不为常见酶类的裂缝状;S1亚基位点呈环状,且由S3和S2′的部分环构成,并且在顶部由保守二元桥Cys22和Cys63所包围;CTSL的S2亚基位点深且疏水,CTSL的S3亚基位点在裂隙左壁中间区域,该亚基位点中心有1个扩展的甘氨酸67(Gly67)和Gly68结构,被天冬酰胺66(Asn66)、谷氨酸63(Glu63)和亮氨酸69(Leu69)的侧链以及Gly61的羰基氧包围[3]。
不同物种的CTSL结构存在较大差异。Tsunemoto等[4]对于鲤鱼的CTSL结构研究发现,鲤鱼CTSL与虹鳟CTSL的一致性为82%,但是与哺乳动物CTSL的一致性却只为62%~69%,哺乳动物的CTSL的P1加工位点为丝氨酸(亲水性氨基酸),易被丝氨酸蛋白酶水解成双链形式,而鲤鱼的CTSL因在关键区域存在缬氨酸29~天冬氨酸295(Val29~Asp295),P1加工位点为Val,该差异导致鱼类CTSL所以不太可能加工成两链形式。哺乳动物CTSL的39 kDa前体最终通过溶酶体半胱氨酸蛋白酶快速转化为23 kDa双链形式[5]。相比之下,鲤鱼CTSL保持单链形式,没有加工成两链形式。在加工位置上的氨基酸性质可能决定了哺乳动物与鱼类CTSL的差异。
2 CSTL的生物合成及体内转运
CTSL位于初级溶酶体,在细胞核和细胞外也有发现,CTSL从mRNA内下游AUG起始位点开始翻译[6-7]。首先N末端的信号肽指导新生多肽链插入ER。在ER内,信号肽被切割,释放出含有前体肽和成熟肽的酶原,CTSL蛋白质在前体肽的帮助下进行卷曲折叠,同时形成二硫键和高甘露糖聚糖的N-联糖基化。在高尔基体内,酶原上甘露糖残基被磷酸化形成6-磷酸甘露糖(mannose-6 -phosphate,m6p)其通过m6p受体将蛋白质靶向到溶酶体腔。经过晚期溶酶体腔的初始酸化后,CTSL被激活,这导致组织蛋白酶前体肽被切割和组织蛋白酶的活化程度加大。到达溶酶体后,经进一步处理,将蛋白水解加工成重链和轻链。甘露糖残基未被磷酸化的CTSL将不会则不会进入溶酶体,而是作为酶原分泌。因组织蛋白酶的过表达极大地增加了该途径中酶的比例,所以甘露糖残基转化为m6p的过程似乎是限速的[8]
3 CTSL的生物学效应
3.1 毛发发育中的作用
脱发是由于毛囊形态发生和周期的改变,毛囊管的扩张和丛毛形成紊乱造成的。对小鼠毛发的研究发现,CTSL在毛发发育中发挥着关键作用。Roth等[9]为研究CTSL在小鼠毛发中的作用,在胚胎干细胞中对该基因进行基因靶向敲除,敲除CTSL基因的小鼠出现周期性脱发和表皮增生、棘皮症(acanthosis)和角化过度。小鼠突变表型主要特征为毛囊上皮细胞和基底表皮角质形成细胞的过度增殖。在对突变体无毛小鼠的CTSL基因研究中发现,小鼠的g149r基因突变导致了蛋白酶失活[10]。对人类毛囊和甲床进行免疫组织化学和免疫荧光试验发现CTSL特异性地表达于毛球和甲床,CTSL能参与到人类毛囊和指甲的终末分化进程中[11]。因此CTSL被证明是表皮稳态、常规毛囊形态发生和循环所必需的第一种溶酶体蛋白酶。通过搜索人类孟德尔遗传在线数据库(OMIM)并未发现因相似原因而导致脱发的人类疾病,因此猜测CTSL在不同生物体内所执行的功能可能也会存在差异。
3.2 生理过程中的关键酶
近年来研究数据表明,新发现的分泌小泡中CTSL是一种用于产生活性脑啡肽(enkephalin)和其他神经递质或激素,例如脑啡肽、促肾上腺皮质激素(ACTH)、α-促黑素细胞激素(α-MSH)、β-内啡肽的蛋白水解加工酶。Yasothornsrikul等[12]研究发现,在嗜铬细胞颗粒中分泌囊泡中CTSL是负责将脑啡肽原转化为活性脑啡肽半胱氨酸蛋白酶。脑啡肽生成时,CTSL需要将其定位于含有前体(PE)和蛋氨酸脑啡肽(ME)的分泌囊泡。在一元和二元激素原加工位点,CTSL通过对蛋白水解加工产生ME。同时还发现,敲除CTSL基因的小鼠脑中ME水平明显低于对照组小鼠,而小鼠脑组织中ME前体的比例升高。这些发现提供了敲除CTSL基因小鼠中脑啡肽前体积累的证据,为CTSL在脑啡肽产生而发挥功能性作用提供支持。除此之外,CTSL能发生蛋白水解作用并且可以通过介导细胞内PGRN(编码谷粒蛋白)蛋白水解,可调节PGRN及其颗粒蛋白片段的水平[13]。据Funkelstein等[14]的研究,CTSL能通过蛋白水解加工促黑素皮质素(POMC)前体而合成垂体激素ACTH,β-内啡肽和α-MSH。CTSL在垂体AtT-20细胞中的表达导致分泌途径中ACTH和β-内啡肽的增加,经CTSL的特异性抑制剂CLIK-148处理的AtT-20细胞则会造成ACTH的产出减少和POMC的积累的结果。糖尿病肾病(diabetic nephropathy, DN)是糖尿病(diabetes mellitus, DM)的最重要的合并症之一,是终末期肾病第二原因。CTSL可能通过参与激活影响DN发展的硫酸乙酰肝素糖苷内切酶活性的机制,促使该酶在肾小球基底膜大量表达,在内皮细胞和足细胞上特异性分解硫酸乙酰肝素,导致这两细胞类型的硫酸乙酰肝素表达降低,导致足细胞损伤,最终产生DN蛋白尿[15-16]。以上研究均表明CTSL对ACTH、β-内啡肽,内切酶的产生与激活均具有重要作用。
3.3 肿瘤疾病标志物
溶酶体CTSL是多种肿瘤疾病中的标志物和潜在治疗靶标的蛋白水解酶。根据Chauhan等[17]的研究表明,癌细胞通过分泌蛋白酶降解细胞外膜成分,从而促进肿瘤的侵袭和转移。对3种鼠黑素瘤变体的观察发现,癌细胞通过CTSL mRNA的持久翻译来维持CTSL的高表达水平,而肿瘤细胞本身就是CTSL mRNA表达升高的来源[18]。Vasishta等[19]测定肿瘤相邻的非恶性组织(A-NM)和远离肿瘤的非恶性组织(D-NM)的匀浆中几种蛋白酶样肽酶的活性,发现肿瘤相邻的A-NM中CTSL的活性显着高于D-NM组织。与正常组织相比,在胃癌、结直肠癌、乳腺癌和甲状腺癌中,也有CTSL酶活性增加的报道,这提示CTSL表达上调与疾病进展有密切关系[20]。同时研究发现CTSL参与卵巢癌细胞的增殖和侵袭,CTSL在卵巢癌(ovarian cancer,OC)中过度表达,CTSL的下调则能显著抑制了人卵巢癌细胞(skov3)的增殖和侵袭能力,而CTSL在ov90细胞中的上调则会产生相反的效果。与OC细胞相比,在裸鼠体内CTSL沉默细胞发育成肿瘤的能力降低,而这些细胞的异种移植瘤生长明显受到抑制[21]。大量文献资料表明癌症组织CTSL的表达水平显著高于正常组织,其中肾和睾丸肿瘤表达的CTSL水平最高,多数乳腺癌表达的CTSL水平较高。CTSL的过表达与人类动脉粥硬化和主动脉瘤(aortic aneurysm,AA)的发生发展同样有着密切联系[22]。重组半胱氨酸蛋白酶抑制剂C具有较高的抗蛋白酶活性,主要通过抑制CTSL活性,达到抑制癌细胞的生长和侵袭的效果[23]。在主动脉瘤中,当不存在半胱氨酸蛋白酶抑制剂C时,CTSL的活性增强,促进了微血管形成、细胞凋亡、白细胞黏附及细胞增殖,从而导致AA病变面积的增大以及动脉管腔直径增大。因此CTSL和半胱氨酸蛋白酶抑制剂C可能与AA存在相关关系[24]。以CTSL结构特点为治疗肿瘤的突破点,中国科学家发现阿斯非芬酯及其类似物能与CTSL形成氢键,与其紧密结合,从而抑制癌细胞的增殖和迁徙[25]。总之,通过敲除卵巢癌细胞和乳腺癌细胞的CTSL基因来减少肿瘤细胞的增殖、迁移和侵袭,增强胶质瘤细胞对放射治疗敏感性[26-27]的方法已逐步为我们所重视。除此之外,在以后的研究中,CTSL极有可能成为人类恶性肿瘤的诊断或预后标志物,这将对恶性肿瘤的提前诊断具有积极的意义。
3.4 维持心肌稳态中的作用
溶酶体CTSL作为心肌内的稳态蛋白酶,是心脏形态和功能的关键,对于维持心脏的正常运行发挥着重要的作用。心肌病(cardiomyopathy)是以进行性心肌重塑为特征的一组异质性心脏病,会导致心脏泵功能受损[28]。据研究发现,缺乏CTSL的心肌细胞含有多个大且明显融合的溶酶体,用于储存电子致密的异质材料,同时发现该小鼠心肌的中间质纤维化和多核化,这两者也都是人心肌病的特征。缺乏CTSL的小鼠显示出明显的心室和心房扩大,且检测到异常心律,如室上性心动过速、室性期外收缩等,超声心动图和心电图检查结果显示小鼠左心室肥大,这很可代表着缺乏CTSL的小鼠对心脏损害的适应性反应[29]。在正常小鼠中,CTSL可通过阻断AKT/GSK3β信号通路,延缓心力衰竭进展,改善心功能,抑制心肌肥厚、炎症和纤维化,而CTSL缺乏则可导致小鼠心功能衰退及梗死后心肌重建,最终有可能发展为晚发性扩张型心肌病(DCM)[28,30]。在对扩张型心肌病研究中发现,DCM患者外周血单个核细胞中CTSL酶活性明显高于健康对照组,CTSL的功能水平与心脏左室功能不全的严重程度有很强的相关性。这表明CTSL参与了扩张型心肌病的发病机制,CTSL可能成为评估扩张型心肌病严重程度的血基标志物[31]。同时小鼠CTSL的缺乏影响新生小鼠心肌细胞的内溶酶体系统。尽管这些囊泡缺乏溶酶体储存材料并且他们的形态也有所改变,但这并不影响酸性细胞器的数量增加。酸性细胞区室缺陷将导致复杂生化和细胞反应以及细胞骨架蛋白和线粒体损伤[32]。CTSL和酸性细胞区室缺乏的,提出了如何改变细胞内信号传导用以诱导肥大反应导致心脏扩张的问题[28]。同时,还有研究发现CTSL还能参与心脏信号转导,减少了用于从受体发出信号的时间跨度和受体再循环的速率。这种信号的提前终止能降低细胞溶质激酶(如AKT)的活化状态,因此降低了受攻击的小鼠心肌的肥大反应[33]。在心脏重塑和修复中也扮演着重要的角色。主要位于溶酶体区室的CTSL,在中性pH条件下,其他蛋白酶(如基质金属蛋白酶)可分泌和激活一部分酶原,其中活化的胞外CTSL也可处理ECM蛋白,如纤连蛋白、层粘连蛋白,这对于心脏重塑和修复极为重要[34]。
3.5 寄生虫病防治方面作用
肝片吸虫病(fasciolosis)是由肝片形吸虫(Fasciolahepatica)寄生引起的人兽共患病,肝片吸虫病在我国是危害最严重、覆盖范围最广的反刍动物寄生虫病之一,不但引起患病动物的生产能力降低,同时还会引起畜产品品质和产量的显著下滑,对畜牧业造成巨大的经济损失[35-36]。因此,如何防治吸虫病成为一个亟待解决的问题。研究发现幼年肝吸虫分泌的CTSL是可行的疫苗靶标[37]。它存在于吸虫属(Fasciolaspp.)的排泄和分泌物中,用重组肝CTSL1蛋白酶对弗西尼亚牛进行免疫接种,与对照组相比,吸虫负荷减少48.2%[38]。同属于半胱氨酸蛋白酶家族的CsCPL可能参与华支睾吸虫寄主蛋白质的营养分解代谢,CsCPL可作为一种潜在的华支睾吸虫疫苗抗原和药物靶标,用来预防和治疗华支睾吸虫感染病[39]。同时据Sansri等[40]的研究发现,接种重组幼年特异性CTSL的小鼠可预防大片吸虫(Cyciolagigantica)感染。在吸虫防治中,有科学家另辟蹊径,在免疫保护试验中利用肝片吸虫的亮氨酸氨基肽酶(leucine aminopeptidase)和CTSL1单独作为抗原,试验效果不尽相同。但Ortega-Vargas等[41]将肝片吸虫FhLAP和FhCL1抗原序列组成嵌合蛋白(rFhLAP-CL1),对绵羊进行免疫,免疫绵羊的rFhLAP-CL1特异性IgG1和IgG2等水平迅速升高,明显高于对照组,表明嵌合蛋白对肝片吸虫感染具有中度保护作用。这提示我们rFhLAP-CL1有做为疫苗的巨大潜力。布鲁氏锥虫可引起一种流行于非洲的家畜血液性疾病——干拿病。该病严重影响家畜的生产生活,对养殖企业造成严重的经济损失。半胱氨酸蛋白酶抑制剂的化学试验证明,TbCATL对布鲁氏锥虫存活至关重要,溶酶体室中的TbCATL是决定半胱氨酸蛋白酶的大部分活性的关键酶。乙烯基砜化合物LU102选择性地抑制了锥虫中TbCATL的活性,从而达到杀死布鲁氏菌的目的,TbCATL抑制剂可能成为未来锥虫药物开发新的方向[42]。
3.6 抗原递呈方面的作用
多项研究表明,CTSL在动物抗原递呈方面发挥重要作用。CTSL在皮质胸腺上皮细胞Ii(固定链)降解和CD4+T细胞选择中发挥着关键作用。CTSL负责质胸腺上皮细胞(cortical thymic epithelial cell, CTEC)的特异性Ii降解后期,而主要组织相容性复合物(MHC)II类抗原表达的关键步骤便是胸腺Ii的降解。内质网中新合成的MHC类分子与恒定链(Ii)结合形成(αβIi)3九聚体,在恒定链胞浆端信号肽引导下,经高尔基体进入上述内吞系统,在那里胸腺Ii被CTSL快速降解,但II类相关的恒定链短肽(CLIP)仍结合在MHCII类分子肽结合槽内;在HLA-DM分子协助下,将CLIP降解,使抗原肽与MHC类分子结合形成抗原肽MHC I类分子复合物;后者转运至细胞表面,供成熟的CD4+T细胞识别[43]。CTSL为我们通过靶向特异性溶酶体酶调控CD4+T细胞和干预自身免疫提供新思路。最近就有学者发现在仔猪感染肺炎支原体期间,通过CTSL参与抗原呈递途径来促进IgA的分泌,导致CD4+T细胞百分比和MHC II分子水平升高,增强猪肺炎支原体(Mycoplasmahyopneumoniae)黏膜免疫,进而为仔猪提供有效保护[44]。
4 总结与展望
自CTSL发现之日起,人们对其性质和结构进行了广泛研究。随着近年来科学技术水平的发展和多种检测手段的更新,人们对于CTSL有了更加深入的认识,并将这些知识应用到临床疾病治疗和药物开发中。在癌症治疗方面,有人利用CTSL的阳离子和亲水性残基可与氧化石墨烯吸附的特性[45],将氧化石墨烯做为该类酶的吸附剂,用于减缓癌症扩散,转移。还有人利用CTSL的抑制剂与该类酶结合,抑制酶的活性,来达到治疗和抑制肿瘤目的。在农业方面,有人利用CTSL做为吸虫疫苗抗原和药物靶标,用于治疗吸虫病,为畜牧业挽回巨大经济损失。总之,只有充分了解了CTSL的生理特性以及CTSL在不同动物机体、不同发育阶段中发挥的作用,才能利用这些特性制定出有针对性的研究方案,更好地为人类和动物疾病的治疗和预防做出贡献。
虽然人们对CTSL的研究已取得了一定的进展,但这只是冰山的一角,CTSL研究仍有许多未知领域需要进一步探索。随着今后研究手段的不断提高,CTSL在癌症治疗、寄生虫病防治和促进神经递质合成等领域必将得到更加深入的发掘,CTSL研究拥有广阔的前景。
