影响家畜耳型变异遗传位点的研究进展
2021-02-06郭家中李鹏飞张红平
郭家中,钟 杰,李鹏飞,李 利,张红平
(四川农业大学 动物科技学院,成都 611130)
耳朵类型(简称耳型)是现代家畜品种的一个重要性状,其主要包括耳朵(耳廓)大小、形状和直立性三个方面的特征[1-2]。在一个家畜品种内,不同个体之间往往具有相同的耳型,且能够稳定地遗传;因此,耳型是家畜品种鉴定的理想表型指标之一。另外,近年来有关动物福利的研究结果表明,耳朵姿势可作为动物情绪评估的重要依据[3-6]。
哺乳动物的耳朵包含内耳、中耳、外耳三部分;其中,外耳又分为外耳道与耳廓两部分。一般而言,哺乳动物出生时,其耳朵形态与结构已基本形成[7]。以人耳为例,内耳、中耳、外耳依次在胚胎期第3、4、5周开始发育;其中,外耳耳廓最早发育成熟,到第20周时,已经具备成人耳廓的基本形态[8]。另外,内耳骨迷路于第23周发育完成,在前庭窗与镫骨底板连接,完成内中耳的整合[9];包含3个听小骨(锤骨、砧骨、镫骨)的中耳腔于第30周形成,并逐渐完成中外耳的整合[10-11]。如果与耳朵发育相关的基因发生突变,则可能会导致畸形耳。例如,周海梅等[12]总结了维甲酸和HOX基因家族对哺乳动物畸形耳的影响。但哺乳动物耳朵发育过程复杂,涉及多个基因,故影响不同家畜品种耳型变异的遗传位点也不尽相同。本文总结归纳了影响猪、绵羊、山羊等家畜耳朵大小、外耳直立性以及小耳畸形等性状遗传位点的研究进展,旨在为家畜遗传育种工作以及人类耳朵相关疾病研究提供参考。
1 影响猪耳型的遗传位点
1.1 影响猪耳朵大小的遗传位点
在养猪业中,大白、长白、杜洛克等著名的商业品种猪的耳型多为直立耳或前倾耳,而中国地方品种猪的耳型一般为长垂耳[13]。为探究影响家猪耳型变异的遗传位点,Wei等[14]依据图像信息,将大白猪和梅山猪杂交的F2代个体的耳朵分为大、中、小三类,最终在5号、7号染色体上分别鉴定到1个与耳朵大小和外耳直立性显著关联的数量性状座位(quantitative trait loci,QTL)。Ma等[15]则利用图像软件准确测定了杜洛克和二花脸猪杂交的F2代个体猪耳面积,最终检测到23个与耳朵质量、面积和直立性呈现显著关联的QTL;其中一个位于7号染色体58 cM区域的QTL与上述三个性状显著关联,这与Wei等[14]的研究结果一致。基于此,Ren等[1]进一步利用同源相同(IBD)定位的方法将该QTL区间缩小至750 kb区域。相比较于该区域内其他8个候选基因,PPARD在皮肤稳态[16]和软骨发育过程中[17]发挥重要作用,该基因的一个错义突变(G>A,G32E)被确定是调控猪耳朵大小变异的一个因果突变。mRNA水平的基因表达量表明,G32E突变降低PPARD的表达,解除了PPARD对耳朵软骨生长的抑制作用,从而间接促进耳朵过度生长,导致猪的耳朵变大[18]。综上所述,PPARD被确定为首个影响家猪耳朵大小的基因(表1)。
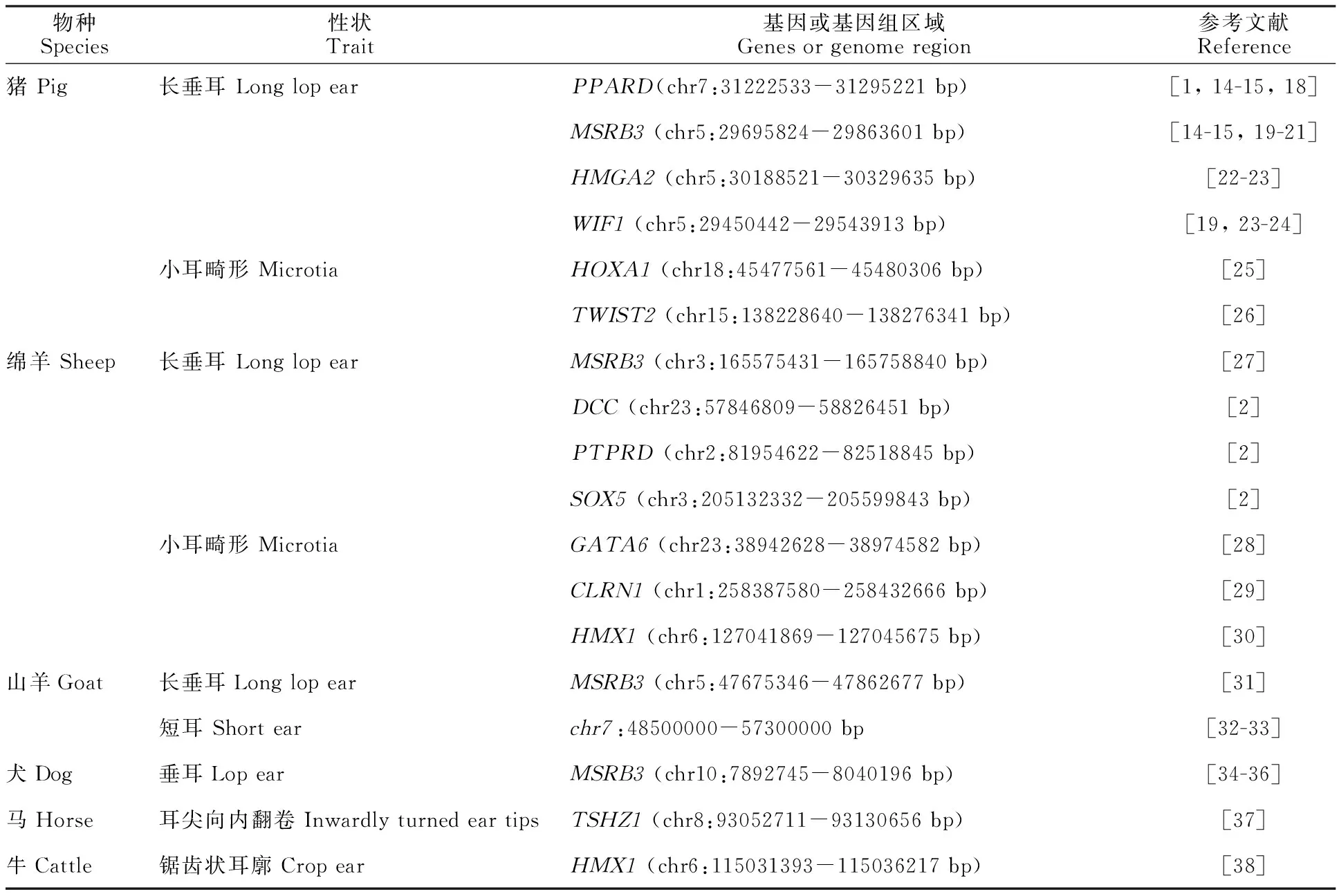
表1 影响家畜不同耳型的遗传位点Table 1 Genetic loci affecting different ear types in domestic animals
除上述7号染色体的QTL,多项研究表明,位于5号染色体30.14~40.92 Mb的基因组区域也是一个影响猪耳型变异的遗传座位,但上述研究所报道的主效基因却有差异[19, 22-24]。Li等[22]基于对HMGA2、SOX5、PTHLH这3个候选基因中7个SNPs位点的关联分析,发现HMGA2的一个SNP位点(g.2836A>G)与耳朵大小相关性最高,从而将HMGA2确定为影响猪耳朵大小的基因。与之不同的是,Zhang等[24]基于对民猪(中国地方品种)和大白猪杂交的F2代资源群体的全基因组关联分析(GWAS)结果,认为LEMD3和WIF1是影响猪耳朵大小的候选基因。进一步研究表明,WIF1的mRNA和蛋白表达量在60日龄大白猪中均显著高于同日龄二花脸猪[19]。由于WIF1基因内的一个错义突变(c.1167C>G)与猪耳朵大小显著关联[23],因此,与HMGA2基因相比,WIF1更有可能是影响猪耳朵大小的一个候选基因。
此外,有研究表明,除基因点突变之外,拷贝数变异也会引起猪耳型变异。Chen等[20]鉴定到1个38.7 kb拷贝数变异(CNV)影响MSRB3基因的最后两个外显子,该变异仅在6个中国本土长垂耳猪和半垂耳猪中存在。基于eQTL分析的结果显示,CNV与miR-584-5p的表达显著关联,而活体和离体的试验又表明miR-584-5p会抑制MSRB3基因的mRNA翻译,从而导致猪耳变大。这项深入系统的研究排除早前研究提出的与家猪耳朵大小相关的候选基因:HMGA2[22]、LEMD3、WIF1[19, 23-24]。与上述研究结果不同的是,Zhang等[21]发现MSRB3的mRNA表达量在60日龄的民猪中显著高于同日龄的大白猪;并且表达量越高的个体,耳廓越大。蛋白水平的证据表明,MSRB3的表达量在60日龄二花脸猪中比同日龄大白猪更高[19]。总的来说,上述研究结果之间的差异可能是由不同的试验动物或者不同的样品采集时间引起的。因此,为进一步探究MSRB3是否在调控耳朵生长及发育过程中发挥作用,有必要深入研究在同一品种内,MSRB3的时间序列表达特征,从而深入理解该基因的功能。
1.2 控制猪耳畸形的遗传位点
小耳畸形是一种先天性外耳畸形,具体表现为耳廓变小甚至外耳完全消失,从而导致听力不同程度的丧失[39]。这种由小耳畸形导致的听力丧失与内耳耳蜗中间细胞早期退化引起的听力丧失不同[40],但人们对其遗传机制知之甚少。在人类上,患有小耳畸形的个体还表现出颅面畸形、小齿畸形、唇腭裂等[41]异常。该结果表明有些基因在胚胎发育早期发挥作用,不仅调控耳朵发育,而且也参与到其他组织器官的发育。
最近,Qiao等[25]利用GWAS分析在沙子岭猪上揭示了HOXA1基因第一外显子的一个突变(c.451delinsTC)使蛋白翻译提前终止,导致HOXA1蛋白的核心结构域残缺,从而引起猪的小耳畸形。Li等[26]利用基因编辑技术,以猪为模型模拟在人类中发现的TWIST2突变(p.E75K)[42],所有基因编辑成功的个体均表现出小耳畸形。类似地,Hai等[43]构建了携带MITF突变(L247S)的巴马香猪模型,该模型猪听力损失特征与人类的听力损失非常相似。上述研究表明,猪可以作为研究与人类耳朵发育异常相关疾病的模式动物。
2 影响绵羊耳型的遗传位点
现有绵羊品种的耳型主要分为短直耳和长垂耳两类,而中国地方绵羊品种的耳型多为长垂耳或半下垂耳[44]。绵羊耳型变异主要分为耳朵大小和形状的变异;有趣的是,基于计算机断层扫描获取的外耳、中耳和内耳的解剖结构显示,绵羊和人类的耳朵在结构上较为相似[45-46]。因此,绵羊耳朵可以作为人类耳朵相关医学研究中的模型。
截至目前,共有7个与绵羊耳型变异相关的遗传位点被报道[2, 27-29]。基于长耳的多浪绵羊与短耳的迪庆绵羊的SNP芯片数据,Wei等[27]利用GWAS分析检测到3号染色体上MSRB3基因内的一个SNP位点在两个群体间表现出巨大的等位基因频率差异,认为该位点与绵羊的耳朵大小关联。最近,Gao等[2]利用一般线性模型和全基因组高效混合模型(GEMMA),对耳朵大小不同的115只多浪绵羊进行GWAS分析,鉴定到DCC、PTPRD、SOX5共3个与绵羊耳朵大小显著关联的候选基因。
在绵羊小耳畸形方面,Jawasreh等[28]基于GWAS的研究表明,位于23号染色体GATA6基因上游的一个SNP位点是导致阿瓦西绵羊(Awassi sheep)小耳畸形的因果突变;这与GATA6基因调控脊椎动物软骨组织发育的功能相一致[47]。Mastrangelo等[29]综合利用GWAS和比较基因组学研究方法,确定1号染色体上CLRN1基因第3内含子区域的一个SNP位点(rs419889303)与贝里斯山谷绵羊(Valle del Belice sheep)小耳畸形显著关联。由于CLRN1是Usher综合征(先天神经性耳聋)的致病基因之一[48];因此,CLRN1被初步认为是引起绵羊耳朵畸形的一个候选基因[29]。最近,He等[30]采用病例-对照设计的GWAS研究,在畸形耳阿勒泰羊的HMX1基因增强子区域鉴定到一个 76 bp的片段重复,初步确定该变异与畸形耳性状显著关联。
3 影响山羊耳型的遗传位点
在全世界现有的山羊品种中,原产于非洲地区的山羊品种多为长垂耳类型;而亚洲地区的多为短直耳类型[44]。例如,中国成都麻羊、太行山羊、中卫山羊等地方品种[49]。总体而言,目前关于山羊耳型变异的遗传研究相对较少。Kumar等[31]利用SNP芯片研究7个巴基斯坦本土山羊品种间的遗传变异,发现MSRB3基因与山羊耳朵大小相关。Brito等[32]为鉴定控制拉曼查山羊短耳性状的遗传位点,将努比亚、波尔等长耳山羊品种作为对照,在全基因组水平检测到7号染色体的48.5~57.3 Mb区域最有可能与山羊短耳性状关联;虽然该区域内存在CXCL14、POU4F3、NDST1等与耳朵发育相关的基因[32],但因果突变尚未被确定。最近,钟杰等[33]在西藏仲巴县帕江乡的藏山羊群体中,发现部分山羊的耳朵发育不完全、外耳较小,总体上与拉曼查山羊的耳型相似;比较基因组学分析结果显示,7号染色体45.05~59.76 Mb区域在正常耳和小耳型藏山羊之间存在显著的遗传分化;这与Brito等[32]在拉曼查山羊上的研究结果一致。简言之,上述研究初步表明,该基因组区域是影响山羊耳型变异的一个遗传位点。
4 影响其他家养动物耳型的遗传位点
关于耳型变异的遗传位点在其他家养动物中亦有报道。例如,Boyko等[34]利用915只家犬(80个品种)、83只灰狼、10只非洲犬的基因组芯片数据以及57个性状的表型数据,开展GWAS研究;最终确定MSRB3基因上游100 kb区域与家犬的垂耳表型显著关联。Vaysse等[35]基于12个直立耳和15个垂耳家犬品种的GWAS分析,鉴定到23个SNPs位点与垂耳表型显著关联,其中最显著的SNP位于HGMA2与MSRB3基因之间。近年来,Webster等[36]对46个不同耳型的家犬品种进行了GWAS分析,同样鉴定到该位点与垂耳表型关联。综上所述,MSRB3所在基因组区域是影响家犬耳型变异的遗传座位。马作为最早被人类驯化的动物之一,如今已经形成了多个品种[50]。原产于印度的马瓦里马(Marwari horse)是一种耳朵直立,耳尖向内翻卷的特殊品种[51];Jun等[37]在该品种中检测到TSHZ1基因的一个错义突变(p.Ala344>Val)与马瓦里马耳尖向内翻卷有关。虽然已有TSHZ1基因缺陷导致小鼠中耳畸形的报道[52],但Jun等的研究仅使用了1个样本,结果的准确性有待在更大的样本群体中验证。在牛上,部分瑞士高原牛的外耳表现出锯齿状耳廓或耳廓缩短等畸形特征。Koch等[38]基于GWAS分析,首先将因果突变定位于6号染色体的4 Mb区域内,进一步依据全基因组重测序的数据,确定该区域内HMX1基因下游发生的CNV是因果突变,这与阿勒泰羊畸形耳的形成原因一致[30]。
5 小 结
尽管从分子机制角度,耳朵的生长发育过程受到多基因协同调控,但基于全基因组水平的研究结果表明,影响家畜耳型变异的候选基因主要包括MSRB3[14-15, 19-21, 27, 31, 34-36]、PPARD[1, 14-15, 18]、HMX1[30, 38]等。尤其是,MSRB3在猪、绵羊、山羊、犬上均有报道;最近,Mastrangelo等[53]的研究表明,MSRB3基因变异与绵羊的脂肪沉积相关。因此,可以推测该基因变异导致脂肪沉积过程异常,从而造成家畜耳朵变大、下垂。
总体来说,借助全基因组遗传多态性数据以及基因表达数据,现有研究鉴定到多个影响家畜耳型变异的遗传座位,增强人们对家畜耳朵发育机制的理解。尽管如此,上述研究仍存在诸多分歧。例如,对于耳型属于质量性状还是数量性状尚无定论;在一些研究中,耳型被视作质量性状[27, 31-32, 34],简单地划分为三类(大、中、小)。显然,利用定量手段准确测定耳朵的面积则有利于提高分析的准确性。因此,一些研究利用图像处理软件等工具准确测定家畜(例如,猪)耳面积,将其作为数量性状进行分析[1, 15, 18, 20, 22]。另外,有些研究使用的样本量太少,相关结果需要在更大的样本群体中进行验证。同时,在已有研究中,人们针对耳朵大小、直立性等性状分别进行统计分析;但考虑到这些性状间的遗传相关,采用多性状统计分析模型理论上更为合理。此外,甲基化测序、三维基因组(例如,Hi-C)等系统性研究技术的应用,将会提高因果突变的鉴定及分子机制研究的准确性和效率。因此,综合运用现代遗传学的各种方法和技术,将有助于全面解析家畜耳型变异机制,从而为家养动物遗传育种工作以及人类耳朵相关疾病研究提供参考。
