SARSMERS及COVID-19的临床特点和器官损伤研究进展
2021-02-05骆亚莉王碧雯安方玉汪永锋综述刘永琦审校
骆亚莉,王碧雯,安方玉,汪永锋(综述),刘永琦(审校)
近二十年来世界范围内发生了严重急性呼吸综合征(severe acute respiratory syndrome,SARS)、中东呼吸综合征(Middle East respiratory syndrome,MERS)以及新型冠状病毒肺炎(2019 corona virus disease,COVID-19)等由β-属冠状病毒感染所致的严重传染病。截至2020-06-11,COVID-19确诊84 647人,死亡4 645人。鉴于三种冠状病毒严重急性呼吸综合征冠状病毒(severe acute respiratory syndrome coronavirus,SARS-CoV)、中东呼吸综合征冠状病毒(Middle East respiratory syndrome coronavirus,MERS-CoV)与严重急性呼吸综合征冠状病毒2型(severe acute respiratory syndrome coronavirus 2,SARS-CoV-2)在基因序列上存在同源性,通过分析对比三种病毒的发病特点及系统器官损伤,有助于对COVID-19的临床诊治深入开展研究。
1 SARS、MERS和COVID-19的临床发病特点
SARS患者初始阶段发生相对轻度的症状,通常有发热、畏寒、头痛、咳嗽、肌肉痛、关节痛和腹泻等症状[1]。MERS患者临床表现最常见的症状是发热、咽痛、咳嗽、寒战、胸痛、头痛、肌肉痛、呼吸急促。迅速发展为急性肺损伤和急性呼吸窘迫综合征(acute respiratory distress syndrome,ARDS)、多器官衰竭甚至死亡,常伴有较显著的急性肾损伤和胃肠道症状[2]。COVID-19最常见的临床表现包括发热(91.7%)、咳嗽(75.0%)、疲劳(75.0%)和胃肠道症状(39.6%)等[3]。三者的临床表现大致相同,在此对发病特点进行列表对比。见表1。
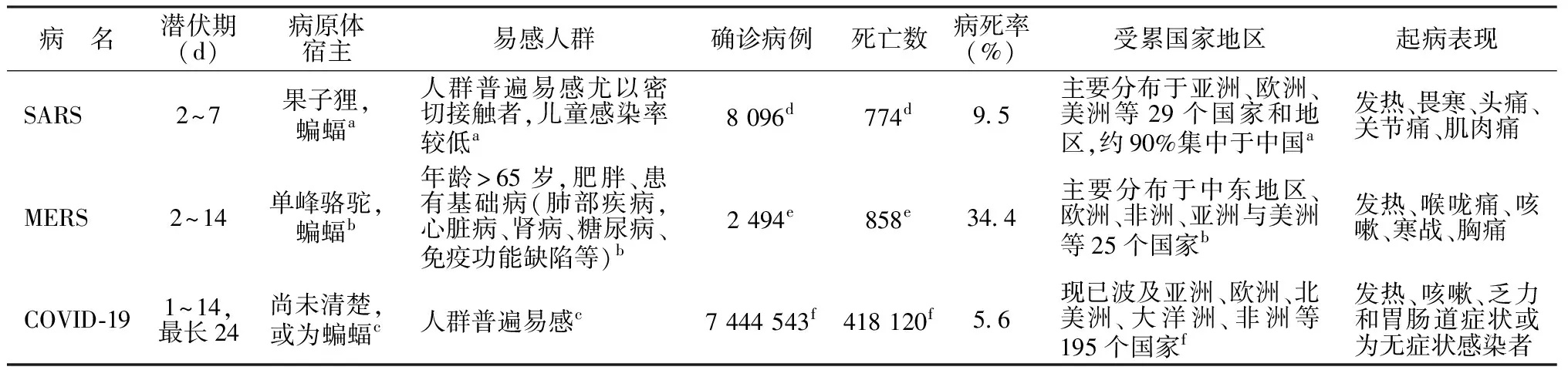
表1 SARS、MERS和COVID-19的临床发病特点[1~5]
2 SARS、MERS、COVID-19所致的肺损伤影像学、病理学和实验室变化特征
2.1SARS 肺部X线及CT结果显示,多数患者具有特征性的表现。X线片表现异常,早期病灶以单侧、肺外带及肺下区分布多见,边界不清,随访可显示多发病灶、病灶密度变实,CT上表现为单侧或双侧胸膜下磨玻璃样密度影(ground-glass opacity,GGO)、GGO伴实变、网格征及细支气管牵拉性扩张。病理学观察肺脏重量增加,明显肺水肿,不同范围实变、局灶出血,个别病例在肺血管内可见血栓栓塞。镜下主要表现为弥漫性肺泡损伤(diffuse alveolar damage,DAD)。病程短于10~14 d者以肺泡腔渗出、透明膜形成、间质水肿为主要特点[1]。病程超过10~14 d者以Ⅱ型肺泡上皮细胞增生、腔内机化、上皮细胞鳞化为主要病变特点。部分病程超过20 d的患者则以急性纤维素性机化性肺炎(acute fibrinous and organizing pneumonia,AFOP)为主,其特征表现是肺泡腔内纤维蛋白球形成及机化样疏松纤维组织增生,临床意义尚不明确。病程超过2周的部分患者出现不同程度的肺纤维化。肺纤维化程度可能与病程存在相关性[6]。肺小血管损伤在SARS死亡患者发生较普遍,肺内微血管有透明血栓形成甚至较大血管的血栓栓塞伴出血性梗死表现。有报道显示SARS肺泡腔内可见不典型的肺泡上皮细胞,表现为细胞增大、大核、胞质双嗜性颗粒以及核仁明显,部分形成多核合体细胞[6,7]并在其中检测到SARS-CoV核酸。见表2。研究显示SARS患者肺间质内浸润的淋巴细胞大多数为CD8+细胞,杂以少数CD4+及CD68+细胞,可见少数CD57+及HLA-DR+细胞,提示SARS所致肺内免疫反应类型以细胞免疫反应为主,可能具有清除受感染细胞内病毒病原体及诱发肺组织免疫损伤的双刃剑作用[8]。
2.2MERS 患者肺部X线并无特异性表现,具有空气间隙混浊、节段性、叶状或斑片状实变等。最常见的胸部X线平片表现是磨玻璃影,其次是实变影,较常分布于肺外带及右肺下区。CT显示以双侧基底和胸膜下空隙受累为主,伴有广泛的GGO、实变及网格征,多分布于肺外带。疾病后期,常出现气胸及胸腔积液[2,9]。肺组织病理学观察主要表现为严重急性出血性肺炎和渗出期DAD。病理学改变严重程度不一。在损伤较轻的区域,肺泡腔和肺间质中含有不同数量的吞噬色素的肺巨噬细胞和散在的单核炎症细胞。纤维蛋白主要沉积在肺泡腔内且数量不一。在损伤严重的区域,肺泡腔呈现扩张,充填大量血液和纤维蛋白,伴随炎性细胞浸润和细胞碎片。形成明显的肺透明膜。Ⅱ型肺泡上皮细胞增生或脱落,少见多核合胞体细胞。肺泡壁充血水肿,肺泡内有大量淋巴细胞浸润,而浆细胞、中性粒细胞以及巨噬细胞减少。肺实质内有CD3+、CD4+和CD8+T淋巴细胞,内皮下以CD4+T淋巴细胞为主[10]。可见融合区实质坏死。未发现病毒包涵体。支气管上皮剥脱,黏膜和黏膜下表现为轻度至中度淋巴细胞浸润,黏膜下腺体局部坏死。电镜观察进一步提供了肺细胞损伤的证据,包括提示凋亡的细胞脱离和胞膜发泡现象,以及由纤维蛋白和基底膜组成的透明膜包裹感染变性的肺泡上皮细胞等现象[9,10]。见表2。MERS-CoV免疫组化和双染技术显示病毒抗原主要定位于Ⅱ型肺泡上皮细胞和上皮合胞细胞[11]。尽管MERS-CoV感染的发病机制尚不清楚,但上述研究为确定肺上皮细胞是重要靶点提供证据,提示直接的细胞病变导致呼吸症状出现。然而,MERS-CoV的免疫组化染色呈斑片状,提示免疫功能障碍等其他原因可能与此有关。黏膜下腺体中检测到MERS-CoV抗原,也有助于解释病毒进入呼吸道分泌物进行传播的机制。
2.3COVID-19 X线对于早期的磨玻璃样变化容易漏检,检测敏感性及特异性均较低。CT表现主要特点是GGO和实变影随机分布[12],对早期筛查疑似病例有重要意义。随着病情发展GGO逐渐减少,实变病灶先增多后保持一段时间稳定。随着住院治疗时间延长,病情得到控制,肺内出现特征性的纤维索条影[12,13]。肺纤维化的程度和持续时间还未见报道。此外,无症状感染者肺部CT以GGO为主要表现,病灶多分布于肺外周胸膜下,下肺叶多见,且累及2个及以上肺叶。少数(5%)患者肺部CT影像表现为实变影,考虑由于无症状造成疾病进展而未能及时检查,肺泡内炎性渗出物增多直至发展到实变[12]。SARS-CoV-2与肺部上皮细胞膜表面血管紧张素转换酶-2(angiotensin-converting enzyme 2,ACE-2)受体结合可导致急性肺损伤、肺水肿甚至肺出血。早期可出现肺间质内淋巴细胞浸润,间质血管扩张、充血;肺泡上皮细胞肿胀,肺泡腔内浆液渗出。进一步发展肺泡上皮细胞变性坏死、脱落或鳞化。肺泡腔内出现单核细胞或多核巨细胞、淋巴细胞及浆细胞浸润、纤维素渗出,纤维素与坏死的上皮细胞形成透明膜。严重者出现程度不等的出血性肺梗死、小血管增生、管壁增厚、管腔狭窄闭塞,甚至微血栓形成[13]。肺内支气管部分黏膜上皮细胞脱落,小气道及肺泡内存在大量的黏稠分泌物溢出现象,提示病毒主要引起深部气道和肺泡损伤为特征的炎性反应[14]。大量黏液引起阻塞型通气障碍,严重影响呼吸功能。有学者认为COVID-19的Ⅱ型上皮细胞坏死、脱落程度不及SARS严重。肺部纤维化及实变均不如SARS导致的病变严重,而渗出性反应较SARS明显[15],可能与病程时间长短有关,还有待研究证实。急性肺损伤进一步发展形成急性呼吸衰竭即ARDS,表现为进行性呼吸窘迫、动脉血氧分压(arterial oxygen partial pressure,PaO2)下降,呼吸功能严重障碍甚至死亡。重症和危重症患者病变以下呼吸道炎症为主,且呼吸道样本核酸阳性持续时间长[16]。见表2。
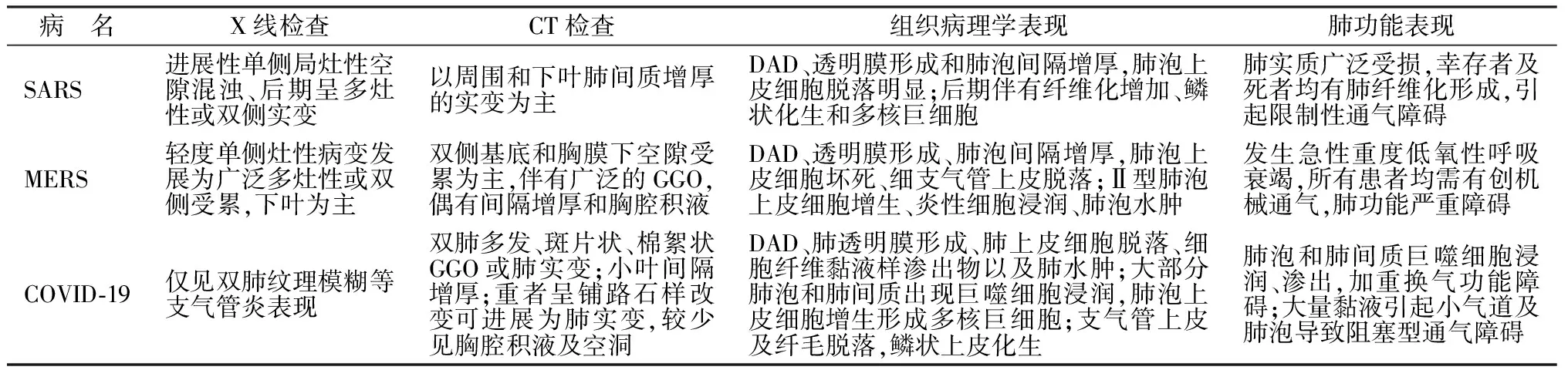
表2 SARS、MERS、COVID-19的肺损伤比较[6,10,12~15]
3 SARS、MERS、COVID-19的肺外脏器损伤的病理生理变化
3.1SARS 通常出现免疫系统受累、胃肠道、肝脏等器官功能障碍[17],可能与免疫损伤、器官存在受体的高表达或血液播散等有关。部分研究显示,也可能对心、脑、泌尿系统造成感染。SARS-CoV可广泛传播于血液、脾脏和淋巴结的免疫细胞,特别是T淋巴细胞、单核细胞和巨噬细胞。淋巴细胞减少是SARS的最早变化之一[18]。感染早期,淋巴细胞的破坏易导致急性免疫损伤、免疫系统功能障碍,引起急性感染和严重呼吸综合征。约29%~39%的SARS患者有腹泻等消化道症状[19],小肠、结肠黏膜上皮细胞检测到病毒感染[20],但胃和食道上皮细胞未发现,考虑病毒可能并非经过食道和胃下行感染肠道,而是通过感染的免疫细胞经循环到达肠道。肝脏也发现了病毒RNA[21]。消化系统的感染可能与SARS-CoV的受体ACE-2的表达分布有关[22]。研究[21]发现心脏中检测到病毒RNA。即使没有基础心脏病的SARS患者也常见发生可逆性舒张性左心室损伤,可能与全身炎症性免疫反应有关。Gu等[7]报道患者出现脑水肿和散在的红色神经元,未确诊病例脑内未见病毒序列和病理改变,提示可能对中枢神经系统造成损伤。患者尿液中也检出病毒[20]。见表3。
3.2MERS MERS进展迅速,病死率高。常合并多器官衰竭,在肾、肝、胃肠道、心、脑和血液均有表现[23,24]。急性肾损害是早期报道中最显著的特征,多数患者出现的急性肾损害需肾脏替代治疗[24]。这是其他人类冠状病毒感染所不具备的独特临床特征。肾脏感染可能与表达MERS-CoV受体二肽基肽酶4[25]有关,肾脏感染以及诱导肾细胞凋亡可能与Smad7和成纤维细胞因子2的表达变化有关[26]。部分患者出现腹泻、呕吐等症状。部分患者粪便检测到低水平的病毒RNA[27]。重症患者可出现意识改变和磁共振成像弥漫性脑异常表现[28],中枢神经系统感染还有待证实。MERS还可导致肝功能障碍、心包炎、心律失常以及贫血、凝血障碍和弥散性血管内凝血等[29]。见表3。
3.3COVID-19 部分患者出现消化功能紊乱,重症可发生心脏、免疫系统及多器官功能障碍[30]。Wu和Mcgoogan[31]对中国44 672例确诊病例进行研究,共有4.2%的患者合并心血管疾病,12.8%的患者合并高血压。22.7%的死亡病例有心血管疾病病史,39.7%有高血压病史,提示合并心血管疾病可能是COVID-19患者预后不良的重要危险因素。而尸检病理结果显示心脏组织间隙中仅有少量细胞单核炎性浸润,无明显的病理变化。临床常见由于呼吸道感染增加心脏负担,在伴有心脏基础疾病时,诱发心功能不全甚至心力衰竭。即使病理检查未对心肌的结构损伤提供支持,考虑部分病例发生心肌炎、心力衰竭与不良预后关联密切,也应重视保护心功能。研究显示患者外周血CD4+T和CD8+T细胞的数量大大减少。但CD4+T细胞中的CCR6+Th17增多,CD8+T细胞具有高浓度的细胞毒性颗粒,T细胞呈现过度激活状态,提示发生严重的免疫系统损伤[32]。《新型冠状病毒肺炎诊疗方案(试行第七版)》中显示:脾脏明显缩小。淋巴细胞数量明显减少,灶性出血和坏死,脾脏内巨噬细胞增生并可见吞噬现象;淋巴结淋巴细胞数量较少,可见坏死。免疫组化染色显示脾脏和淋巴结内CD4+T和CD8+T细胞均减少。骨髓三系细胞数量减少。肝脏体积增大,暗红色。肝细胞变性、灶性坏死伴中性粒细胞浸润;肝血窦充血,汇管区见淋巴细胞和单核细胞细胞浸润,微血栓形成。胆囊高度充盈。Zhang等[33]的研究,在感染COVID-19后,肝脏异常的发生率显著增加,提示SARS-CoV-2可能对肝脏直接具有损伤作用或由于药物治疗的副作用所致,但目前尚无确凿证据支持。研究认为合并肝损害更有可能是重症患者药物不良反应和全身炎症所致[34],应加强肝功能监测和评估。武汉大学中南医院研究[35]显示,10.1%患者最初出现腹泻和恶心,可能与胃肠道存在病毒受体ACE-2或病毒通过损伤免疫系统进而播散至胃肠道有关。见表3。

表3 SARS、MERS、COVID-19的肺外器官损伤的病理生理变化
4 结语
综上所述,SARS、MERS和COVID-19三者均以肺为主要感染器官,以肺泡上皮细胞受累最为显著。重症患者肺部主要病理表现是DAD,病程较短者主要表现为渗出,病程较长者可同步发生渗出、增殖以及纤维化。SARS、MERS常出现肺纤维化,COVID-19可能存在肺纤维化。COVID-19易出现以渗出和浸润为主的炎性反应,且以深部气道和肺泡损伤为特征,黏稠分泌物显著增多。COVID-19与SARS容易发生炎症因子风暴所致的免疫过度攻击,导致免疫器官受损。免疫细胞作为SARS-CoV、SARS-CoV-2攻击的主要靶细胞,诱发严重的免疫功能受损,降低对病毒的清除能力。同时,DAD提示细胞因子炎症风暴的存在。因此,病毒作用导致直接炎症效应,而过度的炎症风暴所致的免疫功能障碍进一步加重损伤作用,二者相互加强不断放大,导致严重后果。MERS除肺损伤之外的急性肾损害发生率较高。心、肝、肾等多器官功能障碍,弥散性血管内广泛微血栓形成及凝血功能紊乱使病情更加复杂化,对重症患者造成致命威胁。COVID-19与SARS表现相似,可能与两种病毒均通过S-蛋白与ACE-2受体相互作用的感染机制有关[36]。但前者传染性更强,可能与病原体的侵袭和定位以及机体对病原体的感应性等多种因素有关。COVID-19肺内病变迅速进展,肺部表现GGO的患者需缩短CT复查时间间隔,及时评估急性肺损伤的进展状况,预防发生ARDS以及多器官功能障碍对于COVID-19的防治具有重要的临床意义。经过我国政府及卫生医疗部门的全力控制,COVID-19疫情暴发状态已得到遏制。目前疫情出现小幅度反弹,但在某些地区仍旧存在每日新增病例和无症状感染者。因此我国各地的复工、复产、复学仍然要做好严密的疫情防控工作。截至2020-06-11中国境外共确诊COVID-19病例3 306 178例,死亡共计413 475例。SARS、MERS以及COVID-19造成的严重后果,意味着与病毒抗争、加强健康防护的相关研究工作任重而道远。
