超高效液相色谱-质谱法测定猪尿中15 种β-受体阻断剂残留
2021-02-05曹旭敏秦立得李木子赵栋皓王丽君武云龙王晓茵王淑婷孙晓亮陈丕英宋翠平赵思俊
曹旭敏,秦立得,李木子,赵栋皓,王丽君,武云龙,王晓茵,王淑婷,孙晓亮,陈丕英,宋翠平,赵思俊
(1.中国动物卫生与流行病学中心,山东青岛 266032;2.山西农业大学,山西太原 030801;3.东营职业学院,山东东营 266109)
β-受体阻断剂是一类人工合成的苯乙醇胺类药物,具有苯乙醇胺或芳氧丙醇胺的基本结构,能与去甲肾上腺素能神经递质竞争β-肾上腺素受体从而发挥拮抗β-拟肾上腺素的作用,产生对心脏兴奋的抑制,从而减慢心率、抑制心脏收缩与传导,被广泛用于人类高血压等心血管疾病的治疗[1-3]。由于β-受体阻断剂具有一定的镇静作用,有时会在体育比赛中被非法使用,因此被世界反兴奋剂组织(World Anti-Doping Agency,WADA)列为禁用药物[4-5]。近年来,个别不法分子为减少动物因长途运输导致的脱水、体重减轻、死亡等情况,使用卡拉洛尔等β-受体阻断剂发挥催眠镇静作用,以减少因动物应激带来的损失,达到非法牟利的目的。而且多数动物进入屠宰场后直接被屠宰、销售,这样动物产品中残留的药物将对人类健康造成严重危害,尤其对患有心血管疾病的人群。为此,欧盟对动物性食品中的该类药物残留限量进行了严格规定[6]。我国在2019 年发布的《食品中兽药最大残留限量》(GB31650—2019)也明确规定了卡拉洛尔在猪组织中的最高残留限量[7]。然而,由于经济利益驱动,卡拉洛尔及其他具有镇静作用的β-受体阻断剂药物在动物养殖、运输过程中仍存在违规、违法使用的风险。目前,针对畜禽的肌肉、肝脏、肾脏等组织以及鱼中β-受体阻断剂残留检测的相关方法较少[3,8-10],主要包括四极杆/线性离子阱质谱、串联质谱、液相色谱等,且这些方法提取净化过程较为复杂、耗时长,因此亟需建立快速、简便测定动物样品中卡拉洛尔等β-受体阻断剂残留的方法。
动物组织样品中基质成分复杂,药物残留通常在μg/kg 水平,对检测方法灵敏度的要求较高,因此样品前处理方法是动物组织中兽药残留检测的关键环节。液液萃取[11]、固相萃取[3,10]、固相微萃取[5]、基质固相分散萃取[8]等方法是目前较为常用的样品净化方法。由于上述方法主要基于待测药物与净化所用吸附剂或溶剂相互作用、分配而达到净化目的[9],无法有效去除与药物性质相似的共萃取杂质,从而造成基质效应强、影响方法的准确定量等难题。而分子印迹技术(molecularly imprint)具有与天然的生物分子识别系统(如酶与底物,抗原与抗体)相类似的特征,能够特异性识别和吸附目标物及其结构类似物,适用于分离、富集复杂样品中的痕量目标物[2,9]。近年来,分子印迹聚合物(molecularly imprinted polymers,MIPs)作为固相萃取的吸附剂在兽药残留检测中受到越来越多关注并被广泛应用[9,12-13]。
由于采集方法简便、快速,且容易操作,动物尿液通常作为大批量样品检测的测试对象[14]。为此,本研究通过建立一种基于分子印迹固相萃取(MISPE)选择性净化,可同时检测猪尿中15 种β-受体阻断剂(阿替洛尔、索他洛尔、卡替洛尔、纳多洛尔、吲哚洛尔、醋丁洛尔、美托洛尔、塞利洛尔、氧烯洛尔、卡拉洛尔、比索洛尔、普萘洛尔、倍他洛尔、丁呋洛尔、奈必洛尔)的液相色谱-质谱(LC-MS/MS)方法,适用于生猪屠宰环节β-受体阻断剂残留量的快速、准确测定。
1 材料与方法
1.1 仪器与试剂
Agilent1290-6470 超效高液相色谱-串联质谱仪,购自安捷伦科技有限公司;5804R 台式高速冷冻离心机、微量移液器,购自德国Eppendorf 公司;超纯水仪,购自美国Millipore 公司。
甲醇、乙腈、甲酸(均为色谱纯),购自德国CNW 公司;氨水(分析纯,25%~28%),购自阿拉丁试剂公司;SupelMIPTMSPE(10 mL,25 mg),购自美国Sigma 公司;GHP 针式滤膜(0.22 μm),购自Pall 公司。
卡拉洛尔(Carazolol,纯度>98.7%)、索他洛尔(Sotalol,纯度>98.5%)、普萘洛尔(Propranolol,纯度>99.5%)、比索洛尔(Bisoprolol,纯度>98.5%)、吲哚洛尔(Pindolol,纯度>99.6%)、阿替洛尔(Atenolol,纯度>99.9%),购自德国Dr.Ehrenstorfer GmbH 公司;卡替洛尔(Carteolol,纯度100%),购自中国食品药品检定研究院;丁呋洛尔(Bufuralol,纯度100%),购自中国药品生物制品检定所;塞利洛尔(Celiprolol,纯度100%),购自Councile of European Pharmacopeia 公司;美托洛尔(Metaprolol,纯度>98%)、醋丁洛尔(Acebutolol,纯度>99%)、倍他洛尔(Betaxolol,纯度>98%)、奈必洛尔(Nebivolol,纯度>98%)、氧烯洛尔(Oxprenolol,纯度>99.6%)、纳多洛尔(Nadolol,纯度>99%),购自Toroto Research Chemical INC公司。各药物的化学结构式见图1。
1.2 标准储备液配制
分别准确称取上述15 种标准品各1 mg,溶于甲醇并定容至10 mL,即为100 mg/L 标准储备液,于-20 ℃冰箱保存。再分别移取适量的标准储备液,用甲醇稀释为1 000 ug/L 混合标准工作液。

图1 15 种β-受体阻断剂的化学结构式
1.3 样品前处理
将猪尿液8 000 r/min 离心5 min,然后将上清液分离备用。移取2 mL 猪尿液加入经3 mL 甲醇、3 mL 水活化的MISPE 柱,依次用3 mL 水、3 mL乙腈淋洗,挤干;最后用4 mL 10%乙酸/甲醇洗脱并收集于试管中,50 ℃水浴下氮气吹至近干,1 mL 0.1%甲酸水/乙腈(V:V=9:1)复溶液溶解,0.22 μm 针式滤器过滤,LC-MS/MS 检测。
1.4 液相色谱-质谱条件
色谱柱:Waters Acquity BEH C18柱(50 mm×2.1 mm,1.7 μm),柱温35 ℃,流速0.3 mL/min,进样量2.0 μL,流动相,0.1%甲酸乙腈(A)和0.1%甲酸(B);梯度洗脱程序为:0~0.5 min,90%~80%A;0.5 1.0 min,80%A;1.0~1.5 min,80%~70%A;1.5~2.5 min,70%A;2.5~3.5 min,70%~50%A;3.5~4.0 min,50%~90%A;4.6~6.0 min,90%A。
AJS 电喷雾电离正离子模式(ESI+):检测方式为动态多反应监测模式(dMRM),毛细管电压3 500 V,干燥气温度250 ℃;干燥气流量7 L/min,鞘气温度325 ℃,鞘气流量11 L/min,碰撞气流量35 psi。
2 结果与讨论
2.1 样品前处理条件优化
本研究采用将尿液离心后直接用MISPE 固相萃取柱净化的方法。而为充分确保本方法的可靠性,还分别比较了使用二氯甲烷[2]、高氯酸[15]等试剂对尿液进行提取再净化的效果。结果发现:使用上述3 种方法对猪尿液进行样品前处理,各待测物的回收率、灵敏度等参数均能满足残留检测方法的要求;而本方法使用的将尿液离心后直接净化的方法,操作简便、快速,化学试剂使用量少。
MIPs 固相萃取净化作为高选择性吸附剂已被广泛应用于农兽药残留检测中,而选择合适的上样、洗涤和洗脱溶液,有利于其选择性吸附样品中的目标分析物,提高仪器分析的灵敏度。上样溶液的介质条件是MIPs 吸附剂与待测目标物之间选择性识别、相互作用的重要影响因子[16-17]。由于MIPs 吸附剂主要通过特有的空间结构及结合位点上的功能基团以氢键与待测物特异性结合,因此上样溶液的pH 是影响目标物与吸附剂作用的关键因素。本研究在前期研究[14]的基础上对净化的上样、淋洗、洗脱进行了优化,最终确定将猪尿液(约pH 7.0)直接上样MISPE 净化,再依次用水、乙腈各3 mL淋洗,最后用10%乙酸/甲醇将待测药物洗脱。
2.2 色谱、质谱条件优化
2.2.1 色谱柱选择 由于β-受体阻断剂药物具有较为相似的化学结构,其理化特性及色谱保留特性也较为相近,因此为了将上述药物在尽可能短时间内有效分离,本试验分别考察了BEH C18(100 mm×2.1 mm)、CSH C18(100 mm×2.1 mm)、HSS T3(100 mm×2.1 mm)不同色谱柱对30 种目标化合物的分离效果。结果(图2)显示,CSH C18、BEH C18色谱柱均可有效分离上述药物;且使用BEH C18柱进行分离时,以0.1%甲酸水溶液和乙腈作为流动相进行梯度洗脱,可获得较好的分离度,且各化合物峰形尖锐。
2.2.2 质谱条件选择 在AJS 电喷雾正离子(ESI+)模式下,分别对15 种β-受体阻断剂药物的标准溶液(1 000 μg/L)进行质谱检测条件优化,通过确定母离子、优化特征离子对、毛细管电压、雾化室温度、碰撞电压等质谱分析条件,分别选取2 对丰度强、稳定的碎片离子作为每个药物的定性与定量离子(表1),以满足欧盟2002/657/EC 委员会决议[18]中有关质谱确证分析的要求。同时,为了提高方法的灵敏度,减少基质干扰,本研究采用动态多反应监测模式(dMRM)进行数据采集,对每个药物进行分段MRM 监测,根据保留时间设置扫描时间窗口(delta retention time),以进一步提高每个药物的滞留时间,提高响应值,同时还可有效降低杂质或其他干扰物质的影响。另外,本方法还将溶剂进入质谱仪的时间延迟1 min。5 min各药物出峰后,将溶剂切出质谱仪,确保极性较强和极性较弱的杂质避免进入质谱仪,因而大大降低了药物基质效应的影响,还减轻了对质谱仪的污染。
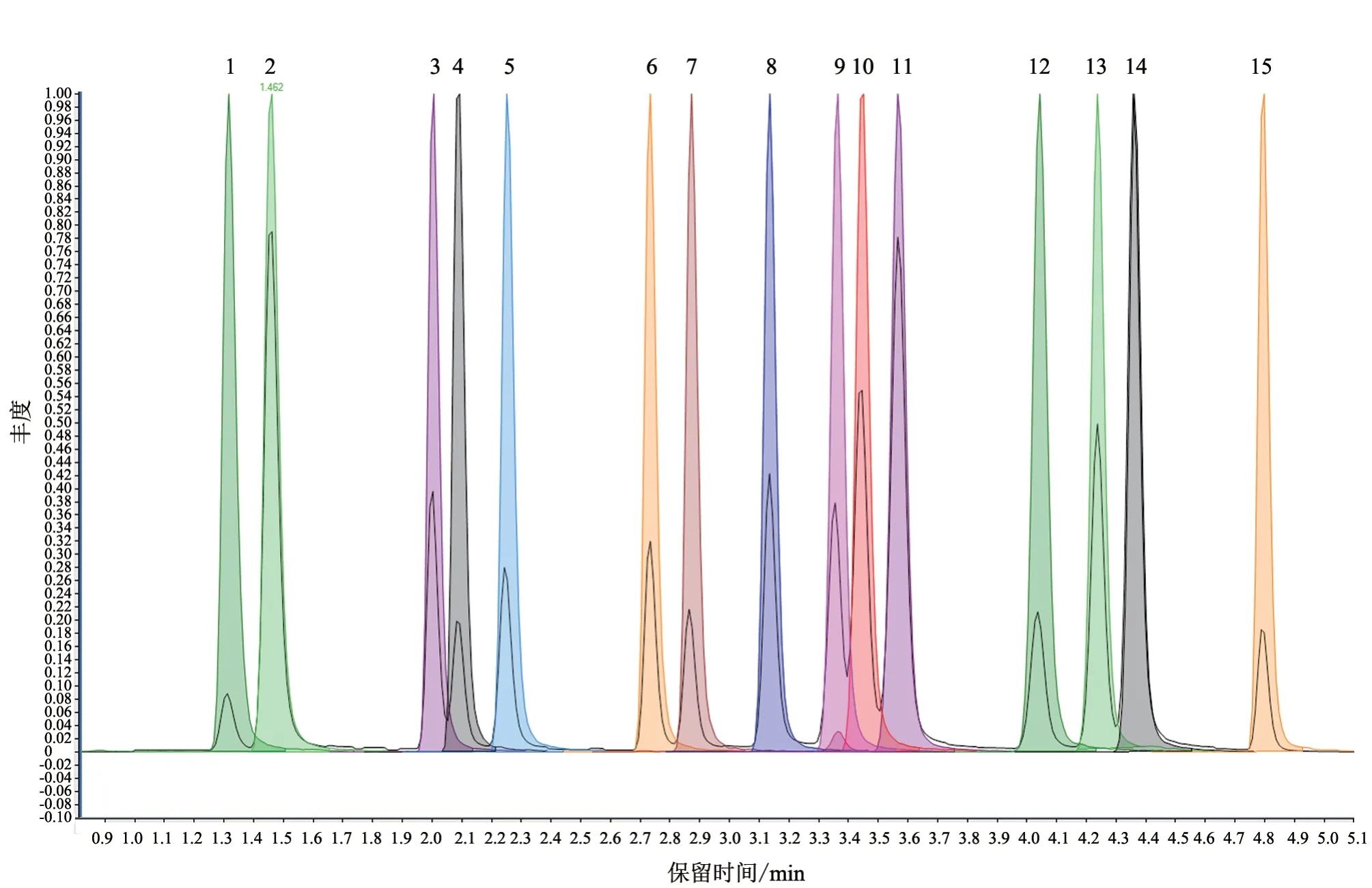
图2 空白尿液添加15 种β-受体阻断剂药物的离子流图(0.1 μg/L)

表1 15 种β-受体阻断剂的质谱监测参数

表2 猪尿中15 种β-受体阻断剂在不同添加浓度下平均回收率、相对标准偏差
2.3 方法学考察
2.3.1 线性关系、检出限和定量限 由于使用的MISPE 柱具有特异性吸附待测物的作用,基质效应低,因此本方法可采用标准曲线进行定量。制备质量浓度分别为0.10、0.25、0.50、1.00、2.00、5.00、10.00 μg/L 的标准工作曲线溶液,以各组分的浓度与其定量离子峰面积进行线性回归,结果发现呈良好的线性关系(R2≥0.996)。通过尿液添加回收试验,确定本方法测定猪尿液中15 种β-受体阻断剂药物的检出限为0.03 μg/L,定量限为0.1 μg/L。
2.3.2 方法的准确度与精密度 采用标准曲线外标法定量,选择定量限1 倍、2 倍、20 倍3 个浓度进行加标回收试验,结果发现,15 种药物的回收率为76.7%~109.2%,批内相对标准偏差(RSD)为2.2%~18.7%,批间相对标准偏差(RSD)为2.1%~19.7%(表2)。
3 结论
本研究通过优化MISPE 柱的上样、淋洗、洗脱条件,建立了选择性好、灵敏度高,可同时测定猪尿液中15 种β-受体阻断剂残留的MISPEUPLC-MS/MS 确证方法;该方法无需复杂的样品前处理过程,通过MIPs 对β-受体阻断剂的特异性吸附,可有效降低基质效应的影响,提高对猪尿液中β-受体阻断剂残留检测的选择性和可靠性。
