貉细小病毒分离鉴定及其VP2 基因序列分析
2021-02-05
(胶州市动物疫病预防与控制中心,山东胶州 266300)
貉 细 小 病 毒(raccoon dog parvovirus,RDPV)属细小病毒科细小病毒属,为无囊膜单链DNA 病毒[1]。其核衣壳由VP1、VP2 和VP3 蛋白组成[2]。一般认为,RDPV 最早由犬细小病毒(CPV)跨宿主感染貉而产生,是CPV 的同属异种病毒[3]。1984 年,我国黑龙江省首次报道发生貉细小病毒性肠炎。1988 年,夏咸柱等[4]从我国不同地区肠炎病貉中分离出3 株RDPV,从而证实我国存在RDPV。2008—2018 年,我国黑龙江、辽宁、山东等省份相继有分离到RDPV 的报道[5-9]。
RDPV 引起的貉细小病毒性肠炎发病率和死亡率较高,严重危害貉养殖业。在幼貉群中,RDPV常呈地方性流行,主要引起发病貉腹泻,导致胃肠炎性变化,剖检可见肠道出血、胃肠黏膜脱落。本研究从山东省某貉养殖场分离到1 株RDPV。为了解RDPV 特性及其致病特点,对其VP2基因进行了序列分析、理化特性研究,以及貉人工感染试验,以期为RDPV 研究及流行病学调查提供数据支持。
1 材料与方法
1.1 病料处理
将采自山东省某貉养殖场腹泻貉粪便,按照1:5的体积比加入适量生理盐水,研磨后10 000 r/min 离心15 min;取上清加入等体积氯仿,室温作用30 min后,12 000 r/min 离心15 min;弃去氯仿,将病毒液经0.22 μm 过滤除菌,-15 ℃以下保存备用。
1.2 病毒分离
按照同步接毒方法,将过滤的病毒液接种到F81 细胞,接种比例为5%;接种后次日换维持液,每日观察细胞病变情况,若无细胞病变(CPE)则将细胞培养物冻融后按相同方法继续传代,待CPE 达80%以上时收获病毒液。
1.3 病毒组织细胞半数感染量(TCID50)测定
取CPE 病变稳定的第2 代病毒液依次进行10-3~10-8稀释,分别接种于F81 细胞96 孔细胞培养板中,每个稀释度做8 个重复,0.1 mL/孔,每孔补加0.1 mL 的培养液;同时设正常细胞为对照组,观察120 h,记录病变孔数目,按Reed-Muench 法计算病毒的TCID50。
1.4 猪红细胞凝集试验
猪前腔静脉采血,制备1%猪红细胞悬液,在血凝板中每孔加入25 μL PBS(pH6.4),从第1 孔加入25 μL 样品开始,依次倍比稀释,至第15、16 孔只加25 μL PBS,以此作为红细胞对照孔,每孔另加25 μL PBS,再加入1%猪红细胞悬液25 μL,混匀后4 ℃冰箱作用50 min;取出判定结果。以100%红细胞凝集的最高稀释度作为血凝判定终点。
1.5 VP2 基因PCR 扩增与序列测定
将提取的病毒基因组为模板,按照常规方法进行PCR 反应。反应条件为:94 ℃预变性5 min;94 ℃ 30 s,56 ℃ 45 s,72 ℃ 90 s,32 个循环;72 ℃延伸10 min。取5 μL PCR 产物在1%琼脂糖凝胶上进行电泳检测。将PCR 产物送上海生工测序公司进行克隆测序。扩增序列大小为1 755 bp,同时用ddH2O 作为阴性对照。VP2测序引物序列如下:P1:5'-ATGAGTGATGGAGCAGTTCAACCAGACGGTGGTCAAC-3';P2:5'-TTAATATAATTTTCTAGGTGCTAGTTGAGATTTTTCA-3'
1.6 理化特性的鉴定
按文献[10]的方法测定分离毒株对氯仿、pH3.0 和55 ℃的耐受性。在病毒液中加入氯仿,使其终体积比为4.8%,震荡20 min,3 000 r/min离心30 min,然后吸取病毒液,过滤除菌,作为氯仿处理组;将病毒液置于2 mL EP 管中,于55 ℃水浴20 min,作为热处理组;用0.1 mol/L 的盐酸溶液调病毒液的pH 为3.0,置于4 ℃感作12 h,用0.1 mol/L 的NaHCO3调pH 至7.0 左右,作为酸处理组。将3 组分别测定病毒含量。
1.7 动物回归试验
挑选CPV HI 抗体阴性的貉3 只,经过食道灌服20 mL 分离毒株病毒液(含20×106.5TCID50),攻毒后连续观察10 d,记录貉的发病情况。
2 试验结果
2.1 病毒分离
将病料处理后的上清,同步接种于F81 细胞,盲传至第2 代,接种后48 h,发现F81 细胞出现拉网等细胞病变(图1-A),正常细胞组无病变(图1-B)。
2.2 病毒组织细胞TCID50 测定
按Reed-Muench 法计算的病毒TCID50=10-6.5/mL。
2.3 猪红细胞凝集试验

图1 F81 细胞病变情况(40×)
取第2~8 代病毒液进行HA 效价测定,发现病毒对猪红细胞的凝集能力基本稳定,HA 效价稳定在213。
2.4 VP2 基因PCR 扩增与序列测定
取病毒液进行PCR 鉴定,同时用ddH2O 作为阴性对照,结果扩增出约1 700 bp 的目的条带(图2)。将PCR 产物送上海生工测序公司进行克隆测序,将测序结果与GenBank 中的RDPV、CPV 及MEV 进行比对,结果发现分离毒株与RDPV 核苷酸的同源性为99.4%(图3)。系统进化树分析发现,分离毒株与RDPV 和CPV-2 为同一分支(图4)。因此,将分离株命名为RDPV SD001 株。
2.5 理化特性鉴定
分离毒株对氯仿、pH3.0 和55 ℃的耐受性试验结果显示,经过以上处理后的病毒含量测定结果变化不大,表明分离毒株对氯仿不敏感,且对酸、热均耐受。
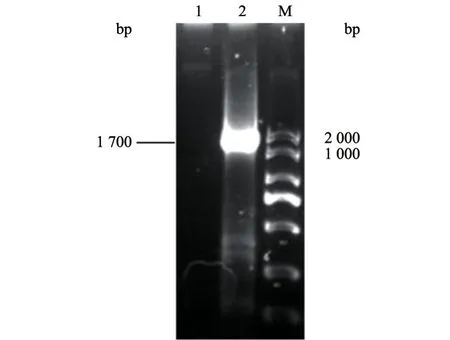
图2 分离毒株的PCR 鉴定结果
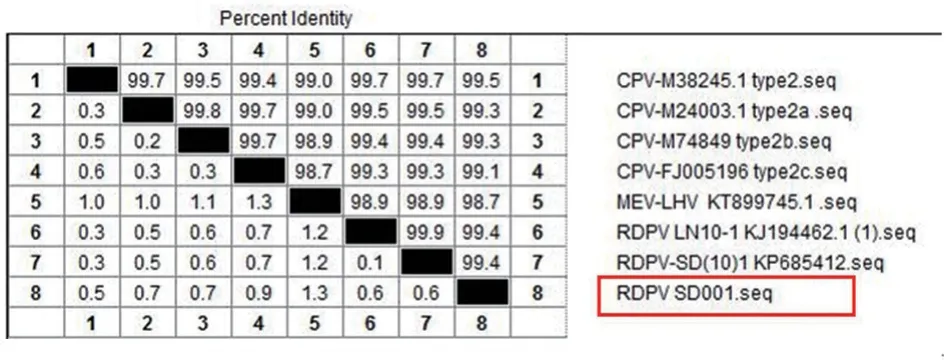
图3 分离毒株VP2 基因核苷酸同源性分析结果
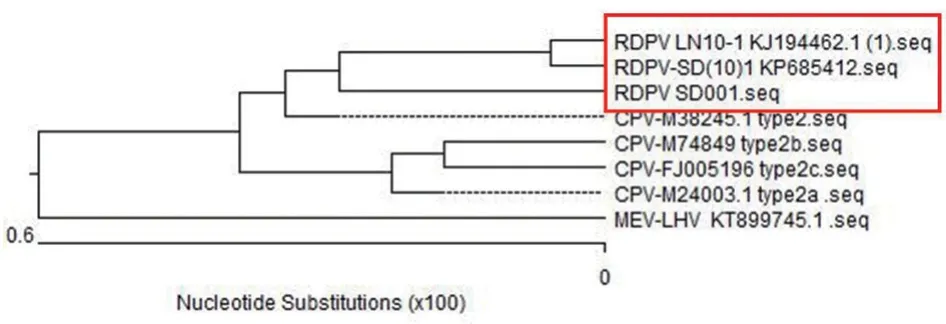
图4 分离病毒VP2 基因遗传进化分析结果
2.6 动物回归试验
将分离毒株第5 代病毒液,经过食道灌服20 mL(含20×106.5TCID50)攻毒3 只健康貉,发现攻毒后第4 日,貉出现精神不振、腹泻、呕吐等症状。采集攻毒后5 d 的粪便,用1%猪红细胞测定HA效价,结果3 只貉的粪便HA 效价均不低于210;攻毒后6 d,死亡2 只;攻毒后7 d,全部死亡。死亡貉眼窝凹陷(图5-A),剖检可见肠黏膜出血(图5-B),肠系膜淋巴结水肿,胃内空虚,有煤焦油样黏液(图5-C),胃黏膜出血(图5-D),符合典型的貉细小病毒病症状。
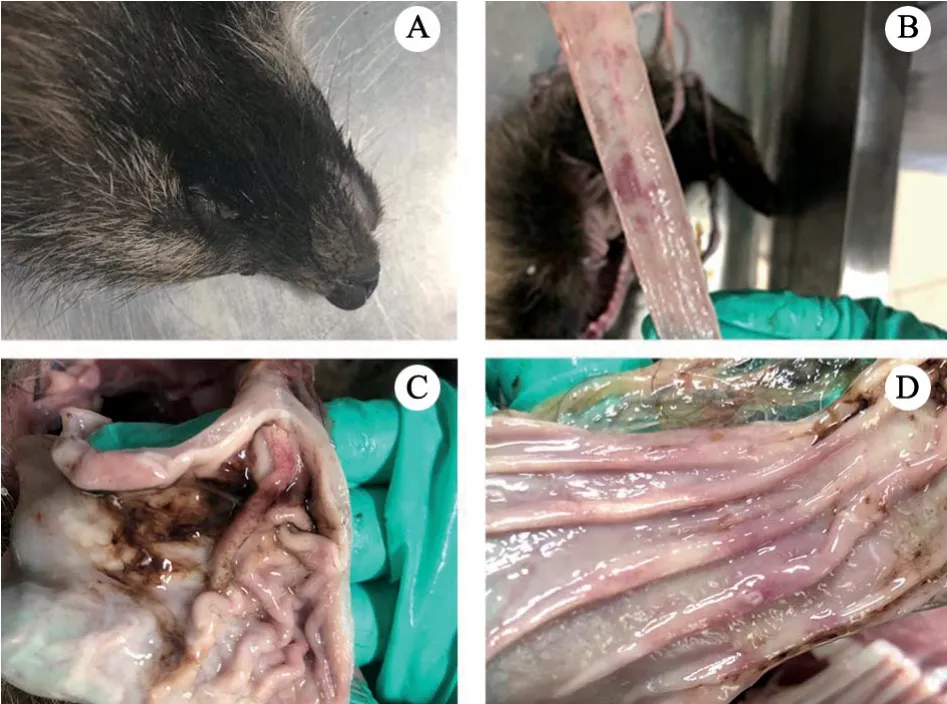
图5 攻毒后貉发病症状
3 讨论
本研究对分离毒株VP2基因进行序列分析,并与RDPV 参考毒株、CPV 毒株、MEV 毒株进行同源性比较和遗传进化分析,发现分离毒株属于CPV-2 型。有学者[8]推断,这可能是因为多数养殖场长期应用CPV-2 弱毒疫苗,导致免疫犬排毒直接感染了与其接触的未免疫貉。貉本身是CPV-2的易感动物,CPV-2 弱毒株可以在易感动物间传播复制的过程中毒力返强,成为使貉发病的强毒株[11]。
目前除山东省有貉细小病毒病发生外,河北省、黑龙江省也均有报道。可见貉细小病毒病已成为威胁貉养殖业的重要疫病。现在市场上的疫苗主要有针对水貂的病毒性肠炎灭活疫苗,水貂犬瘟热、肠炎二联活疫苗以及针对犬的细小病毒类疫苗。目前貉养殖户仍采用上述疫苗进行免疫,但是由于病毒之间存在差异,貉细小病毒病并没有得到有效控制,因此研发针对貉细小病毒病的疫苗很有必要。
