1 型、2 型牛病毒性腹泻病毒通用RT-PCR检测方法的建立与应用
2021-02-05曾维欢肖望成康京丽黄保续吴发兴代飞燕
曾维欢,李 蓉,肖望成,康京丽,黄保续,吴发兴,代飞燕
(1.云南农业大学,云南昆明 650201;2.中国动物卫生与流行病学中心,山东青岛 266032)
牛病毒性腹泻黏膜病(bovine viral diarrheamucosal disease,BVD/MD)是由牛病毒性腹泻病毒(bovine viral diarrhea virus,BVDV)引起的母牛繁殖障碍,各年龄牛呼吸、消化系统损伤的免疫抑制性疾病[1]。该病被世界动物卫生组织(OIE)列为须通报动物疫病。1946 年,该病首次在美国被发现,之后其在其他各国家相继暴发并全球流行[2]。OIE 官方网站数据显示,截至2020 年上半年,BVD 在各大洲仍处于流行阶段。1980 年,我国首次从胎牛血清中分离出BVDV(长春184 株)[3]。OIE 公布的调查数据显示,该病目前在我国境内呈地方性流行。BVDV 除感染各年龄阶段牛外,还可感染猪[4]及其他反刍动物[5]。BVDV 能造成机体免疫机能下降,易继发与其他病毒或细菌混合感染,在没有采取综合防控措施的牛场,有60%的牛会感染BVDV[6]。在全世界,每年死于BVD 的牛不少于500 万头[7]。该病也危害着我国养牛业的发展。
BVDV 为黄病毒科瘟病毒属成员,是单股正链RNA 病毒,基因组长12.3~12.5 kb。其整个基因组由5'-UTR,C、Erns、E1、E2结构蛋白基因,Npro、p7、NS2-3、NS4A、NS4B、NS5、NS5B非结构蛋白基因和3'-UTR 组成。其中,5'-UTR 含360 个核苷酸,具有稳定的茎环结构(Ia 发夹),参与病毒RNA 的翻译起始和复制。BVDV 不同毒株5'-UTR 基因序列高度保守,根据其基因序列差异分为1 型、2 型BVDV。2004 年,Schirrmeier 等[8]在德国一家实验室首次从巴西进口的一批胎牛血清(FBS)中检测到霍比样病毒分离物D32/00。该病毒与1 型、2 型BVDV 亲缘关系较近,但不在同一分支,将其归类为3 型BVDV,又称HoBi like pestivirus。现已发现1 型BVDV 至少有22个基因亚型(1a—1v),2 型BVDV 有4 个基因亚型(2a—2d)[9]。在我国流行的BVDV 毒株有1a、1b、1c、1d、1m、1o、1p、1q、1u、2a 以及2b 型[10]。
BVDV 检测方法[11]主要有:病毒分离、抗原检测、免疫组织化学法等病原学诊断技术;以病毒中和试验、酶联免疫吸附试验(ELISA)为代表的血清学诊断技术;RT-PCR 和荧光定量PCR 等分子诊断学技术。由于RT-PCR 方法特异性强、敏感性高、检出率高、操作简便,因而得到广泛应用。目前我国BVDV 流行毒株主要为1 型和2 型,且利用一对引物便能同时检出1 型、2 型BVDV 的方法研究较少。因此,本研究拟建立1 型、2 型BVDV 通用RT-PCR 检测方法,以期为快速有效筛查BVDV,进一步确定地方流行毒株,开展流行病学调查和疫病监测奠定技术基础。
1 材料与方法
1.1 材料
1.1.1 毒株 1 型及2 型BVDV、猪瘟病毒(classical swine fever virus,CSFV)、牛传染性鼻气管炎病毒(infectious bovine rhinotracheitis,IBRV)、牛呼吸道合胞体病毒(bovine respiratory syncytial virus,BRSV)、牛副流感病毒3 型(bovine parainfluenza virus type 3,BPIV3)、牛轮状病毒(bovine rotavirus,BRV)参考毒株,均由中国动物卫生与流行病学中心提供。
1.1.2 样品 山东省某发病牛场牛鼻棉拭子13份、血清9 份,-80 ℃保存备用。
1.1.3 细胞 牛肾传代细胞(MDBK),由中国动物卫生与流行病学中心提供并保存。
1.1.4 主要试剂 病毒DNA/RNA 提取试剂盒,购自天隆科技(西安)有限公司;凝胶回收试剂盒,购自天根生化科技(北京)有限公司;pCloneEZTA-Amp/HC 载体,购自中美泰和生物技术有限公司;One Step Prime Script RT Kit、50×TAE 缓冲液、琼脂糖、6×loading buffer、DL 2 000 DNA Marker,均购自宝生物工程(大连)有限公司;胎牛血清,购自内蒙古金源康生物工程有限公司。
1.2 方法
1.2.1 引物设计 根据GenBank 上已公开发表的序列,下载49 个1 型BVDV 毒株、15 个2 型BVDV 毒株以及1 株CSFV 毒株的全基因组序列,针对保守性高的5'-UTR 区域,应用Primer 6.0 设计1 型、2 型BVDV 通用特异性引物(TF:5'-GAAGGCCGAAAAGAGGCTA-3';TR:5'-CATGTGCCATGTACAGCAGAG-3'),送生工生物工程(上海)股份有限公司合成,预期扩增片段长度为302 bp。
1.2.2 核酸提取 使用病毒DNA/RNA 核酸提取试剂盒(天隆)机提1 型BVDV、2 型BVDV、CSFV、IBRV、BRSV、BPIV3、BRV 毒株及22 份临床样品核酸,具体步骤按说明书操作。
1.2.3 RT-PCR 方法优化 总体系为20 μL,包括:2×1step buffer 10 µL,PrimeScript 1 step Enzyme Mix 0.8 µL,BVDV TF 和TR(10 μmol/μL)各0.8 µL,病毒核酸4 µL,最后用RNase Free dH2O 补至20 µL。反应程序为:50 ℃ 30 min,94 ℃ 5 min;94 ℃ 30 s,56/57/58/59/60 ℃(5 个退火温度梯度)30 s,72 ℃ 30 s,共35 个循环;最后72 ℃10 min,4 ℃ 10 min。RT-PCR 扩增结束后取5 µL扩增产物进行1%琼脂糖凝胶电泳并成像。
1.2.4 特异性试验 将1.2.2 提取的1 型BVDV、2 型BVDV、CSFV、IBRV、BRSV、BPIV3、BRV核酸进行RT-PCR 扩增,阳性样品送测序,测试该方法的特异性。
1.2.5 敏感性试验 测定1 型、2 型BVDV 阳性毒株核酸浓度,用ddH2O 10 倍梯度连续稀释样品至10-10,按照已确定的RT-PCR 方法进行扩增,以最低可检出浓度判定该RT-PCR 方法的敏感度。
1.2.6 重复性试验 不同实验人员使用1 型、2型BVDV 阳性毒株核酸重复进行平行RT-PCR 操作,验证该方法的重复性。
1.2.7 临床样品检测及系统发育树构建 将1.2.2提取的22 份临床样品核酸运用已建立优化的1型、2 型BVDV 检测方法检测,阳性样品进行5'-UTR 序列测序,然后同具有代表性的20 株1 型BVDV、8 株2 型BVDV 和4 株3 型BVDV 毒株的5'-UTR 序列,运用Clustal 和MEGA6 软件进行序列比对并构建分子系统发育树。
2 结果与分析
2.1 RT-PCR 程序优化
分别设置56、57、58、59、60 ℃退火温度进行梯度试验,对比试验结果,发现58 ℃电泳条带单一且较亮,确定该反应退火温度为58 ℃。电泳结果见图1~2。
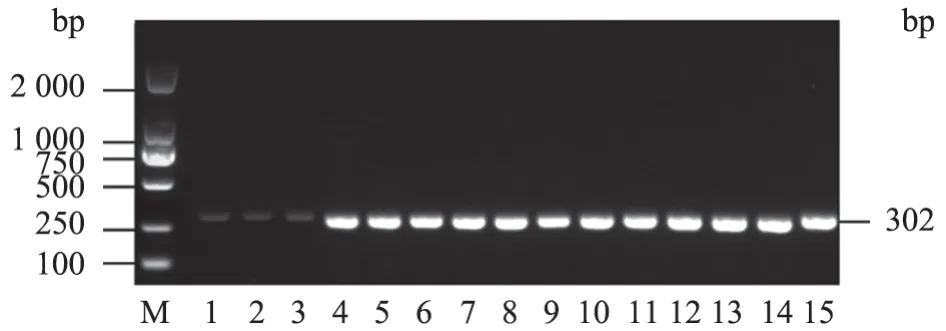
图1 1 型BVDV 阳性毒株鉴定退火温度优化结果

图2 2 型BVDV 阳性毒株鉴定退火温度优化结果
2.2 特异性试验
对1.2.2 提取的核酸进行RT-PCR 扩增发现,只有1 型、2 型BVDV 阳性毒株出现目的条带。PCR产物送华大基因公司测序,经在线Blast 比对,发现与GenBank 中收录的序列同源性分别为95.4%、100%。其余参考毒株均未扩增出目的片段,表明该引物特异性良好。电泳结果和测序序列如图3~4。

图3 引物特异性试验结果

图4 1 型、2 型BVDV 阳性毒株5'-UTR 扩增区域基因序列
2.3 敏感性试验
经测定,1 型、2 型BVDV 阳性毒株核酸浓度分别为36.1 ng/μL(2.09×1011copies/μL) 和41.63 ng/μL(2.41×1011copies/μL)。分别将核酸样品按照10-1~10-10进行10 倍梯度稀释后,RTPCR 扩增,发现BVDV 阳性毒株稀释度为10-9时仍可检出BVDV 阳性。样品电泳结果见图5~6。
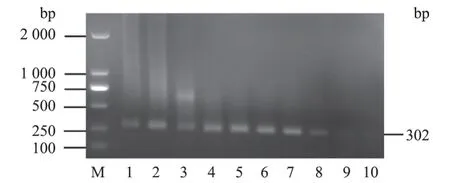
图5 1 型BVDV 阳性毒株敏感性试验结果

图6 2 型BVDV 阳性毒株敏感性试验结果
2.4 重复性试验
将同一份1 型、2 型BVDV 细胞毒核酸样品,交由3 个不同实验室人员在同一时间与环境下进行检测,每个样品2 个重复,结果发现重复性较好(图7),说明该方法可靠。

图7 鉴定引物重复性试验结果
2.5 临床样品检测与测序分析
运用优化好的1 型、2 型BVDV RT-PCR 方法,对山东省某发病牛场采集的13 份牛鼻棉拭子、9 份血清进行检测。其中,有8 份鼻棉拭子和8 份牛血清在302 bp 左右均出现目的条带(图8)。随机抽取4 份不同场的BVDV RT-PCR 阳性胶回收产物进行连接转化,挑取单菌落进行PCR 扩增并送至华大基因公司测序,发现序列比对结果均为BVDV 阳性(编号为SX0813-2020、SD-M17014、HN-1315、X39-2019)。将这4 份样品与1 型、2 型、3 型BVDV 标准毒株的5'-UTR 序列比对,利用软件构建系统进化树(图9),初步分析发现3 份样品田间流行株与1 型BVDV 标准毒株同处一个进化分支,X39-2019 样品5'-UTR 与其他毒株的相似性较低,还需进一步鉴定。

图8 临床样品检测结果

图9 5'-UTR 序列系统发育树分析结果
3 讨论
BVD 已在世界各地广泛流行和蔓延,特别是在养殖业发达的国家,其对我国牛养殖业也造成了一定经济损失。BVDV 会造成母牛繁殖障碍,各年龄牛消化系统、呼吸系统疾病,并且会损伤机体免疫系统引发其他病毒、细菌混合感染。不同健康状况的牛表现不同的临床症状,在临床上不易诊断;30~150 d 经胎盘感染的胎牛会持续感染并终身携带病毒成为牛场潜在BVDV 传染源[12]。现阶段,疫苗接种并未达到消除BVDV 相关临床疾病以及明显降低其发病率的理想效果[13]。一个高效准确的检测方法对于发病牛的诊断和牛场生物安全防控尤为重要。在BVDV 监测过程中,RT-PCR 能够检测急性感染动物并识别持续感染牛;对于血液、牛奶、滤泡液、唾液和组织样本也可通过RT-PCR 成功检测[14]。
BVDV 作为一种易突变的RNA 病毒,在全世界范围内广泛分布,其危害之大应引起足够重视。本研究根据5'-UTR 在种内各毒株间有较高的保守性,并且易于进行片段扩增的特性[15],针对该片段设计并合成特异性引物,经过反复优化引物建立1 型、2 型BVDV 通用型RT-PCR 方法。试验结果表明:该方法具有较好的特异性和重复性;将阳性核酸模板稀释至10-9(2.09×102copies/μL)仍可检出,具有较高的敏感度。在临床采集发病牛场的13 份牛鼻棉拭子和9 份牛血清中检测出8 份鼻腔棉拭子和8 份血清样品为BVDV 阳性,测序比对,4 份随机挑选的阳性样品毒株有3 份5'-UTR序列系统发育树分析与1 型BVDV 标准毒株在同一分支,剩余1 份样品还需进一步鉴定。应用RTPCR、测序和系统发育分析等先进分子技术,获得了本次分离得到阳性毒株的遗传分型,这对BVD的流行病学研究和防治具有重要意义。经验证,该方法对BVDV 有较高的灵敏性和检出率,表明该方法较可靠;对于临床样品,可在一套体系中快速便捷对1型、2型BVDV完成检测,并提供准确结果。在现行BVDV 检测国标(GB/T 18637—2018)中缺少普通RT-PCR 方法背景下,本方法是对该标准的有益补充。
