灭蝇胺在茶树菇及其培养基质中的残留及消解动态
2021-02-05罗雪婷潘洪吉李秋梅黄培鑫师迎春
吴 迪, 矫 健, 尹 硕, 罗雪婷, 潘洪吉,李秋梅, 黄培鑫, 师迎春
(北京市植物保护站,北京 100029)
茶树菇Agrocybe aegerita 由于其生产特点和栽培方式受局限,是目前尚不能进行工厂化生产的食用菌品种之一,其生产过程中的病虫害防治,尤其是对菇蚊菇蝇的防治还存在一定的难度。目前,中国在食用菌上登记的杀虫剂仅有氯氟·甲维盐乳油1 种[1],不能满足生产实际的需要。灭蝇胺 (cyromazine) 属三嗪类昆虫生长调节剂[2],具有强内吸传导作用,可以诱使双翅目幼虫和蛹发生畸变,成虫羽化不全或被抑制[3]。据报道,灭蝇胺在双翅目害虫防治中具有一定优势[3],其对潜叶蝇、异型眼蕈蚊和食用菌眼蕈蚊等毒力作用和药效显著[3-5],且对菌丝生长抑制作用较小[6]。目前灭蝇胺在美国、日本等国家在食用菌上均已登记使用[6]。已有研究表明,灭蝇胺在中国的使用尚不会产生不可接受的膳食摄入风险[2,7-8]。笔者调研发现,灭蝇胺在食用菌生产中使用较广泛,有必要对其在食用菌中使用后的残留情况进行研究。
中国尚未制定灭蝇胺在食用菌上的最大残留限量标准 (MRL) 和相关标准检测方法,CAC (国际食品法典委员会) 规定,灭蝇胺在蘑菇中的MRL值为7 mg/kg[9],欧盟规定其在栽培真菌和野生菌中的MRL 值分别为10 mg/kg 和0.05 mg/kg[10],美国规定灭蝇胺在蘑菇中MRL 值为1.0 mg/kg[11]。
关于灭蝇胺残留的检测方法主要有液相色谱法[12-14]、液相色谱-质谱联用法[15-16]、CdSe/CdS 量子点荧光探针法[17]等,但涉及食用菌基质检测的较少[12],对茶树菇中灭蝇胺残留的研究尚未见报道。虽然有文献报道三聚氰胺为灭蝇胺的降解产物[2],但在JMPR 报告中,灭蝇胺的残留物监测定义和风险评估定义仅为灭蝇胺,不包括三聚氰胺,认为三聚氰胺的毒性比灭蝇胺小,且样本中的三聚氰胺可能有其他的来源[18-19]。依据该报告,本研究中不对三聚氰胺进行检测,建立了与相关文献方法不同的简单快速的液相色谱-串联质谱(LC-MS/MS) 测定食用菌中灭蝇胺残留的分析方法,并基于生产实际中农户使用灭蝇胺防治菇蚊、蝇的用药量,对菇棚中灭蝇胺的残留消解动态及最终残留进行了研究,旨在为其合理使用和最大残留限量制定提供参考。
1 材料与方法
1.1 仪器、药剂与试剂
Agilent 1260-6460 型三重串联四极杆液相色谱-质谱联用仪,美国安捷伦公司;Autogizer 701 型全自动多通道样品匀质器,美国TOMTEC公司;TG16 型台式高速离心机,长沙英泰仪器有限公司;FP3010 食物调理机,德国博朗公司。
99.2%灭蝇胺标准品 (cyromazine),国家农药质检中心 (沈阳);50%灭蝇胺可溶性粉剂 (cyromazine SP),东莞市瑞德丰生物科技有限公司。
甲醇 (质谱纯),Fisher 公司;氯化钠 (分析纯),天津市瑞金特化学品有限公司。
1.2 培养基质 (菌棒)
茶树菇栽培中,使用棉籽皮90%、麸皮5%、豆粕2%和生石灰3% (质量分数) 作为培养基质,装入塑料袋中形成棒状,以菌棒形式进行生产。
1.3 田间试验
供试药剂为50%灭蝇胺可溶性粉剂。
1.3.1 残留消解动态试验 茶树菇采用菌棒竖放培养,每小区面积5 m2,每小区放置400 个菌棒。施药剂量为灭蝇胺有效成分3 433.5 g/hm2,待出菇后,喷雾施药1 次,每小区用药液量为3 L,重复 2 次。于药后 2 h 及 1、2、3、5、7、10、14、21、28 d 取茶树菇和菌棒样品。
1.3.2 最终残留试验 设4 个不同施药剂量和不同施药次数的小区,每小区面积5 m2,菌棒数量约550 个,以灭蝇胺有效成分2 289 g/hm2、3 433.5 g/hm2的剂量施药3、4 次,于田间茶树菇生产间歇茬口开始施药,不强调茶树菇必须着药,施药间隔期为7 d。另设不施药对照区。于末次施药后3、5、7 和10 d 分别取茶树菇和菌棒样品。
1.3.3 取样方法 茶树菇样品按五点法取整株出菇部分,每小区取不少于12 个点,总质量不少于2 kg,用食物调理机打碎,混匀,待分析。
菌棒按五点法整袋取样,每小区取5 个点。菌棒长度约15 cm,分为上、中、下3 段,每段约5 cm,分别用食物调理机打碎,混匀,待分析。
1.4 样品前处理
称取10 g 样品,加入1.0 mL 水和30.0 mL 甲醇,于12 000 r/min 下匀浆2 min;加入7 g 氯化钠后剧烈振荡1 min;移取1 mL 上清液至1.5 mL离心管中,于10 000 r/min 下离心10 min;取上清液过0.22 μm 微孔膜,待测定。
试验过程中,对初步测定后测定溶液浓度高于线性范围的样品,用甲醇稀释后再测定,以确保测定样品溶液浓度在线性范围内。
1.5 仪器分析条件
色谱条件:使用色谱柱为ZORBAX Eclipse plus C18Rapid Resolution HT 3.0 mm × 100 mm 1.8-Mincron 600Bar,柱温为35 ℃,进样体积2 μL。流动相A 相为5 mmol/L 醋酸铵 + 0.1%甲酸水溶液,B 相为甲醇,流速为0.4 mL/min。采用梯度洗脱程序,梯度变化见表1。

表1 液相色谱-质谱梯度洗脱程序Table 1 Gradient elution program of LC-MS/MS
质谱条件:电喷雾离子源正离子扫描 (ESI+),多反应监测模式 (MRM);干燥气温度300 ℃;干燥气流速7 L/min;雾化气压力241.4 kPa;鞘气温度350 ℃;鞘气流速11 L /min;毛细管电压3 KV;喷嘴电压0 V。多反应监测参数见表2。
1.6 方法学验证
称取灭蝇胺标准品0.01 g (精确至0.000 1 g),用体积分数为0.1%的甲醇水溶液溶解,配成质量浓度为1 000 mg/L 的灭蝇胺标准储备液,于 −20 ℃下避光保存。用甲醇稀释灭蝇胺标准储备液,配成质量浓度分别为0.002、0.005、0.01、0.02、0.05、0.08、0.1 和0.2 mg/L 的系列灭蝇胺标准溶液,外标法定量。以灭蝇胺质量浓度为横坐标,定量离子峰面积为纵坐标,绘制标准曲线。
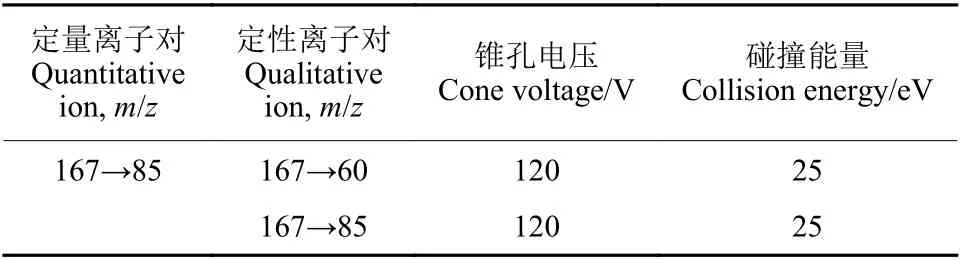
表2 灭蝇胺多反应监测参数Table 2 Multi-reaction monitoring parameters of cyromazine
向空白茶树菇和菌棒中分别添加灭蝇胺标准溶液,添加水平为0.01、0.1 和1 mg/kg,每个水平重复5 次,计算回收率及相对标准偏差 (RSD)。
2 结果与分析
2.1 施药方式和剂量的选择
食用菌生产中主要的施药方式为拌料和喷雾。考虑到喷雾方式直接接触食用部位,残留影响更大,故选择喷雾作为本研究的施药方式。
鉴于有关灭蝇胺残留的研究报道较少,文献数据对本研究的参考价值不大,故在本试验开展过程中,通过对常年从事茶树菇生产的基地和生产者进行调研,参照其日常防治用药量,确定本研究的施药剂量为灭蝇胺有效成分2 289 和3 433.5 g/hm2。
2.2 样品前处理方法的优化
分别考察了乙腈、甲醇、V (甲醇) : V (水) = 30 :1 作为提取溶剂对灭蝇胺提取效率的影响。结果表明:当以乙腈或甲醇作为提取溶剂时,灭蝇胺的回收率均较低,在30%~60%之间,不能满足残留分析的要求。当以V (甲醇) : V (水) = 30 : 1 作为提取溶剂时,灭蝇胺的回收率为72%~110%,加入过量的氯化钠,可在一定程度上降低部分大分子杂质在提取液中的溶解度,再高速离心可去除提取液中的悬浮颗粒,达到有效提取和净化基质中目标分析物灭蝇胺的目的。故最终选择加水辅助甲醇提取,加入氯化钠后高速离心净化的前处理方法。
2.3 方法学考察结果
结果 (表 3) 表明:在 0.002~0.05 mg/L 和 0.01~0.2 mg/L 范围内,灭蝇胺的质量浓度与对应的峰面积间均呈良好的线性关系,R2≥ 0.997。能够满足本试验定量分析的要求。
按照添加回收的最低浓度确定方法的定量限,则灭蝇胺在茶树菇和菌棒样品上的定量限(LOQ) 均为0.01 mg/kg;依据最低浓度的信噪比估算方法检出限,则灭蝇胺在茶树菇和菌棒中的检出限 ((LOD) 均为 0.002 mg/kg。

表3 灭蝇胺的线性范围、决定系数、检出限及定量限Table 3 Linear range, coefficient of determination, LOD and LOQ of cyromazine
在0.01、0.1 和1 mg/kg 添加水平下,灭蝇胺在茶树菇和菌棒中的回收率均在72%~110% 之间,RSD 在2%~6%之间 (表4),均满足农药残留试验准则的要求[20]。

表4 灭蝇胺在茶树菇和菌棒中的添加回收率及相对标准偏差Table 4 Recoveries and RSDs of cyromazine in Agrocybe aegerita and its substrates (n = 5)
2.4 灭蝇胺残留消解动态
结果 (表5) 表明,灭蝇胺在茶树菇中的残留消解规律符合一级反应动力学模型,消解曲线为ct= 0.285e−0.127t(R2= 0.795 7),半衰期为 5.46 d;菌棒中灭蝇胺残留集中分布在上段,药后1~21 d 的残留量在0.33~0.69 mg/kg 之间,无明显降低趋势,且远高于中段 (0.022~0.091 mg/kg) 和下段(0.017~0.091 mg/kg) 中灭蝇胺残留量。
由于灭蝇胺通过自上而下喷雾方式施入,在菌棒中逐渐下渗,故上段农药残留量明显高于中、下段,但随着时间的变化,上、中、下段中灭蝇胺的残留量比例变化不显著,这可能与菌棒为半闭体系有关。药后21 d 内菌棒中的灭蝇胺残留量无明显的降低,说明灭蝇胺在菌棒中的残留时间较长,施药一次即可满足茶树菇一个出菇周期 (约为20 d) 的用药需求。
2.5 灭蝇胺最终残留结果
由表6 可知,喷雾施药后按照茶树菇正常生长周期进行取样,灭蝇胺在茶树菇中的残留量为0.053~0.18 mg/kg,在菌棒上段残留量为0.67~1.58 mg/kg,菌棒中段为0.035~0.46 mg/kg,菌棒下段为<0.010~0.20 mg/kg。可见灭蝇胺残留主要集中在菌棒的上段。
茶树菇中灭蝇胺残留规律:1) 采样间隔期越长,残留量越低。2) 施药剂量越大,残留量越高。由于最终残留试验中在出菇间歇时施药,故茶树菇中的灭蝇胺均为自菌棒中内吸传导所获得,说明在菌棒中的施药剂量越大,茶树菇吸收灭蝇胺的量越大。3) 施药3 次和4 次处理间的残留量差异不大,在一定程度上说明视防治需求适当增加用药次数,可能不会增加茶树菇中灭蝇胺的残留风险。4) 最终残留试验施药次数、施药总量均高于消解动态试验,但残留量却低于后者,说明直接喷施在食用菌表面残留的灭蝇胺比从基质中吸收的灭蝇胺残留量高,可以采取在出菇间歇茬口施药的方式以降低其在食用菌中的残留量。

表5 灭蝇胺在茶树菇及菌棒中的消解动态Table 5 Dissipation dynamics of cyromazine in Agrocybe aegerita and its substrates
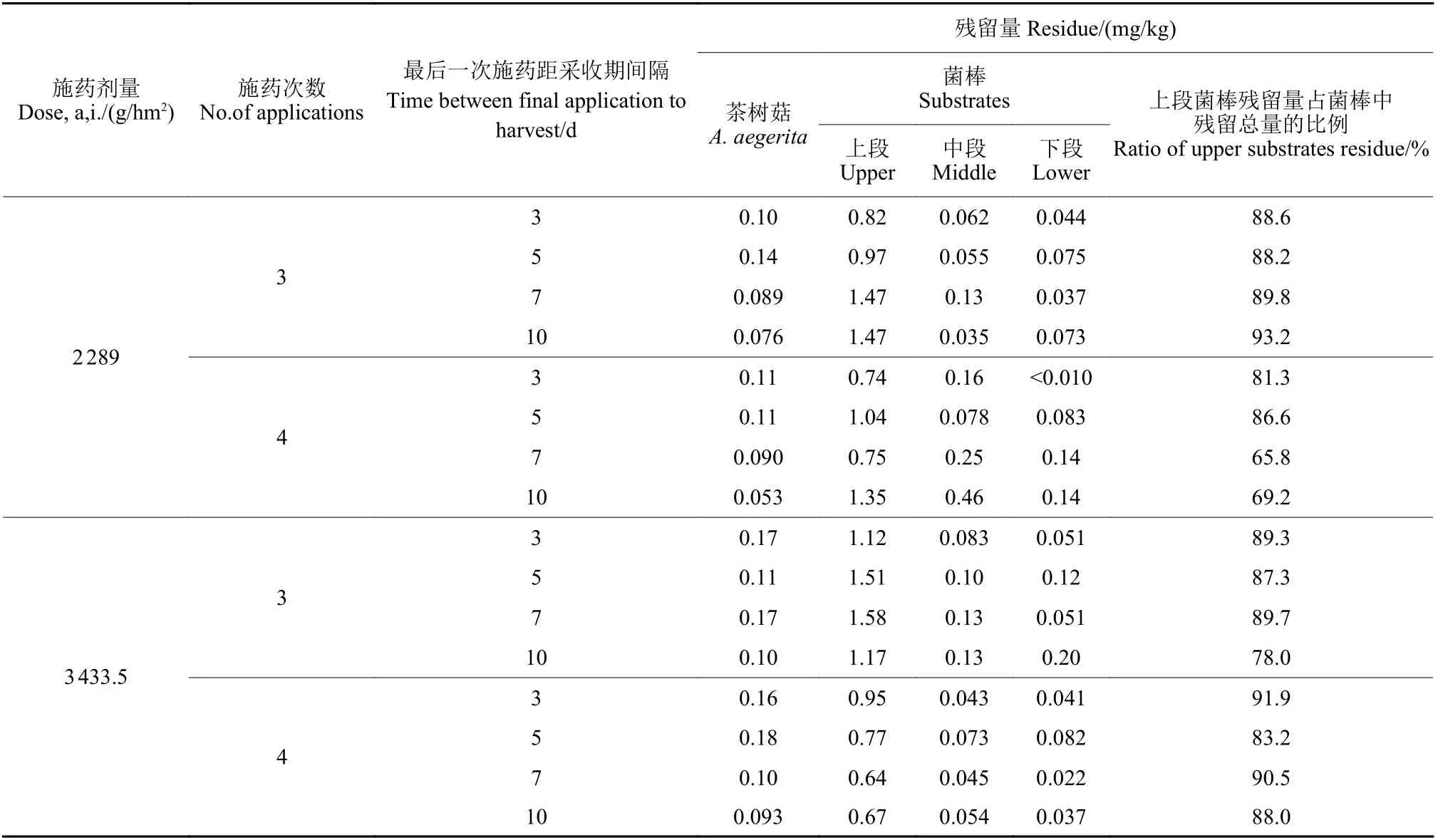
表6 灭蝇胺在茶树菇和菌棒上的最终残留量Table 6 Terminal residues of cyromazine in Agrocybe aegerita and its substrates
菌棒中灭蝇胺残留规律:1) 灭蝇胺残留主要集中在上段菌棒中。2) 施药剂量和施药次数对菌棒中的残留量影响不显著。
3 结论与讨论
采用液相色谱-串联质谱法测定茶树菇及其菌棒中的灭蝇胺残留量,方法简单、快捷,检出限低,其平均回收率为72%~110%,相对标准偏差为2%~6%。与乙酸铵-乙腈提取、固相萃取净化等标准方法相比,该方法更加简便,较相关文献中乙腈提取后加氯化钠分层的方法提取效率更高。
消解动态试验结果表明,灭蝇胺在茶树菇中的半衰期为5.46 d;灭蝇胺在菌棒中主要分布于上段,且在施药后21 d 内残留量无明显的降低,基本可提供茶树菇一个出菇周期的持续防效。
最终残留试验结果发现,与消解动态试验结果一样,灭蝇胺残留主要集中在菌棒上段。最终残留试验中茶树菇上的灭蝇胺残留量较菌棒中的残留量低,且比消解动态试验中茶树菇直接着药的残留量低。故在实际生产中可将用药时期控制在未出菇时,既能够避免茶树菇直接着药产生较高残留,又能对在菌棒中孵化和生长的菇蚊、菇蝇幼虫进行有效防治。
在食用菌生产中,采取培养基质用药,一定程度上既能保障相关病虫害的有效防治,又能降低可食部分的农药残留,对食用菌用药防治方法的改进有实际的意义。
试验结果表明,按有效成分2 289~3 433.5 g/hm2施药3~4 次,3 d 后灭蝇胺在茶树菇中的残留量在0.10~0.17 mg/kg 之间。结合国际农药残留和本研究结果,建议我国规定灭蝇胺在食用菌上的MRL 值为1.0 mg/kg。由于食用菌属于小宗作物,农药企业的登记成本较高,虽然用药需求大,但企业主动登记的积极性并不高,希望有关部门能够引导农药企业登记,并积极推动限量标准制定工作,以便更好地指导食用菌生产用药。
本文选择目前农药残留风险较高的食用菌——茶树菇作为研究对象,分析其在食用菌上的残留行为,其栽培方式较为单一,生产主要在棚室内进行,需要对光照、温度、湿度进行控制,不同试验点之间的差异性不大。本研究结果是基于北京一个试验地点的研究数据,虽在一定程度上能够反映生产实际,但离完全支撑食用菌中农药残留限量国家标准的制定尚有一定差距。此外,由于不同的食用菌栽培方式和生长情况差异较大,该研究结果是否在其他食用菌中具有类似的规律,还有待进一步研究证实。在检测方法方面,本试验方法虽未能将甲醇提取液与样本基质中的水完全分离,但由于同类基质中含水量相近,样本与提取液的结合方式相同,故采取此方法开展研究基本能够满足要求。为适应不同基质检测的需要,其检测方法有待进一步优化。
