甲酸与双甲脒对意大利蜜蜂的时间-剂量-致死率分析
2021-02-05苗春辉黄新球荀利杰胡宗文
苗春辉, 杨 娟, 黄新球, 荀利杰, 胡宗文
(云南省农业科学研究院 蚕桑蜜蜂研究所,云南 蒙自 661101)
蜜蜂 (如意大利蜜蜂、中华蜜蜂) 作为一种主要的授粉性昆虫,对农业增产、农民创收具有重要作用,同时对于维护生态系统的生物多样性具有重要而深远的意义[1-2]。对于意大利蜜蜂而言,其最大的威胁源于体表寄生螨的危害[3]。目前防治蜂螨的方法有多种,如使用杀螨剂、改变温度及气压、割除雄蜂脾等,然而化学杀螨剂的频繁使用不仅有可能污染蜂产品,并且使得害螨的抗药性问题日益加重,因此蜜蜂杀螨剂的安全性越来越受到关注[4]。
甲酸是一种有机酸,同时也是蜂蜜中的天然成分,但对蜂螨有很强的刺激作用,于20 世纪80 年代在德国最早被尝试用于防治蜂螨,后普及到全球蜂业治螨[5]。双甲脒又称N,N-双 (2,4-二甲苯亚氨基甲基) 甲胺 (amitraz),为常见的有机氮类杀螨剂,广泛用于农作物上害螨和蚜虫、棉铃虫等害虫的防治,因对蜜蜂体表寄生螨雅氏螨Varroa jacobsoni 和狄氏螨Varroa destructor 有良好的触杀效果,且对蜜蜂低毒,因此也被广泛用于蜂群杀螨[6]。有关甲酸和双甲脒的杀螨效果在国内有诸多文献介绍[7-8],而国外更多关注的则是其对蜜蜂的安全性及生理、病理学影响。Semkiv 等连续两年观测发现,波兰蜂场使用双甲脒后其在巢脾上的累计残留检出率高达94.6%[9]。Gregorc 等采用DNA 检测的末端转移酶标记 (TUNEL) 技术,检测了经双甲脒处理的蜜蜂幼虫,发现48 h 后有36% 的3 日龄蜜蜂发生了中肠上皮细胞死亡[10];同样,他们采用质量分数为2.97%的甲酸与31.95%的蔗糖混合后处理蜜蜂幼虫,40 h 后发现有18%的3 日龄蜜蜂发生了上皮细胞死亡,到5 日龄时这一比例增加到82%[11]。
甲酸和双甲脒对蜂螨的致死效果及对蜜蜂的生理影响均已得到很好的验证,但两种杀螨剂对蜜蜂的致死规律还鲜有报道。在国内的养蜂生产中,常将甲酸和双甲脒配制成一定浓度的溶液后向蜂群喷洒以防治蜂螨[12-13],而蜜蜂自身的清洁行为会促使工蜂之间相互舔舐而摄入杀螨剂,从而对蜜蜂产生胃毒作用[14]。随着杀螨剂的广泛使用,蜂螨已对常规浓度 (1 mL 杀螨剂 : 1 000 mL水,大致相当于质量浓度 1 μg/mL) 的化学类杀螨剂[如氟胺氰菊酯 (fluvalinate,螨净)]产生了抗药性[6,15-16],必须加大浓度才能达到所需的杀螨效果,但有关高浓度下杀螨剂对意大利蜜蜂的影响尚未见报道。为此,本研究采用时间-剂量-致死率(time-does-mortality,TDM) 模型,研究了甲酸与双甲脒对意大利蜜蜂成年工蜂的致死规律,以期掌握甲酸和双甲脒对意大利蜜蜂的致死动态及时间-剂量效应,旨在为田间合理应用这两种药剂提供理论指导。
1 材料与方法
1.1 供试材料
蜂群:6 群意大利蜜蜂 Apis mellifera 饲养于云南农业科学院蚕桑蜜蜂研究所意大利蜜蜂试验蜂场内,待工蜂出房后进行标记,采集蜂箱内21 日龄的成年工蜂供试。
主要仪器:蜜蜂饲养盒[20 cm × 6 cm × 3.5 cm的木质盒,内含有 5 个饲养室 (6 cm × 3.5 cm × 3.5 cm),每个饲养室前面有门档,后面为孔径1 mm 的铁纱网];WYA-2 S 型数字阿贝折射仪 (上海物光科技开发有限公司)。
药剂:甲酸 (formic acid) 和双甲脒 (amitraz)原液由浙江商贸浙雨试剂公司提供,分析纯,以质量分数30%的蔗糖液作为溶剂,按表1 配制成梯度浓度药液,并以30%蔗糖液作为空白对照。将配制好的药液置于50 mL 离心管内,于5 ℃保存,在试验开始前1 h 取出,于室温下放置,待试验时摇匀饲喂。麻醉用CO2(蒙自市黄龙氧气供应站提供,装于CO2钢瓶中,通过钢瓶阀门控制CO2流量)。
1.2 试验方法
蜜蜂捕捉:于试验开始前21 d 在蜂群内标记刚出房蜜蜂,为0 日龄,以获得同一日龄工蜂。为防止蜜蜂捕捉过程中受伤,采用CO2麻醉后用镊子和吸管小心捕捉,置入饲养盒中。共设12 个蜜蜂饲养盒,每盒含5 个饲养室,即总计60 个独立的饲养室,每个饲养室放入20 只蜜蜂,以获得每个浓度药剂3 次重复。
饥饿处理:为剔除在捕捉过程中致死的蜜蜂,待被麻醉的蜜蜂苏醒后,静置饥饿处理2 h,用镊子触及蜜蜂躯体而不活动者判定为死亡,清理并记录死亡蜜蜂数。

表1 两种供试药液浓度梯度Table 1 The concentration gradient of acaricide
饲喂处理:采用摄入法处理蜜蜂[14,17]。为准确记录蜜蜂取食药量,采用移液枪每隔6 h 饲喂1 次。将1 000 μL 移液枪调到最大量程,吸取药液后将枪头倾斜45° 角对准蜜蜂聚集区,轻轻旋转排量按钮,使在枪头形成药滴饲喂蜜蜂,至蜜蜂不再取食后移出,移液枪最大量程与此时刻度的差值即为蜜蜂取食药量。每浓度重复3 次。当每个饲养室蜜蜂死亡数量 >10 只时,改用100 μL的移液枪进行饲喂。每次饲喂前记录蜜蜂的死亡数,并清理已死亡的蜜蜂。
1.3 数据统计与分析
数据以Excel 2012 软件进行收集整理和作图,采用DPS 软件对杀螨剂毒杀活性试验结果进行TDM (Time-Does-Mortality) 模型模拟和时间-剂量效应参数估计[18],采用Pearson 卡方检验和Hosmer-Lemoshow 检验对所建立的模型拟合度进行验证,以评价两种杀螨剂对蜜蜂的毒性作用。
TDM 模型因其数学结构也可称为互补重对数模型,其给出了某供试生物在任意时间tj(j = 1, 2,3, ···, J ) 下经药剂 (被供试因子) 剂量 di(i = 1, 2,3···, I ) 处理后的累计致死率 (cumulative mortality probability)[19],其计算公式见式1。
式中:待估参数β 可描述为 “假设存在的每个关键生物受体所接受活性分子的平均数目”,即剂量效应的斜率;τj描述截止于时间tj时的待估时间效应参数。τj+ βlgdi与 ln[−ln (1−Pij)]具有线性关系,称为线性预测因子 (linear predictor)。
累计致死率是连续性时间变量的非独立性变量,因而,式1 并不能满足模型模拟的独立性假设。若时间区间[tj−1, tj]非常短,同时各时间段相互独立,那么剂量di促使试虫在时间段[tj−1, tj]内发生的死亡率就是时间变量的独立性变量,可模拟。这个死亡率即条件死亡率 (conditional mortality probability),是指实际死亡数与供试时间起始的存活数之比,其计算公式见式2。
式中:γj为供试时间区间[tj−1, tj]内时间效应的待估参数。γj和 τj的关系见式 3。
式中, γk 为某一时刻时间效应的待估参数。
2 结果与分析
2.1 意大利蜜蜂死亡趋势
不同浓度甲酸和双甲脒处理后不同时间下意大利蜜蜂的累计致死率见图1。总体而言,累计致死率随药剂质量浓度递增及处理时间的延长而增加。其中,目前田间所用质量浓度 (1.67 μg/mL)的甲酸和双甲脒对意大利蜜蜂的累计致死率迅速增加的时间始于处理后6 h,分别在处理后60 h和42 h 达到死亡率高峰,累计致死率超过50%的时间 (T50值) 分别为处理后12 h 和18 h,显著高于推荐使用质量浓度 (1 μg/mL) 下甲酸和双甲脒的累计致死率 T50值 (分别为 27 h 和 24 h,P甲酸= 0.043,df = 18,P双甲脒= 0.032,df = 18)。剂量≥5 μg/mL时,在处理后30 h 内累计致死率达最高,T50小于9 h。低于1 μg/mL 时,两种药剂累计致死率随处理时间变化的趋势相近。结合各处理的累计致死率和处理时间看,浓度变化对累计致死率的影响程度次序为双甲脒>甲酸。
2.2 TDM 模型模拟
两种药剂的处理时间效应和剂量参数比较见表2。经t 检验,两种药剂的剂量效应与时间效应均极显著 (P < 0.01),即相对于参数估计值标准误均极小。条件死亡率是时间的相关函数,τj描述截止时间tj的待估时间参数,β 为剂量效应的斜率。甲酸与双甲脒的剂量效应斜率β 分别为1.98和2.44,即意大利蜜蜂工蜂对两种药剂浓度变化的敏感性为双甲脒>甲酸。时间效应参数γj估计值表明,相同时间点下双甲脒的时间效应参数均高于甲酸,并且甲酸的持续时间短于双甲脒。模型拟合结果与试验结果 (图1) 相符。
通过TDM 模型拟合优度的显著性可以检验建模是否成功,若差异显著则表明建模成功。从表3可看出,本研究的数据符合TDM 模型,Pearson卡方检验和Hosmer-Lemoshow 拟合异质性检验显著水平均<0.05,表明模型的拟合异质性能够描述两种药剂的时间-剂量效应关系。
2.3 两种药剂的剂量效应
甲酸和双甲脒处理意大利蜜蜂工蜂后不同时间的剂量效应模拟结果见图2。随着处理时间延长,达到同等致死效应所需的药剂浓度呈递减趋势,即甲酸和双甲脒对意大利蜜蜂工蜂的LD50和LD90值与处理后时间的对数呈负相关函数关系,处理后 66 h 的 LD50和 LD90值分别为 7.40 × 10−2、2.99 × 10−2μg/mL 和 4.21 × 10−2、2.60 × 10−2μg/mL。处理12 h 后蜜蜂死亡率趋于平稳,表明在处理后12 h 内蜜蜂死亡率偏高,后期则变化较小。从图2还可看出,甲酸的LD50和LD90值均高于双甲脒,且两种药剂间差异显著 (P = 0.014,df = 42,t = 0.81),表明双甲脒对蜜蜂的毒性强于甲酸。
2.4 时间效应
根据TDM 模型可得出不同浓度甲酸和双甲脒对意大利蜜蜂的LT50和LT90值 (图3)。从中可看出,时间效应与处理剂量间呈负相关关系,即随剂量升高两种供试药剂对意大利蜜蜂的致死时间缩短。药剂的LT50和LT90值越小,表明其毒性越强。从图3 可知,1 和10 μg/mL 质量浓度下,甲酸和双甲脒的LT50值分别为4.8、4.2 h 和1.5、1.4 h,差异极显著 (P = 0.005,df = 7,t = 4.06),表明双甲脒对蜜蜂的毒性强于甲酸,与图2 的结果相似。当质量浓度升至2.5 μg/mL 后,两种药剂对蜜蜂的LT50值相当,说明此时两种药剂对蜜蜂的毒性相近。
待估参数γj在不同时间区间[tj−1, tj]内条件死亡率与药剂浓度di的函数关系见式2,其拟合曲线与试验测定值的关系见图4。甲酸和双甲脒条件死亡率迅速递增的线性预测因子为 −0.1~0.1,通过比较拟合曲线的系数及R2值可知,甲酸的拟合曲线二项式系数为1.493 1,R2为0.518 7,双甲脒的拟合曲线二项式系数为2.285 1,R2为0.678 7,即双甲脒的拟合曲线二项式系数和R2值均高于甲酸,同样表明两种药剂的毒性顺序为双甲脒>甲酸。
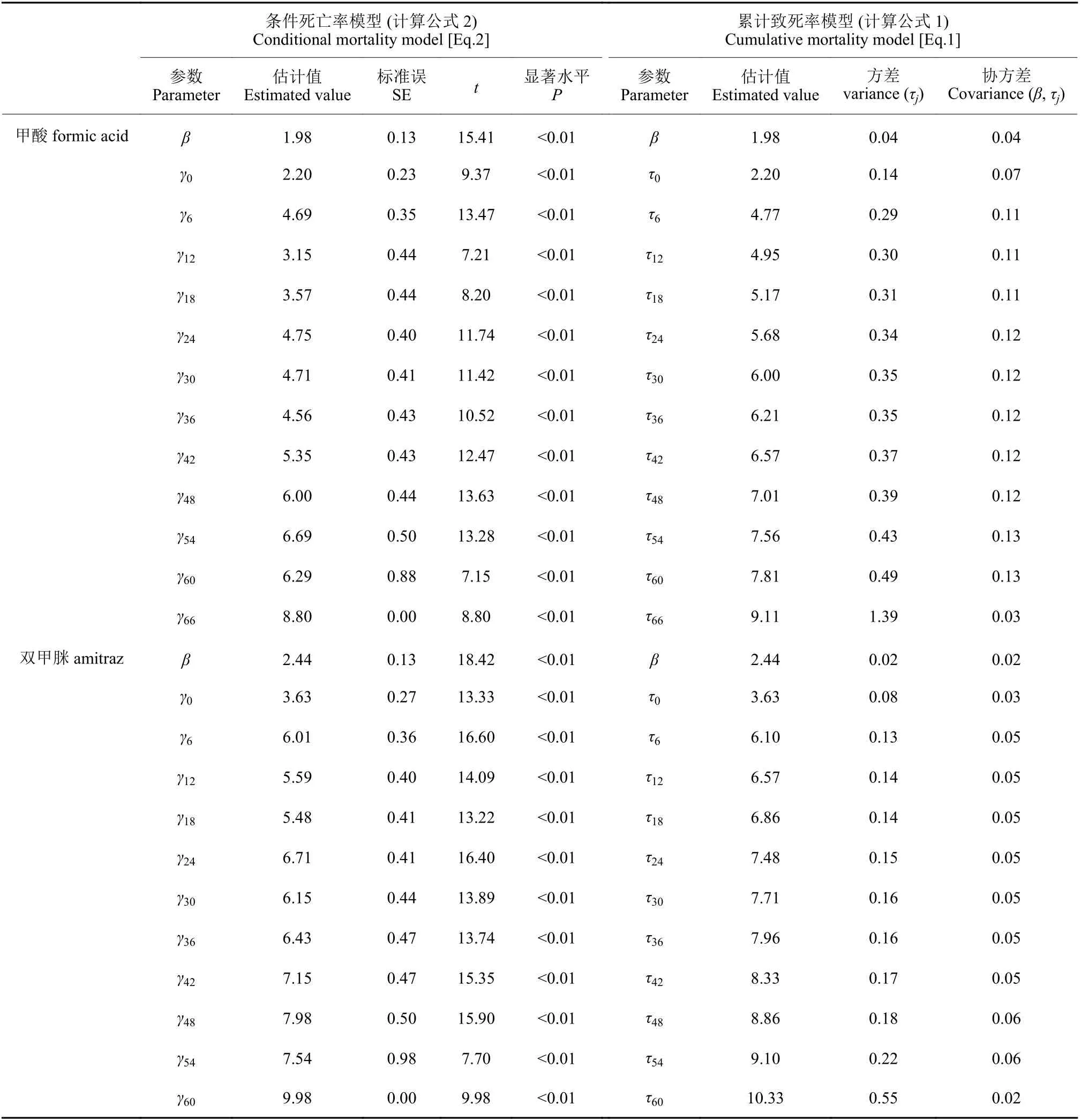
表2 甲酸和双甲脒对意大利蜜蜂的TDM 模型模拟和时间-剂量效应参数估计Table 2 Time- and dose- effect parameter estimated from the time-does-mortality data of formic acid andamitraz on the honeybees, Apis mellifera

表3 TDM 模型拟合优度Table 3 Goodness fitness of TDM model
3 讨论与结论
在评价药剂生物活性的参数中,剂量效应和时间效应是重要的指标之一[20]。TDM 模型能够充分揭示剂量效应和时间效应的关系,合理表达时间-剂量相互作用关系,并且直观地展示药剂致死的动态变化、高峰期、致死剂量等指标[21],在评价药剂的毒力、害虫敏感程度及致死率变化等方面有着显著的优势[22]。杨振国等[23]采用TDM 建模,通过Hosmer-Lemoshow 拟合异质性检验,证明了植物源类杀螨剂的数据分析能够无偏差地描述时间-剂量-致死率的相互关系。本研究中TDM模型的拟合异质性 (表2) 检验同样能够描述两种药剂对意大利蜜蜂的时间-剂量-致死率相互关系。
甲酸和双甲脒作为常用的杀螨剂,对意大利蜜蜂体表寄生螨,尤其是狄斯瓦螨 (大蜂螨) 有着良好的触杀和防治效果[5,7-8,10-11],但在防治蜂螨的同时也会对意大利蜜蜂产生毒杀效应。本研究中,两种药剂处理后对意大利蜜蜂的累计致死率随药剂质量浓度递增及处理时间的延长而递增:≥5 μg/mL 时,在处理后30 h 内累计致死率均达100%;低于 1 μg/mL 时,两种药剂的累计致死率随处理时间变化的趋势相近 (图1),且在剂量效应中甲酸的LD50和LD90值均高于双甲脒 (图2),以及在时间效应 (图3) 中甲酸和双甲脒在1 和10 μg/mL处理后的LT50值分别为4.8、4.2 h和1.5、1.4 h。研究表明,相同浓度下双甲脒的作用时间较短,毒性较强,依据各处理的累计致死率和处理时间,表明浓度变化对意大利蜜蜂的影响程度次序为双甲脒>甲酸。
剂量效应的斜率β 描述了假设存在的每个关键生物受体所接受的活性分子的平均数,可表示为杀虫剂对昆虫的毒力参数[24-25]。最早报道多种杀虫剂对昆虫的毒力参数估计范围的是Preisler等[21],为1.4~3.5。本研究中甲酸与双甲脒的剂量效应斜率β 值分别为1.98 和2.44,表明甲酸对意大利蜜蜂的毒性与常用化学杀虫剂双甲脒相当。TDM 模型剂量效应参数能充分证明生物测定数据的完整性和客观性,对生物测定有重要的理论和实践价值,在姜灵等[26]及王艳秋等[27]检测真菌类生物制剂杀虫效果的研究中均得到了很好的验证。本研究中,TDM 模型也可较好地反映出甲酸与双甲脒对意大利蜜蜂的致死效应。
在实际生产中,为使效果最大化,养蜂员常将甲酸和双甲脒药液雾化后再进行喷施[8,13,28],以扩大药剂在蜂箱内的扩散范围,但因此也增大了成年工蜂因清洁行为舔舐摄入杀螨剂的风险。目前多数杀螨剂使用说明书的推荐浓度均为1 mL 杀螨剂 : 1 000 mL 水 (大致相当于质量浓度 1 μg/mL)[8],但在实际使用中往往高于该浓度。从本研究结果(图1) 看,1.67 μg/mL 甲酸和双甲脒处理的累计致死率T50值分别为处理后12 h 和18 h,显著高于推荐质量浓度的累计致死率T50值 (分别为27 h和24 h),因此在田间使用甲酸和双甲脒防治意大利蜜蜂的狄斯瓦螨时,综合考虑杀螨剂对蜜蜂的致死率及对蜂螨的杀灭效果,建议药剂质量浓度最高不宜超过 1.67 μg/mL 。
