Q 型烟粉虱细胞色素P450 CYP6DV5 基因克隆及其在烟粉虱对噻虫嗪抗性中的作用
2021-02-05杨峰山危学高杜田华王少丽张友军
杨峰山, 殷 城, 杨 静, 危学高, 杜田华,杨 鑫, 王少丽, 张友军*,
(1. 黑龙江大学 生命科学学院,黑龙江省寒地生态修复与资源利用重点实验室,农业微生物技术教育部工程研究中心,黑龙江省普通高校分子生物学重点实验室,哈尔滨 150030;2. 中国农业科学院 蔬菜花卉研究所,北京 100081)
烟粉虱Bemisia tabaci 是一种世界性农业害虫,其寄主植物广泛,以直接取食植物汁液,分泌蜜露诱发煤污病以及传播植物病毒等方式危害农作物生长[1-2]。在与环境协同进化的过程中,烟粉虱被分化出数十种不同的生物型 (隐种),其中入侵性最强、危害最为严重的是B 型和Q 型烟粉虱。中国于20 世纪90 年代首次发现B 型烟粉虱,2003 年首次发现Q 型烟粉虱,随后Q 型烟粉虱大面积爆发,导致番茄病毒病大规模发生,造成了严重危害[3-6]。
目前烟粉虱的防治主要依赖于化学防治,尽管触杀型的杀虫剂对其成虫具有一定杀虫效果,但是对隐藏在植物叶片背面的若虫则防效不佳。噻虫嗪作为第二代新烟碱类杀虫剂,具有良好的触杀及内吸性杀虫效果,在世界范围内被大量用于烟粉虱、桃蚜和褐飞虱等刺吸式害虫的防治[7]。随着噻虫嗪长时间的使用,烟粉虱逐渐对其产生了严重的抗性[8-11]。自2007 年起,在中国境内的田间抗性监测中陆续发现烟粉虱对噻虫嗪产生了不同程度的抗性[12-13]。
昆虫对新烟碱类杀虫剂的抗性机制主要包括靶标抗性和代谢抗性,其中关于靶标抗性的报道主要有褐飞虱因乙酰胆碱受体α 亚基突变 (Y151S)[14]和蚜虫因乙酰胆碱受体β1 亚基突变 (R81T)[15],最终导致其对吡虫啉产生抗性。目前尚未见关于烟粉虱靶标抗性机制的报道。烟粉虱对新烟碱类杀虫剂的抗性主要为代谢抗性,如在烟粉虱对吡虫啉的抗性种群中发现,由于细胞色素P450 基因CYP6CM1 过量表达,使得烟粉虱将吡虫啉代谢成亲水性更强的羟基化吡虫啉,并且这种抗性机制在田间种群中也得到了广泛的验证[16-18]。
前期研究比较了对噻虫嗪抗性和敏感的烟粉虱种群间的一系列I 期和II 期解毒酶间的转录水平和蛋白水平的差异,其中包括细胞色素P450、UDP-葡萄糖醛酸转移酶、谷胱甘肽S-转移酶(GST) 和几种ABC 转运蛋白[19]。在细胞色素P450酶系数据中发现,相比于对噻虫嗪敏感的烟粉虱种群,细胞色素P450 基因CYP6DV5 在噻虫嗪抗性烟粉虱种群中显著过量表达,表明其很可能参与了烟粉虱对噻虫嗪抗性的形成。本研究对该基因进行克隆,分析了其在噻虫嗪抗性烟粉虱不同部位和不同发育阶段的相对表达量,并通过RNA干扰试验探究了其在烟粉虱对噻虫嗪产生抗性中的作用。研究结果将有助于揭示烟粉虱对噻虫嗪的抗性形成机制,并且为烟粉虱的综合治理提供理论基础。
1 材料与方法
1.1 供试材料
昆虫:Q 型烟粉虱来自于中国农业科学院蔬菜花卉所长期饲养的种群,寄主植物为棉花,温室饲养条件为温度 (25 ± 1) ℃、相对湿度70% ±5%、光照14 h (光照) : 10 h (黑暗)。其中噻虫嗪敏感种群长期无药剂接触史;噻虫嗪抗性种群通过噻虫嗪汰选获得,与噻虫嗪敏感种群相比,其对噻虫嗪的抗性倍数约为58.4 倍[20]。
1.2 供试试剂及仪器
1.2.1 药剂及试剂 噻虫嗪 (thiamethoxam) 原药(上海源叶生物科技有限公司);RNA 提取试剂Trizol (赛默飞世尔科技有限公司);cDNA 反转录试剂盒PrimeScript®RT reagent Kit (REAL TIME)(宝日医生物技术有限公司);荧光定量PCR 试剂盒SuperReal PreMix Plus (SYBR Green) (北京天根生化科技有限公司);dsRNA 合成试剂盒T7 RiboMAX Express RNAi system (普洛麦格生物技术有限公司);PCR 引物 (合成自北京擎科新业生物技术有限公司);PCR EsTaq with 6 × Loading Buffer MIX(北京康为世纪生物科技有限公司);DH5α 感受态细胞、PCR 产物纯化试剂盒、pEASY-T1 载体 (北京全式金生物技术有限公司),其他实验室常用化学试剂 (分析纯) 均为市售。
1.2.2 仪器 ABI7500 荧光定 PCR 仪;Bio-Rad S1000PCR 仪;Thermo Scientific Nanodrop 2000 分光光度计;Sigma 3K15 高速离心机;超纯水仪(ZMQ55VOTI Mini Q);分子实验用移液器(Eppendorf)。
1.3 试验方法
1.3.1 烟粉虱RNA 提取及cDNA 合成 用吸虫管从烟粉虱养虫笼中取50 头成虫于离心管中,经液氮速冻5 min 后使用Trizol 试剂参照试剂使用说明书提取总RNA。每个离心管内加入1 mL Trizol 和两粒小钢珠,于匀浆器中充分破碎。向离心管内加入200 μL 氯仿,漩涡振荡1 min,于冰上静置5 min,于 4 ℃、12 000 r/min 下离心 10~15 min。吸取上层清液400 μL 至新的离心管中,加入400 μL 预冷的异丙醇,轻轻上下颠倒混匀,于冰上静置10 min,再在4 ℃、12 000 r/min 下离心10 min。弃去上清液,加入体积分数为70%的乙醇1 mL 颠倒清洗,于4 ℃、8 000 r/min 下离心5 min。弃去上清液,将管内残余液体吸干,于超净台内晾置5 min。加入10 μL 焦碳酸二乙酯(DEPC) 水溶解,于冰上静置3 min 后进行OD260/OD280值和RNA 质量浓度测定。选择OD260/OD280值在1.9 以上、质量浓度高于200 μg/μL 的 RNA 进行反转录。
反转录参照TaKaRa 反转录合成试剂盒说明书合成cDNA,荧光定量样品RNA 反转总量为1 μg。
1.3.2 烟粉虱CYP6DV5 基因克隆 通过烟粉虱基因组序列[21]获得CYP6DV5 基因全长,利用Primer Premier 5.0 软件设计扩增引物CYP6DV5-F/R (表1),由生工生物工程股份有限公司合成。以烟粉虱cDNA为模板,反应体系:cDNA 1.0 μL, Taq 酶 mix 12.5 μL,Primers-F/R 0.5 mL, ddH2O 10.5 μL。PCR 反应程序:95 ℃ 预变性 5 min;95 ℃ 变性 30 s,60 ℃退火1 min,72 ℃延伸2 min,35 个循环;72 ℃最终延伸10 min。PCR 扩增产物用琼脂糖凝胶电泳检测后切下目的条带,用DNA 琼脂糖凝胶回收试剂盒进行胶回收,将产物连接到pEASY-T1 克隆载体上,然后转染进入DH5α 感受态细胞中,进行蓝白斑筛选,挑取阳性克隆,送北京擎科生物科技有限公司测序,结果在NCBI 上进行比较分析。
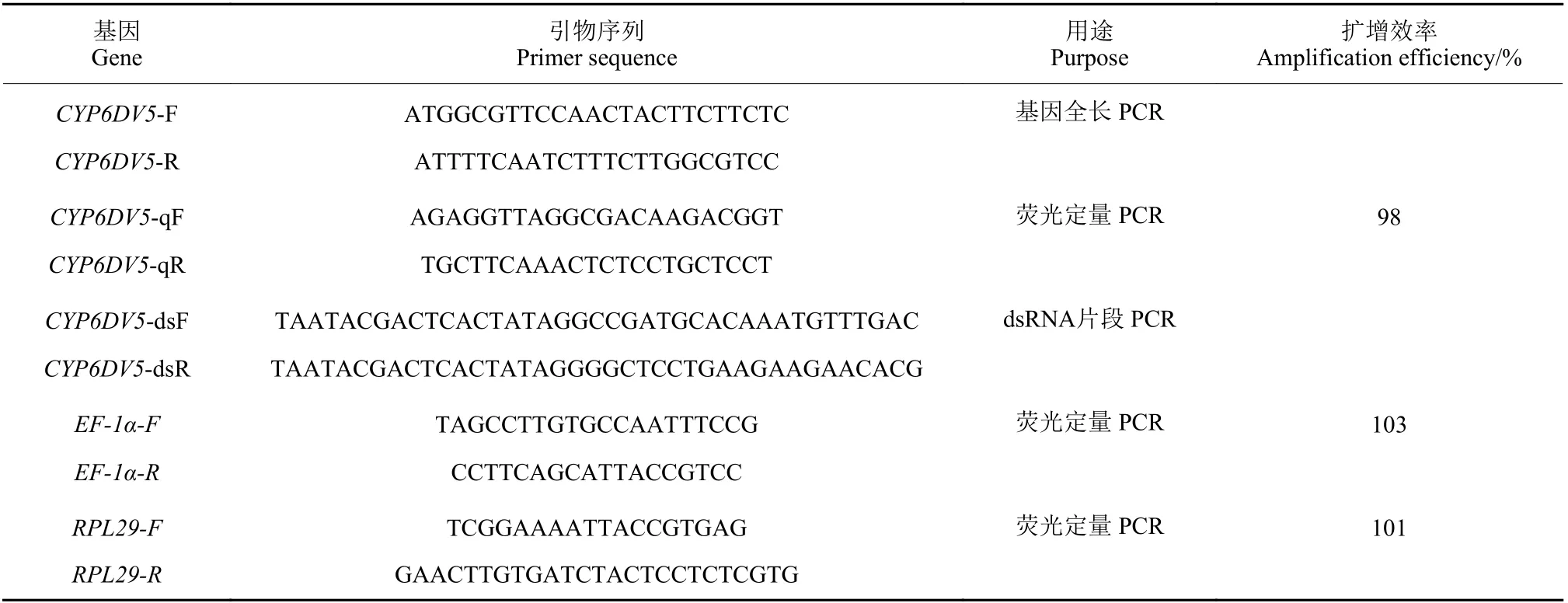
表1 本研究中所用引物Table 1 Primers used in this study
1.3.3 烟粉虱CYP6DV5 基因表达量分析 收集烟粉虱抗性种群的卵、1~4 龄若虫、成虫以及成虫的头、胸、腹部位,每个样品进行4 个生物学重复。
卵及若虫收集:显微镜下用毛刷刷下烟粉虱产在叶片上的卵,每个生物学重复约2 000 粒。显微镜下用挑针挑取烟粉虱若虫,1、2 龄若虫一起收集,每个生物学重复约200 头;3、4 龄若虫一起收集,每个生物学重复约100 头。
成虫收集:用玻璃管抓取单头烟粉虱成虫,在显微镜下辨别雌雄后分别收集,每个生物学重复约60 头。
成虫各部位收集:用玻璃管抓取单头烟粉虱成虫,在显微镜下用解剖针分解挑取烟粉虱的头部、胸部和腹部,立即放入装有Trizol 的离心管中。每个生物学重复分别为2 000、300 和100 头。
以上样品取样放入液氮中冷冻,−80 ℃保存。对取得的样品分别提取RNA。取1 μg 总RNA反转录合成cDNA,用于研究CYP6DV5 基因在烟粉虱不同发育阶段和部位的表达量差异。依据基因克隆得到的CYP6DV5 基因全长序列,设计筛选荧光定量PCR 引物CYP6DV5-qF/qR (表1),内参基因为烟粉虱延伸因子 (elongation factors-1α,EF-1α) 和核糖体蛋白L29(ribosomal protein L29,RPL29)。荧光定量PCR (qRT-PCR) 采用SYBR Green I 染料进行,20 μL 反应体系:2 × SuperReal PreMix Plus 10 μL, 10 μmol/L 上下游引物各 0.5 μL,50 × ROX Refernce Dye 0.4 μL, cDNA 模板 1.0 μL,RNAse-Free ddH2O 7.6 μL。反应条件:95 ℃ 预变性 10 min,95 ℃ 变性 15 s,60 ℃ 退火 30 s,72 ℃延伸30 s,40 个循环。荧光定量引物扩增效率模板采用3 倍梯度稀释,统计不同浓度下的Ct值,计算扩增效率,每个样品3 个生物学重复。根据2−ΔΔCt法[22]计算 CYP6DV5 基因在烟粉虱不同发育阶段和部位、以及在噻虫嗪抗敏烟粉虱种群中的表达量。
1.3.4 烟粉虱RNA 干扰 采用饲喂法进行烟粉虱RNA 干扰[20]。将双链RNA (dsRNA) 和营养液(30%的蔗糖和5%的酵母浸出物溶液) 混合配制成含dsRNA 的饲喂液。取一个两端开口的圆柱形玻璃管 (长5 cm,直径2 cm),将培养皿封口膜拉伸至尽可能地透薄,覆盖在玻璃管开口的一端,取配制好的双链RNA 营养液滴加在玻璃管封口端外侧封口膜上,再拉展一层封口膜覆盖在其上,使营养液均匀分布在两层封口膜中间。将封好营养液的玻璃管的另一开口端扣在饲养烟粉虱的叶片上,轻轻拍动叶片使烟粉虱自然飞入管内,每管取40~50 头,取完后用封口膜将开口端封住。利用烟粉虱的趋光性,将营养液端以外的玻璃管身用黑色塑料壳覆盖,仅留营养液端向光放置在培养箱内,让烟粉虱集中在营养液端取食,温度(25 ± 1) ℃、相对湿度 70% ± 5%、光照 14 h (光照) :10 h (黑暗)。双链 RNA 饲喂质量浓度为 0.5 μg/μL,饲喂量为每个饲喂小袋100 μL,每个处理3 个生物学重复。48 h 后取出烟粉虱,提取其RNA,反转录后进行qRT-PCR 以测定目的基因的干扰效率。
1.3.5 烟粉虱噻虫嗪敏感性测定 在噻虫嗪抗性烟粉虱体内敲低CYP6DV5 基因后,对其进行噻虫嗪敏感性测定。其中烟粉虱成虫敏感性测定参考Feng 等[23]的叶片浸药法。试验分为6 个质量浓度的药剂处理组以及1 组空白对照,每个质量浓度4 个生物学重复,添加曲拉通以便使药剂在叶片上有更好的附着效果。药剂处理组使用蒸馏水、二甲基亚砜 (DMSO)、噻虫嗪原药和0.01%的曲拉通溶液配制,对照组使用蒸馏水和0.1‰的曲拉通溶液配制。指形管底部铺上2%的琼脂,凝固后待管壁水蒸气晾干,将预先打取的棉花叶片浸药10 s,晾干后轻轻放于玻璃管中琼脂上,每管接入烟粉虱成虫20~30 头,用棉塞封口。整个装置倒置于培养箱中,温度 (25 ± 1) ℃、相对湿度70% ±5%、光照14 h (光照) : 10 h (黑暗)。统计测定结果时,轻轻拍打管壁,观察烟粉虱生存情况,用昆虫针拨动烟粉虱,以无活动迹象记为死亡。
1.4 数据分析
试验数据均采用SPSS 19.0 软件进行统计学分析,不同发育阶段,成虫不同部位以及噻虫嗪抗性、敏感之间的基因表达量均采用单因素方差分析,诱导后的基因表达量变化应用Tukey 法进行多重比较分析。
2 结果与分析
2.1 烟粉虱CYP6DV5 基因的克隆及其序列分析
分别以噻虫嗪抗性、敏感烟粉虱cDNA 为模板,通过PCR 获得1 527 bp 的CYP6DV5 基因的全长ORF 序列 (图1),该长度与基因组序列一致。将对噻虫嗪抗性与敏感的烟粉虱CYP6DV5 基因ORF 序列进行比对后,未发现两者间存在差异位点。进一步分析后发现,烟粉虱CYP6DV5 基因编码509 个氨基酸,分子质量为58.71 kDa,等电点为6.13,具有细胞色素P450 基因的保守结构域:C-helix (W × × × R) 结构域 (51-55)、Hemebinding 结构域 (369-379)、Oxygen-binding 结构域(176-180) 以及 P × × F × P 结构域 (345-350),属于典型的昆虫P450 基因 (图2)。
2.2 CYP6DV5 基因在噻虫嗪抗性烟粉虱不同发育阶段和部位的表达量
应用荧光定量PCR 分析CYP6DV5 基因在噻虫嗪抗性烟粉虱不同龄期的表达情况,结果如图3A所示,CYP6DV5 基因在噻虫嗪抗性烟粉虱卵期表达量最低,若虫阶段有一定的表达量,成虫期的雄性和雌性个体表达量最高;不同部位表达如图3B 所示,该基因在噻虫嗪抗性烟粉虱腹部表达很少,主要集中在头部和胸部表达。
2.3 噻虫嗪抗性及敏感品系的CYP6DV5 表达量分析
通过检测室内饲养的Q 型烟粉虱敏感种群以及相应筛选的噻虫嗪抗性种群,发现该基因在噻虫嗪抗性种群中的表达量为敏感种群的2.95 倍,差异极显著 (图4A)。进一步用50 mg/L 的噻虫嗪对抗性种群进行杀虫剂诱导试验,结果如图4B所示,随着接触噻虫嗪时间的延长,细胞色素CYP6DV5 基因的表达量显著上调。
2.4 RNA 干扰后烟粉虱CYP6DV5 基因的表达量及其对噻虫嗪敏感性变化
CYP6DV5 基因在噻虫嗪抗性烟粉虱种群中过量表达,对于该基因在烟粉虱对噻虫嗪抗性中发挥的作用需要进一步研究。通过RNA 干扰的方法敲低该基因在噻虫嗪抗性烟粉虱体内的表达量,对其饲喂 0.5 μg/μL 的 dsCYP6DV5 营养液 48 h后,用荧光定量PCR 检测发现该基因在烟粉虱成虫体内表达量减少了39% (图5 A)。在敲低该基因在噻虫嗪抗性烟粉虱体内的表达量后,在50 和100 mg/L 的噻虫嗪处理条件下,测定RNAi 后的烟粉虱对噻虫嗪敏感性变化。结果显示,50 和100 mg/L 噻虫嗪处理组中,dsGFP 组死亡率分别为26.79%和52.17%,dsCYP6DV5 组死亡率分别为56.12%和70.66%,dsCYP6DV5 组死亡率显著高于 dsGFP 组。(图 5 B)。
3 讨论
噻虫嗪作为第二代新烟碱类杀虫剂,于21 世纪初在中国推广使用,由于其良好的杀虫效果而得以大量推广,但是靶标害虫的抗药性问题也随之而来,其中烟粉虱作为噻虫嗪重要的靶标防治害虫,也产生了严重的抗药性,特别是以逐渐取代B 型烟粉虱进而在中国大面积爆发的Q 型烟粉虱抗药性最为严重。尽管Q 型烟粉虱在抗药性能力方面比B 型烟粉虱强[24],但关于Q 型烟粉虱对于主要防治药剂的抗药性机制却知之甚少。在前期室内筛选的噻虫嗪抗性机制研究中发现,细胞色素P450 基因参与了烟粉虱对噻虫嗪抗性的形成[25],随后对噻虫嗪抗性、敏感品系进行的转录组测序研究结果表明,细胞色素P450 基因、谷胱甘肽S-转移酶 (GST) 基因等解毒酶基因在噻虫嗪抗药性形成机制中发挥重要作用[26],在此基础上通过定量分析发现了一个CYP4-like 基因可能参与了烟粉虱对噻虫嗪抗性的形成[25]1,并且进一步通过验证GST 基因功能,发现了GST14 也可能与其对噻虫嗪的抗性形成有关[18]1。
本论文在前期研究基础上进一步通过对噻虫嗪抗性、敏感品系烟粉虱的定量PCR 分析,发现P450 基因CYP6DV5 在对噻虫嗪产生抗性的烟粉虱成虫阶段具有高表达,说明该基因可能参与了烟粉虱成虫阶段对噻虫嗪抗性的形成;同时CYP6DV5 基因在烟粉虱成虫头部的表达最为丰富,表明该基因可能在头部行使功能。另外,随着烟粉虱接触噻虫嗪时间的增加,其体内CYP6DV5基因相对表达量也逐渐升高,表明该基因具有对噻虫嗪的响应机制,可能与噻虫嗪的瞬时解毒代谢相关,最终的RNA 干扰也表明,该基因被敲低后显著提高了烟粉虱对噻虫嗪的敏感性,本研究证明了CYP6DV5 基因可能与烟粉虱对噻虫嗪抗性的形成有关。
烟粉虱作为寄主广泛的刺吸式害虫,在进化过程中形成了数量众多的细胞色素P450 基因,对于这些基因具体的功能以及相应的调控机制等有待深入研究,特别是田间烟粉虱环境复杂,形成抗药性的机制也很复杂,需要通过一系列的研究才能最终揭示烟粉虱对杀虫剂的抗药性及其调控机制,为田间烟粉虱抗药性水平的监测、合理使用杀虫剂以及高效防治烟粉虱提供技术支撑。
