大熊猫轮状病毒可视化LAMP 检测技术的建立及应用
2021-02-05蒋金蓁张白玉杨锐颜其贵
蒋金蓁,张白玉,杨锐,颜其贵
(四川农业大学动物医学院,四川 成都 611130)
王成东等[1]从大熊猫粪便中分离出1 株A 组轮状病毒(rotavirus,RV),命名为大熊猫轮状病毒(GPRV) CH-1 株。GPRV 主要感染幼龄大熊猫(5~11月龄),引起幼龄大熊猫腹泻甚至死亡。由于成年动物感染RV 多为隐性经过,并持久地向外界排毒,RV 对环境因子和许多常见消毒剂有较强抵抗力,导致某一地方发病,随后每年会连续发生[2],这对大熊猫的繁育、健康及野化放归带来重大威胁。
目前,针对GPRV 已建立常规PCR[3]及荧光定量PCR[4]检测方法,具有特异、敏感、高通量等特点。曾杨茹等[5]使用上述2 种方法对2011、2012、2013、2015 年的共 227 份大熊猫粪便 GPRV 携带情况进行检测,利用荧光定量 PCR 检出阳性率为11%,而常规 PCR 检出阳性率仅为 6.6%。及早发现GPRV 感染,更早接受治疗,可降低病毒传播和死亡风险[6]。荧光定量PCR 对设备及实验条件要求过高,不能广泛推广;因此,加强对GPRV 感染的监测和开发简单、快速、高灵敏度的实验室诊断方法是当务之急。
环介导等温扩增(loop-mediated isothermal amplification,LAMP)技术是在等温(60~65 ℃)条件下,由2 对特异性引物针对靶基因的6 个不同区域进行特异性识别,在 DNA 聚合酶的作用下,短时间(通常少于1 h)内进行核酸扩增,其结果可直接肉眼观察[7-8]。研究[9]发现,在 LAMP 反应中加入环引物,能明显加快扩增速度,提高检测效率。本研究中,笔者根据GPRV CH-1 株VP4 基因设计引物,建立GPRV 可视化LAMP 方法,并对其反应条件进行优化,以期利用 LAMP 方法快速、有效的诊断GPRV 的早期感染和隐性感染。
1 材料与方法
1.1 供试病毒株
供试的 GPRV CH-1 株、大熊猫犬瘟热病毒(CDV)、犬细小病毒(CPV)均由四川农业大学动物医学院动物微生物与免疫研究室分离和保存。
1.2 引物设计与合成
参照GenBank 中GPRV VP4 基因保守区域序列(登录号为 HQ641296),使用 Primer Explorer V4(http://primerexplorer.jp/lamp4.0.0/index.html)设计 3对LAMP 引物。具体引物信息列于表1。选取VP4基因上的2 段高度保守序列设计常规PCR 引物。上游引物为5'-TGGCTTCGCTCATTTATAGACA-3',下游引物为 5'-TTGTGTCTGTGACGTATTCT-3',产物长度为409 bp。引物由成都擎科生物技术有限公司合成。

表1 LAMP 扩增引物序列Table 1 The primers for LAMP
1.3 病毒基因组RNA 的提取和反转录
按照MAGEN 病毒RNA 提取试剂盒操作说明书,提取GPRV 的总RNA,置于-80 ℃保存。按照宝生物(Takara)反转录试剂盒说明书制备cDNA。
1.4 LAMP 方法的建立
采用25 μL 体系扩增,其组分和终浓度分别为1×Isothermal Amplification Buffer( 纽 英 伦 ) 、1×LAMP 可见光染料(天恩泽)、0.2 μmol/L F3 和 B3,1.6 μmol/L FIP和BIP、0.4 μmol/L Loop F和Loop B、8.0 mmol/L MgSO4(纽英伦)、1.6 mmol/L dNTPs(纽英伦)、8 U Bst DNA 聚合酶(纽英伦)、0.4 mol/L 甜菜碱、1 μL cDNA 模板,加 ddH2O 至 25 μL。以MA104 细胞RNA 为阴性对照和ddH2O 为空白对照同时进行反应。反应温度为65 ℃,反应时间为40 min。反应结束后,80 ℃加热2 min 终止反应。同时,用2%琼脂糖凝胶电泳分析扩增产物。
1.5 LAMP 反应条件的优化
在其他条件不变的情况下,分别调整LAMP 反应体系中Mg2+终浓度为2、4、6、8、10 mmol/L,或甜菜碱终浓度为0.0、0.2、0.4、0.6、0.8 mol/L,或Bst DNA 聚合酶终浓度为4、8、12、16 U,或反应温度为 60、61、62、63、64、65 ℃进行扩增。反应结束后,各取5 μL 进行电泳鉴定,依据条带的清晰度确定Mg2+、甜菜碱和Bst DNA 聚合酶的最佳反应浓度及最佳反应温度。
1.6 特异性和重复性检测
分别以GPRV、CDV、CPV 为模板,采用建立并优化的LAMP 方法进行检测,检验其对GPRV 的特异性。选择高(50 ng/μL)、中(5 ng/μL)、低(0.5 ng/μL)3 个不同浓度的病毒RNA 为模板,进行批内及批间试验,评估该方法检测GPRV 试验的重复性和稳定性。每个样品重复10 次。
1.7 灵敏性检测
为确定LAMP 的最低检测限度,先用分光光度计测定GPRV 的RNA 浓度;再通过10 倍倍比稀释,将 RNA 稀释成 50、5、5×10-1、5×10-2、5×10-3、5×10-4、5×10-5、5×10-6、5×10-7ng/μL 共 9 个梯度浓度;按优化的LAMP 体系进行反转录;扩增结束后,分别进行可见光染料颜色变化观察及 2%琼脂糖凝胶电泳扩增产物。
用分光光度计测定GPRV 的cDNA 浓度,再通过10 倍倍比稀释,将cDNA 稀释10 个梯度浓度。按优化的 LAMP 体系,对 10-6、10-7、10-8、10-9、10-10的 5 个梯度浓度的 GPRV cDNA 进行 LAMP扩增。同时,利用常规PCR 引物,对10-6、10-7、10-8、10-9、10-10的 5 个梯度浓度的 GPRV cDNA进行常规PCR 检测。常规PCR 检测采用25 μL 体系进行扩增,其组分和用量为 1×T3 PCR Mix 22 μL(擎科)、上下游引物(10 μmol/L)各 1 μL、cDNA模板1 μL。常规PCR 检测扩增程序为:98 ℃预变性 2 min;98 ℃循环变性 10 s,55 ℃退火 15 s,72 ℃延伸15 s,34 个循环;72 ℃末延伸2 min;4 ℃保存。扩增结束后,各取5 μL 扩增产物进行2%琼脂糖凝胶电泳,观察结果。
1.8 临床样品检测
利用优化好的LAMP 方法及常规PCR 方法,对50 份大熊猫腹泻粪便样本进行GPRV 病原检测,以GPRV CH-1 株作为阳性对照,ddH2O 作为阴性对照。采用荧光定量PCR 方法[6]验证。
2 结果与分析
2.1 采用LAMP 方法检测GPRV 的结果
图1-a 所示,以GPRV CH-1 株cDNA 为模板的扩增结果出现大小不同的梯状条带,而阴性对照(MA104 细胞)和空白对照(ddH2O)没有任何条带。图1-b 所示,以GPRV CH-1 株cDNA 为模板的阳性扩增样品的颜色从紫色变为蓝色,而阴性对照和空白对照未见颜色变化。

图1 LAMP 方法检测GPRV 的结果Fig.1 The results of GPRV detected by LAMP
2.2 LAMP 反应条件的优化结果
图2 所示,当Mg2+浓度为2、4 mmol/L 时,无法实现目的基因的扩增;当Mg2+浓度为6 mmol/L时,梯状条带不清晰,扩增效率较低;当Mg2+浓度为8、10 mmol/L 时,条带清晰,扩增效果达到最佳。可见,最适Mg2+浓度为8.0 mmol/L。

图2 LAMP 方法的反应体系中不同Mg2+浓度的电泳结果Fig.2 The electrophoresis results of different concentrations of Mg2+ in the LAMP reaction system
图3 所示,不添加甜菜碱时也能出现较明显的扩增条带。当甜菜碱浓度为0.2、0.4 mol/L 时,其梯状条带比不添加甜菜碱更弱,其扩增效率更低,这可能是低浓度甜菜碱对 LAMP 反应有一定的抑制作用;随后,随着甜菜碱浓度的增加,扩增效率提高,条带清楚明亮,在甜菜碱浓度为 0.6 mol/L时,比甜菜碱浓度为0.8 mol/L 和不添加时更清晰,但无法说明高浓度甜菜碱对LAMP 反应有影响。可见,最适甜菜碱浓度为0.6 mol/L。

图3 LAMP 方法的反应体系中不同甜菜碱浓度的电泳结果Fig.3 The electrophoresis results of different concentrations of betaine in the LAMP reaction system
图4 所示,Bst DNA 聚合酶对LAMP 扩增的影响不大,低浓度酶扩增的条带与高浓度酶扩增的条带相差不大,但为了保证扩增效率,选择终浓度12 U 为最适Bst DNA 聚合酶浓度。
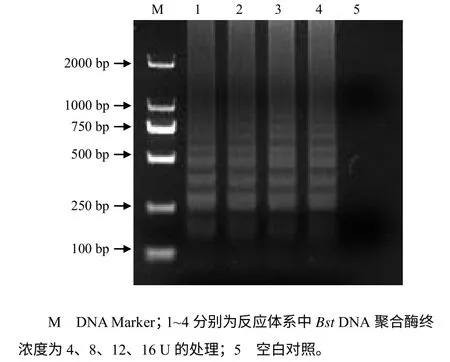
图4 LAMP 方法的反应体系中不同Bst DN A 聚合酶浓度的电泳结果Fig.4 The electrophoresis results of different concentrations of Bst polymerse in the LAMP reaction system
图5 所示,在60~65 ℃时,均能发生扩增,62℃时,扩增出的梯状条带较其他温度的扩增条带更清晰明亮。选择62 ℃为最适反应温度。

图5 LAMP 方法的不同反应温度的电泳结果Fig.5 The electrophoresis results of different temperature in the LAMP reaction system
经过对LAMP 反应体系的条件优化,其最佳反应条件为:25 μL 体系的组分和终浓度分别为1×Isothermal Amplification Buffer、1×LAMP 可见光染料、0.2 μmol/L F3 和 B3、1.6 μmol/L FIP 和 BIP、0.4 μmol/L Loop F 和 Loop B、1.6 mmol/L dNTPs、8.0 mmol/L MgSO4、0.6 mol/L 甜菜碱、12 U Bst DNA 聚合酶、1 μL cDNA 模板,加 ddH2O 至 25 μL;反应温度为62 ℃;反应时间为40 min;反应结束后80 ℃加热2 min 终止反应。
2.3 供试方法的特异性和重复性
由图6 可知,只有在GPRV cDNA 为模板时,才会出现有梯状条带的阳性扩增。可见,所建立的LAMP 方法特异性良好。重复性试验显示,批内及批间的变异系数均小于 1%,说明该方法的重复性好,可进行稳定、可靠的检测。

图6 LAMP 方法的特异性检测结果Fig.6 The result of specific detection of LAMP
2.4 供试方法的灵敏性
从图7 可知,LAMP 方法能检测到的最低RNA浓度为5×10-5ng/μL,管中颜色变化明显,与凝胶电泳结果一致(图 8)。图 9 所示,LAMP 方法能扩增稀释到10-9梯度浓度的cDNA,而常规PCR 方法仅能扩增稀释到10-7梯度浓度的cDNA。该结果表明,LAMP 方法的灵敏性较常规PCR 方法高约100 倍。

图7 LAMP 方法的最低检测限测定可视化结果Fig.7 The visual results of the minimum detection of LAMP

图8 LAMP 方法的最低检测限测定电泳结果Fig.8 The el ectrophoresis results o f t he minimum d etection o f LAMP

图9 LAMP 方法和常规PCR 方法的灵敏度检测结果Fig.9 The result of sensitivity of LAMP and PCR
2.5 LAMP 方法的应用
对 50 份大熊猫粪便样本进行 RV 检测,常规PCR 检测到阳性样本17 份,阳性率为34%;LAMP检测到阳性样本22 份,阳性率为44%;LAMP 方法比常规PCR 方法多检出5 份阳性样本。荧光定量PCR 方法检测到阳性样本22 份,LAMP 方法的检测结果与其吻合度为100%。
3 结论与讨论
本研究中,在优化LAMP 方法检测GPRV RNA的4 个反应因素中,Mg2+浓度对该方法的影响最大。当Mg2+浓度小于6 mmol/L 时,靶基因无法扩增。这主要是由于 Mg2+在反应中的作用是形成dNTP-Mg 络合物与核酸骨架相互作用,稳定碱基形成中的中间体,影响Bst 聚合体[10-11]。甜菜碱在LAMP 反应中不是绝对必要的,不添加甜菜碱的扩增带比添加低浓度甜菜碱的扩增带更清晰,但随着甜菜碱浓度的增加,当浓度达到0.6 mol/L 时得到了合适的扩增。然而,由于甜菜碱对酶的活性有稳定作用,这也增强了反应的特异性[12],所以在LAMP 反应体系中加入0.6 mol/L 甜菜碱。Bst DNA聚合酶的浓度对反应影响不大,低浓度的酶也能扩增出清晰的条带,与高浓度时的条带无明显差异。为保证加样的准确性和扩增效率,在LAMP 反应体系中加入12 U Bst DNA 聚合酶。与常规PCR 不同,温度对LAMP 的影响不是对核酸的影响,而是对Bst聚合酶的影响[13]。在60~65 ℃时均可产生扩增条带,适用于温度控制较差的地区。
本研究建立的 LAMP 反应对大熊猫感染的犬瘟热病毒、细小病毒等无交叉反应,只能扩增出RV。可见,LAMP 方法对RV 基因组有高度特异性。LAMP 反应灵敏度高,RV RNA 的检测限为5×10-5ng/μL,其灵敏度是常规 PCR 的 100 倍。虽然 LAMP的高灵敏度使其易受气溶胶诱导的假阳性,但为了避免二次开盖污染的风险,选择 LAMP 可见光染料,可直接添加到反应体系中,颜色的变化可直接用肉眼观察。对50 份大熊猫粪便样本的RV 携带情况检测发现,常规PCR 和LAMP 均检测到的阳性样本17 份,另有5 份样本仅使用LAMP 检测到阳性;使用荧光定量 PCR 对样本进行验证,LAMP方法与其阳性吻合度为 100%。可见,LAMP 方法比常规PCR 方法更适合GPRV 的初步诊断和监测。
LAMP 方法加热过程简单,不需要热循环器,使用传统的水浴锅即可完成扩增;可直接观察反应结果,不需要电泳,不需要紫外线,检测时间大大缩短,且用于检测的仪器和试剂价格低廉。虽然荧光定量PCR 技术的敏感性高于LAMP 技术,但由于荧光定量PCR 技术的设备和试剂成本较高,在大规模疾病暴发中难以推广。在野生大熊猫轮状病毒监测中,LAMP 技术由于其设备要求低、灵敏度高,可更快速、方便地投入使用。
综上所述,本研究开发的检测GPRV 的LAMP方法较常规PCR 方法灵敏度更高,检测时间更短;较荧光定量PCR 方法成本低廉,设备简单,可通过肉眼直接观察结果。基于此,LAMP 方法可作为快速检测大熊猫轮状病毒的有效工具,甚至可用于野生大熊猫轮状病毒的监测。
